电解法处理有色有机废水
——介绍一个物理化学综合设计实验
邓媛
(武汉大学化学与分子科学学院 湖北武汉 430072)
电解法处理有色有机废水
——介绍一个物理化学综合设计实验
邓媛
(武汉大学化学与分子科学学院 湖北武汉 430072)
介绍电解法处理有色有机废水这样一个新的物理化学设计实验,详细阐述了实验原理、实验装置的搭建和实验操作方法,主要探讨了电流密度、电解时间、辅助电解质浓度等技术参数对槽压和有机物转化率的影响,并介绍了该实验的开设模式和实践情况。
电催化氧化 槽压 转化率 物理化学设计实验
在实验教学中加入综合性设计实验,是适应现代创新型人才培养目标的必然举措。然而,物理化学实验因其本身的学科特点,需要较多地依赖于部分专用仪器与设备。而受到仪器设备台套数少和学生人数多的限制,设计实验的内容在创新和变革上存在较大的难度。选择部分科技含量高、综合实用性强且对实验仪器设备要求较低的实验作为设计实验,是以上问题的有效解决途径。电解法处理有色有机废水是近年来广泛应用于现代工业废水处理的一项较为热门的研究课题[1-3],该方法操作简便、易于控制、无二次污染,且实验材料与设备相对简单,是一个适合在教学实验室向大多数学生开设的综合设计性实验。
1 实验目的
(1) 初步理解并掌握电催化氧化技术的基本原理与操作方法。
(2) 了解电解装置的基本结构并掌握搭建电解装置的基本方法。
(3)了解电解技术中的重要基本技术参数的意义,学习自主设计实验方法测定参数,并探究各种不同因素对电解的影响。
2 实验原理
电催化氧化法是工业上处理有机废水的一种常用方法,其降解有机物的过程较为复杂,多数研究者认为[4-5],在该过程进行时,可在高析氧电位的阳极表面形成具有强氧化性的羟基自由基(·OH ),其标准电极电势为2.80 V,氧化能力仅次于F2(2.87 V)。羟基自由基在反应中作为链引发剂,诱导自由基反应发生,将难降解的有机物氧化成CO2、H2O和其他产物,反应机理大致如图1所示[6-9]。

图1 电催化氧化机理
该方法具有氧化能力强、操作简便、易于控制、无二次污染等优点,在现代工业废水处理中得到越来越广泛的应用。
在电解技术中,影响电解效果的主要因素有电极材料、电极面积、电解时间、辅助电解质浓度等。电解效果通常通过槽压、甲基橙的转化率等技术指标来反映。
本实验采用电催化氧化法处理甲基橙溶液,阳极采用氧化性极强的且具有高析氧电位的PbO2/Ti电极[10-12],主要探讨电流密度、电解时间、辅助电解质浓度对电解槽压和甲基橙转化率的影响。本技术通常采用恒电流电解,电流密度可通过设备控制,槽压可由直流稳压电源实时监测。由于甲基橙为有色物质,在碱性条件下,于波长460 nm处有最大吸光度,故甲基橙的实时转化率可采用分光光度法测定。计算公式如下:

式中A0为电解前溶液的吸光度,A为电解过程中某时刻溶液的吸光度。
3 仪器与试剂
3.1 仪器
DH1718E-4型直流跟踪双路稳压稳流电源(32 V/3 A)、SZCL-2A数显智能控温搅拌器、VIS-7220可见分光光度计、电子天平、电解槽(20 cm × 10 cm × 15 cm,容量1.0 L)、铜电极(9.0 cm × 4.5 cm × 0.30 cm)、PbO2/Ti电极(9.0 cm × 3.0 cm × 0.10 cm)、磁子、秒表。
3.2 试剂
无水硫酸钠(分析纯),0.0025 g/L甲基橙溶液。
4 实验步骤
4.1 设计搭建电解装置
按图2搭建电解装置,电极板阳极为PbO2/Ti电极,阴极板为铜电极。固定两个电极板在电解槽中的横向和纵向位置,以固定电极间的相互距离及电极浸入电解液的深度。加入1.0 L电解液,用直尺测定阳极板的浸入深度,计算阳极的有效面积。阴极的铜电极浸入深度应大于阳极。两极板分别通过铜线接入直流电源的正负极。

图2 电解装置示意图
4.2 电解相关参数的测定
(1)打开磁力搅拌器和直流跟踪双路稳压稳流电源开关,设置为恒流电解。向电解槽内加入1.0 L不含辅助电解质的0.0025 g/L甲基橙溶液为电解液,固定某个电流值不变,向电解液内定量加入无水硫酸钠粉末,观察并记录稳压稳流电源上显示的槽压数值,绘制槽压与辅助电解质无水硫酸钠浓度之间的关系曲线,确定辅助电解质的最佳加入量。
(2)重新向电解槽内加入1.0 L含辅助电解质的0.0025 g/L甲基橙溶液为电解液,设置不同电流密度值进行恒电流电解,记录槽压,并绘制电流密度与槽压关系曲线。
(3)设置某个电解电流值,电解含辅助电解质的0.0025 g/L甲基橙溶液直至肉眼观察电解液明显退色或近似无色。在电解过程中,每隔3~5 min测定槽压,并观察温度变化。绘制电解时间与槽压的关系曲线。
(4)在电解前,从电解槽中取1.00 mL电解液,经过适当稀释后,测定其吸光度。设置某个电流值进行电解,记录时间,每电解5 min,从电解槽中取1.00 mL电解液,经过适当稀释后,测定其吸光度;电解约30 min。然后改变电流值的大小,重复上述操作。根据上述结果,绘制甲基橙转化率与电流密度、甲基橙转化率与电解时间之间的关系曲线。
4.3 甲基橙溶液最大吸收波长的确定及工作曲线的绘制
(1)分别移取0.50 mL、1.00 mL、2.00 mL、3.00 mL、4.00 mL、5.00 mL、6.00 mL、7.00 mL、8.00 mL、9.00 mL的0.0025 g/L甲基橙溶液至25 mL容量瓶中,稀释至刻度并摇匀。
(2)以蒸馏水为参比,使用分光光度计测量0.00050 g/L甲基橙溶液在不同波长入射光下的吸光度,确定最大吸收波长。
(3)在最大吸收波长下,测定按上述步骤配置的不同浓度甲基橙溶液的吸光度,并绘制工作曲线。
5 结果与讨论
5.1 甲基橙溶液最大吸收波长及工作曲线
(1)甲基橙作为酸碱指示剂,在酸性条件下和碱性条件下颜色不同,因此最大吸收波长也会随溶液pH不同而有所差别。本实验电解液的溶剂为去离子水,辅助电解质为无水硫酸钠,均为中性,pH在7左右,应显碱式色。然而学生在实验中发现,已电解较长时间的甲基橙溶液,其最大吸收波长相对于电解前有少量增大,这可能是因为在甲基橙的电解过程中会生成CO2,从而使电解液的pH减小;而pH越接近甲基橙的变色范围,pH的少量变化引起的最大吸收波长变化越大。因此,可在测定吸光度前,向待测溶液中加入少量NaOH固体,使pH大于7。此条件下测得的最大吸收波长为460 nm。
(2)确定460 nm的最大吸收波长后,在此波长下,测量已经配制好的不同质量浓度甲基橙标准溶液的吸光度,可得如图3所示的甲基橙工作曲线。由图3可以看出,在460 nm下,甲基橙质量浓度与吸光度有良好的线性关系。

图3 最大吸收波长(460 nm)下标准溶液质量浓度与吸光度关系图(工作曲线)
5.2 辅助电解质浓度、电流密度和电解时间对槽压的影响
5.2.1 辅助电解质浓度对槽压的影响
改变电解槽中加入的辅助电解质Na2SO4的质量浓度,在电流密度一定的条件下进行恒流电解,记录槽压的变化,可得到如图4所示的槽压与辅助电解质质量浓度之间的关系曲线。
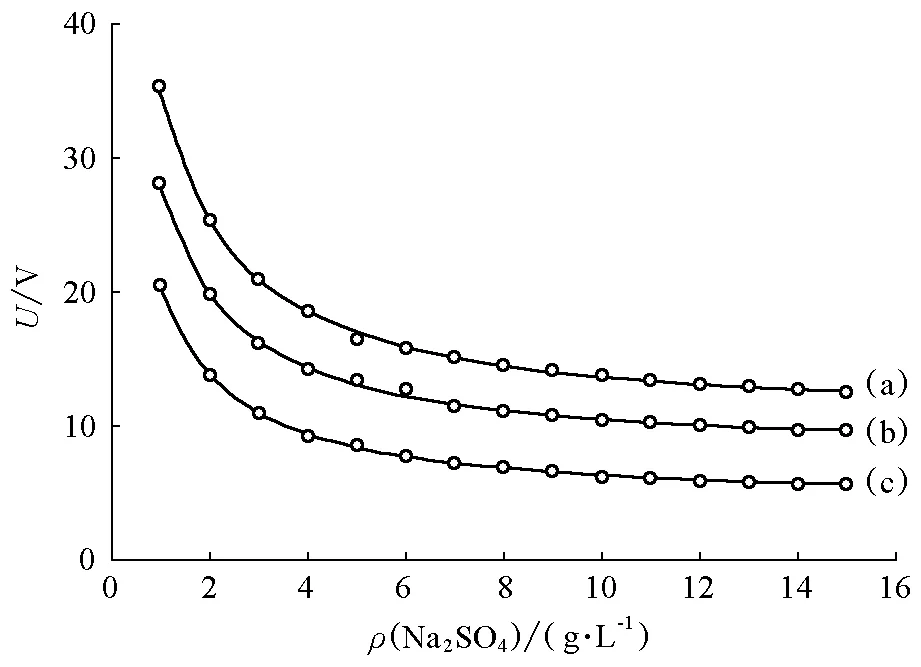
图4 槽压随辅助电解质硫酸钠质量浓度变化曲线电流密度为:(a)35 mA/cm2; (b)21 mA/cm2; (c)15mA/cm2
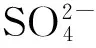
5.2.2 电流密度对槽压的影响
保持辅助电解质浓度和电极面积一定,改变电流密度进行恒流电解,将得到如图5所示的槽压与电流密度关系图。图5显示槽压与电流密度呈线性关系,说明本实验中的电解液内阻较大,电流密度的增加将导致槽压显著增大,而这将大大增加电解过程中的能耗,这也是该技术的一个缺陷。
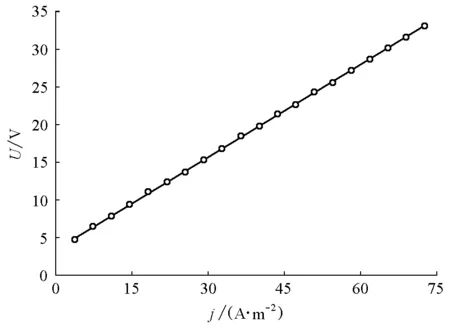
图5 槽压随电流密度变化图辅助电解质质量浓度为7.0 g/L
5.2.3 电解时间对槽压的影响
保持电流密度值一定,电解一段时间至电解液颜色显著变浅,测定槽压随时间变化的曲线。由于该步骤的实验时间较长,学生在进行该步骤时为分组进行,综合其实验结果可得到如图6所示的不同电流密度下槽压随电解时间变化曲线。
图6 不同电流密度下槽压随电解时间变化曲线电流密度为: (a)43.5 mA/cm2; (b)52.8 mA/cm2; (c)68.2 mA/cm2; (d)75.4 mA/cm2
从初始状态至甲基橙溶液颜色变浅,绝大多数学生的电解时间为40~60 min。从图6可知,在电解过程中,槽压均随电解时间的推移而降低,且电流密度越大,槽压下降得越明显;另外,槽压初始时降低得较快,在电解一段时间后,槽压降低的速度变缓。槽压随时间降低的原因可能是: ① 在电解过程中,一部分水会被电解,通过对电解前后电解液体积的测量,经过40~60 min的电解过程,电解液体积减少了5~6 mL。水的电解导致电解液中辅助电解质浓度增大,电解液电阻率减小,槽压下降。② 电解液温度变化。由于电解液存在较大内阻,电解过程中一部分电能转化为热能损耗,导致电解液温度有所上升,而使电解液内离子迁移率提高,从而提高了导电性,导致槽压降低。温度升高可能是槽压降低的主要原因。在相同时间内,电流密度较大(大于50 mA/cm2)时,电解前后温度升高较大(5~6 ℃);电流密度较小(小于50 mA/cm2)时,电解前后温度升高较小(2~4 ℃)。因此,电流密度较大时,槽压降低得较多。电解初期温度上升较快,槽压降低速度也较快;而温度升高带来散热速度的加快,因此温度上升速度的降低也导致槽压降低速度的变缓。值得注意的一个现象是,每条曲线的最后1~2个点显示出槽压有加速降低的趋势,这可能是因为在电解后期,电解液的颜色已经明显变淡,即电解液内甲基橙的含量已显著减少,因此电能有更多的部分被消耗于水的电解和产生热量,从而导致槽压进一步降低。
5.3 电流密度和电解时间对甲基橙转化率的影响
5.3.1 电流密度对甲基橙转化率的影响
在阳极电极板有效面积为13.8 cm2、Na2SO4辅助电解质的质量浓度为9.0 g/L条件下,使用不同电流密度进行恒流电解,比较甲基橙转化率(图7)。

图7 不同电流密度下的甲基橙转化率
由图7可知,甲基橙转化率随电流密度的增加而增加,但转化率的增加速度随电流密度的增大而减小,甚至在达到某一个值(j= 80 mA/cm2)后,甲基橙转化率保持不变。此现象说明,该电解过程应是浓差极化为控制步骤的电化学反应。初期电流密度的增大,使单位时间单位面积内通过的电荷量较大,导致甲基橙转化率提高。但随着电流密度进一步增大,由于甲基橙分子在水中的扩散速度较慢,电极表面的电化学活性物质浓度明显降低甚至耗尽,而使电解速度难以继续增大并达到极值,此时再增大电流密度,电能将主要消耗在水的电解和热能的散失上,显然这将增大能耗,降低电流效率。因此电流密度应控制在合理的区间。在本实验条件下,电流密度应小于80 mA/cm2。
5.3.2 电解时间对甲基橙转化率的影响
保持辅助电解质浓度及电极板面积不变,在电流密度值一定时,恒电流电解一段时间,绘制不同电流密度下,甲基橙转化率随时间的变化图(图8)。
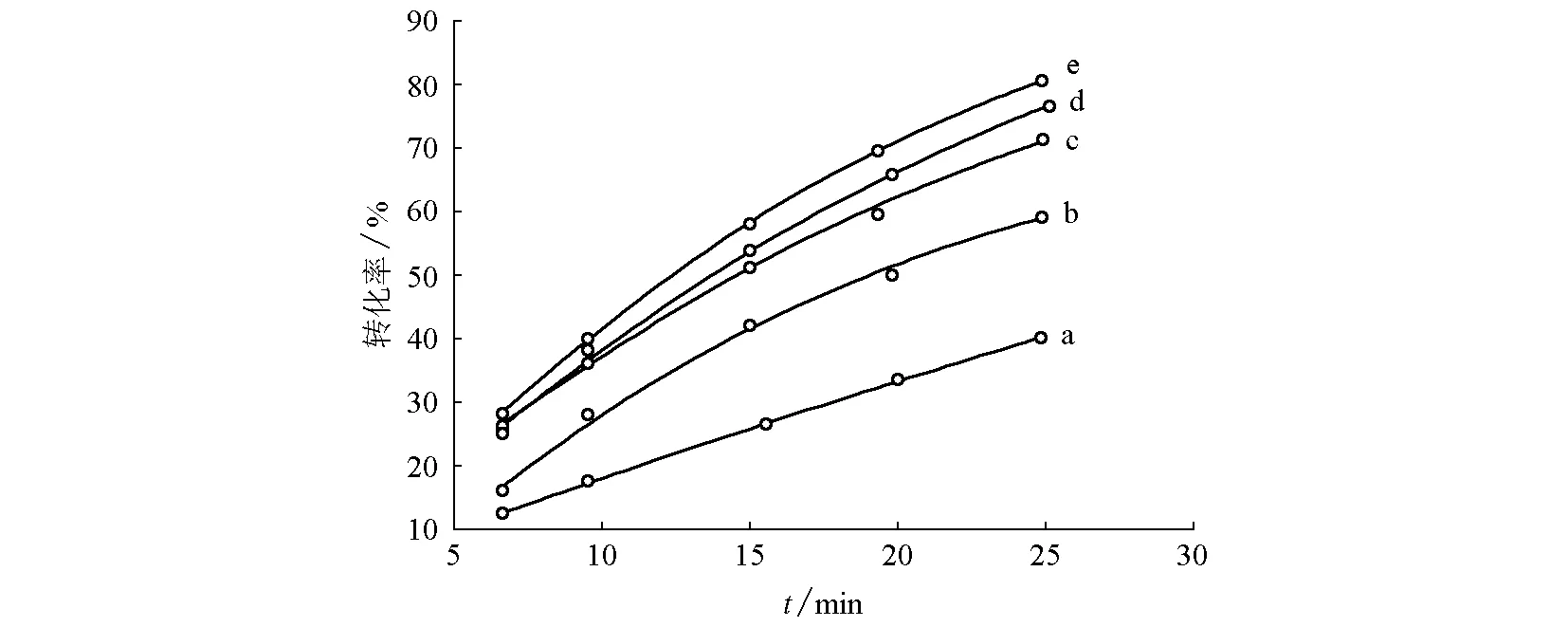
图8 不同电流密度下甲基橙转化率随电解时间的变化曲线图电流密度分别为: (a)29.0 mA/cm2; (b)40.0 mA/cm2; (c)50.8 mA/cm2; (d)61.2 mA/cm2; (e)72.4 mA/cm2
由图8可知,甲基橙转化率随电解时间增加而增大,但增加的速度逐渐变缓,即甲基橙的电解速率随时间降低,且电流密度越大时电解速率降低得越显著,这是因为随着电解时间延长,电解液中的甲基橙浓度降低,从而导致电解速率降低。
5.4 动力学机理的初步讨论
图9为-ln(c/c0)随时间t的变化曲线,c为不同时刻电解槽中甲基橙浓度,c0为甲基橙初始浓度。

图9 不同电流密度下的-ln(c/c0)-t关系图
从图9可以看出,-ln(c/c0)与时间t基本符合线性关系,而且在电流密度较小时,线性关系较好。当电流密度较大时,线性关系发生一定的偏离。因此可近似认为,在电流密度较小时,该电解反应为一级反应。
6 实验运行模式及实践情况
该电解法处理有机废水的设计实验为综合性较强的设计实验,实验开设过程分以下3个环节完成:
(1)布置实验题目“电解法处理有色有机废水”,同时给出实验室可以提供的试剂药品、电极材料、电解槽、分析仪器等信息,要求学生通过查阅文献,给出实验方案。实验方案中需要包括电解装置的搭建,槽压、反应物转化率等重要因素的测定方法及其影响因素的探索步骤,时间为2周。
(2)学生提交方案,教师对学生方案进行审核和细化,并根据学生的实验方案进行实验试剂和器材的准备,时间为1周。
(3)学生进入实验室进行实验,在两次实验课的时间内完成,如果学生要求更多时间,可在开放实验的时间内自主安排。
(4)学生分组撰写科研论文形式的实验报告和ppt报告,并组织全班学生与教师的讨论会,由学生代表就“电解法处理有色有机废水”课题的研究背景,实验过程,遇到的问题和发展前景作口头报告。
本实验是根据本学院某课题组的一项在研科研课题设计而来的教学实验,已在我院化学专业本科生中作为设计实验开设一年,两个年级约100名本科生参与实践。通过这种科研前沿领域的研究课题转化的设计实验的实践,使学生查阅资料、自主并独立思考问题以及动手等综合能力均得到很大提高。例如在搭建电解装置时工作电极与对电极的放置不当,有的将两电极放置距离过远导致槽压太大,有的让对电极面积小于工作电极等,对于这些实验中出现的问题,教师多以提供参考意见的方式向学生提出建议,主要由学生通过思考、讨论和查阅资料等方式给出修改和解决方案。这样可以使学生对电解的基础技术问题有更深刻的了解。
学生对于此类实验的兴趣非常浓厚。本实验安排的时间是两次实验课,但由于实验内容较多,给学生布置题目时部分内容是必做,部分是选做。而80%的学生都主动申请在开放实验的时间里另外增加实验时间,全部完成必做和选做的内容。通过整个实验教学过程,学生对该研究领域的了解比较深入,在实验报告和分组口头报告中,学生能够清楚地阐述该课题的研究意义、核心问题和技术难点,并能对未来的发展方向提出自己的观点。这为学生将来从事科研工作打下了一个良好的基础。
7 结论和展望
本文介绍的电解法处理有色有机废水实验是第一个在我院物理化学教学实验室开设的科研前沿实验,是一项实验教学改革的新举措,目的是让学生能够初步了解一个新领域,学习一项新技能,以锻炼和提高学生的创新能力和综合能力。延续这样的思路,更多的科研前沿实验将会逐步开设,使物理化学实验教学内容更加丰富,技术更加先进,从而使教学改革进程迈上一个新台阶。
[1] 李天成,朱慎林.电化学,2005,11(1):101
[2] 王勋华,张铁明,童少华,等.电化学,2010,16(2):172
[3] Zhou M H, Wu Z C, Wang D H.ChemicalReactionEngineeringandTechnology, 2001,17(3):263
[4] Zhang L, Jia J, Ying D,etal.ResearchinMicrobiology, 2005,156(1):88
[5] Dai Qizhou, Zhou Minghua, Lei Lecheng,etal.ChineseScienceBulletin,2007,52(12):1724
[6] Comninellis Ch, Vercesi G P.JApplElctrochem,1991,21(4):335
[7] Comninellis Ch.ElectrochinActa,1994,39:1857
[8] Mohan N, Balasubramanian N, Basha C A.JournalofHazardousMaterials,2007,147:644
[9] 李少中.广东化工,2012,39(2):119
[10] 宋小三,李艳红,王三反.工业水处理,2013,33(12):11
[11] 申哲民,雷阳明,贾金平,等.高校化学工程学报,2004,18(1):105
[12] 杨建朝,潘会波.稀有金属材料与工程,1994,23(1):50
Electrolysis for Colored Organic Wastewater Treatment*——Introduction of a Comprehensive Experiment of the Physical Chemistry Laboratory
Deng Yuan**Qin Jingjing Hu Xiaohong Xia Yan Gong Chuqing Deng Lizhi Xia Chunlan
(CollegeofChemistryandMolecularSciences,WuhanUniversity,Wuhan430072,Hubei,China)
In this paper, a new comprehensive and design experiment of the physical chemistry laboratory was introduced. And the principle, apparatus setup and the experimental procedure were discussed in detail. The effects of the current density, time of electrolysis, the concentration of the supporting electrolyte, and other technical parameters on the cell voltage and the conversion rate of organic matter were explored. In addition, the teaching mode and practice of the experiment were introduced.
Electrocatalytic oxidation; Cell voltage; Conversion rate; Comprehensive experiment of the physical chemistry laboratory
10.3866/pku.DXHX20150667
*通讯联系人,E-mail:dengy@chem.whu.edu.cn 秦菁菁 胡晓宏 夏艳 龚楚清 邓立志 夏春兰
武汉大学实验技术项目(No.WHU-2014-SYJS-09)
O646.51; G64

