松江鲈(Trachidermus fasciatus)泛素结合酶E2-D2基因的分子克隆及组织表达分析
陈学昭,张雷,于珊珊,毕彩红,刘春影,祝茜*
(1.山东大学(威海) 海洋学院,山东 威海 264209)
松江鲈(Trachidermus fasciatus)泛素结合酶E2-D2基因的分子克隆及组织表达分析
陈学昭1,张雷1,于珊珊1,毕彩红1,刘春影1,祝茜1*
(1.山东大学(威海) 海洋学院,山东 威海 264209)
泛素结合酶(UbcE2)是蛋白泛素化过程中所必需的酶,在泛素转移和底物的特异性识别方面发挥着重要的作用。本实验利用RACE技术克隆获得了全长为993 bp的松江鲈泛素结合酶E2-D2基因cDNA序列(命名为TfUbcE2-D2),其开放阅读框为444 bp,编码147个氨基酸。通过SMART预测得知,TfUbcE2-D2含有一个UBCc结构域。同源比对结果表明该基因与其他物种的同源性为92.31%。实时荧光定量PCR显示,TfUbcE2-D2广泛表达于松江鲈各组织,在肾脏中的相对表达量最高,其次为鳃。鳗弧菌(Vibrioanguillarum)刺激后,TfUbcE2-D2在血液、脾脏、肝脏和鳃中表达均上调,其中,脾脏和鳃中的表达量上调约40倍。由以上实验结果推测,TfUbcE2-D2可能参与松江鲈的先天免疫防御。
泛素结合酶;松江鲈;基因克隆;非特异性免疫
1 引言
松江鲈(Trachidermusfasciatus)隶属于鲉形目,杜父鱼科,松江鲈鱼属 ,曾广泛分布于我国沿海,但由于环境的破坏及人为因素干扰,其种群数量锐减,于1988年被列为国家二级保护动物。为恢复其种群数量,除对其栖息地的保护外还需要进行人工养殖,而在人工养殖中的各种刺激势必会引起各种疾病的出现和蔓延。为此,本实验室着手研究松江鲈的免疫学机制,以期为松江鲈的养殖及保护提供一定的参考依据。
泛素-蛋白酶体途径(Ubiquitin-proteasome pathway,UPP ),发现于20世纪70年代末,是介导机体蛋白降解的一个重要机制[1]。通过降解和修饰蛋白,UPP参与生物体多种生理生化过程,表现出功能的多样性[2—3]。最新研究表明,UPP还参与无脊椎动物免疫反应的调节和炎症反应的诱导[4]。组成UPP途径的成分主要有:泛素(Ubiquitin,Ub) 、泛素活化酶(Ub-Activating enzyme,E1)、泛素结合酶(Ub-Conjugating enzyme,E2)、泛素连接酶(Ub-Ligating enzyme,E3)、26S蛋白酶体(26S Proteasomes)和去泛素化酶(DUBs)。
泛素结合酶E2(UbcE2)通过硫酯键与活化的泛素相连,在E3的作用下,泛素与靶蛋白形成泛素-蛋白复合体,UbcE2也可以直接把泛素转移到靶蛋白的赖氨酸残基上。所有的UbcE2都含有一个保守的、大约包含150个氨基酸的核心结构域(Ubcc)。目前发现的E2有50余种,推测其多样性与对靶细胞的特异性选择有关[5]。 尽管有研究表明UPP参与了无脊椎动物的先天免疫,但是否参与脊椎动物的先天免疫,目前未见报道。 本文以松江鲈为研究对象,通过基因克隆成功获得了松江鲈泛素结合酶E2的亚型D2(命名为TfUbcE2-D2)的cDNA全长,进一步采用荧光实时定量PCR手段,分析TfUbcE2-D2 mRNA的组织分布以及鳗弧菌(Vibrioanguillarum)刺激后其表达模式变化,探讨泛素结合酶E2在松江鲈先天免疫中的作用,为进一步研究泛素结合酶在鱼类免疫方面的作用打下了一定的基础。
2 材料与方法
2.1 实验材料
2.1.1 实验动物
松江鲈(体质量15~23 g,9~10月龄)取自山东文登埠口松江鲈自然保护区,实验前将其饲养于12 ~14℃循环海水中,适应一周后,挑取正常健康的个体进行试验。
2.1.2 主要仪器和试剂
7300实时荧光定量PCR仪(美国Applied Biosystems);RNA提取试剂盒(EZNATMTotal RNA Kit Ⅱ)产自美国Omega公司;逆转录酶(Reverse TranscriptaseM-MLV)、RNA酶抑制剂、SYBR○RPremix Ex TaqTM试剂盒为TaKaRa Biotechnology产品(日本)。
2.2 实验方法
2.2.1 总RNA提取和cDNA合成
(1)实验处理
将适应后健康的松江鲈分成实验组和对照组(各50条):① 对照组:腹腔注射50 μL PBS缓冲液。② 鳗弧菌刺激组:腹腔注射鳗弧菌0.1 mL(约108/mL)。两组均于刺激后2 h、6 h、12 h、24 h用三卡因甲基磺酸盐(Sigma,St. Louis,MO,USA)麻醉取样(每个时间点每组取5尾),取出的各组织器官(血液、心脏、肝脏、鳃、胃、肠、皮肤、肾脏、脾脏和脑)于液氮中速冻,然后分装放于-80℃冰箱保存备用。
(2)总RNA提取及cDNA合成
根据EZNATMMicroElute○Rtotal RNA Kit Ⅱ试剂盒(QMEGA,USA)的操作说明,提取各个样品的总mRNA。cDNA合成参照CLONTECH公司SMART(Switching mechanism at 5′ end of RNA template)的指导说明。PCR所用引物为Smart F、Oligo-anchor R,引物序列见表1。
2.2.2 TfUbcE2-D2 cDNA全长克隆
由NCBI GenBank数据库中查找已发表的如下鱼类U bcE2-D2的cDNA基因序列:罗非鱼(XM_003447621.2Oreochromisniloticus)、斑马宫丽鱼(XM_004552029.1Maylandiazebra)、半滑舌鳎(XM_008327233.1Cynoglossussemilaevis)、青鳉(XM_004085735.1Oryziaslatipes)、红鳍东方鲀(XM_003978490.1Takifugurubripes)、剑鱼(XM_005811259.1Xiphophorusmaculatus)、斑马鱼(NM_199952.1Daniorerio)、大西洋鲑(BT056835.1Salmosalar)、胡瓜鱼(BT074727.1Osmerusmordax)和蓝鲶鱼(GU588028.1Ictalurusfurcatus),用DNAman进行多序列比对,并用Primer Premier 5.0在保守序列区设计简并引物(TfR1、TfF1,见表1)。以松江鲈肝脏cDNA为模板进行PCR,反应条件为94℃预变性5 min,94℃变性50 s,55℃复性45 s,72℃延伸90 s,35个循环后,72℃总延伸10 min。将纯化产物进行克隆测序获得中间片段。根据获得序列设计特异性引物TfF2、TfR2分别与3′ anchor R、 5′ primer 配对进行RACE克隆,得到5′端和3′端序列。利用Clustal W、DNAman、BioEdit等生物分析软件并结合人工校对,对TfUbcE2-D2的5端、中间序列和3′端进行拼接,得到目的基因cDNA全长序列。
2.2.3 TfUbcE2-D2基因序列分析
通过Expasy (http://www.au.expasy.org/) 对TfUbcE2-D2的cDNA序列进行蛋白翻译、分子量及等电点预测,通过SMART (http://smart.embl-heidelberg.de/)进行蛋白的结构域预测,在NCBI上BLAST搜查同源序列对其在氨基酸水平上进行同源比对,用ClustalW和BioEdit进行同源序列比对分析。
2.2.4 实时荧光定量PCR(Realtime fluorescence quantitative PCR,real-time PCR)
根据克隆所得的TfUbcE2-D2 cDNA序列设计real-time PCR的引物qRTF、qRTR(见表1),以对照组和刺激组的各时间点的cDNA为模板,进行real-time PCR。以β-Actin为内参基因,所用引物分别为ActinF和ActinR(见表1)。具体反应体系和步骤参见SYBR○RPremix Ex TaqTM说明书。每个待测样品cDNA设置3个平行,mRNA相对表达量根据2-ΔΔCt法计算,使用T检验的方法分析差异显著性,P<0.05为可接受的显著性差异标准[6]。
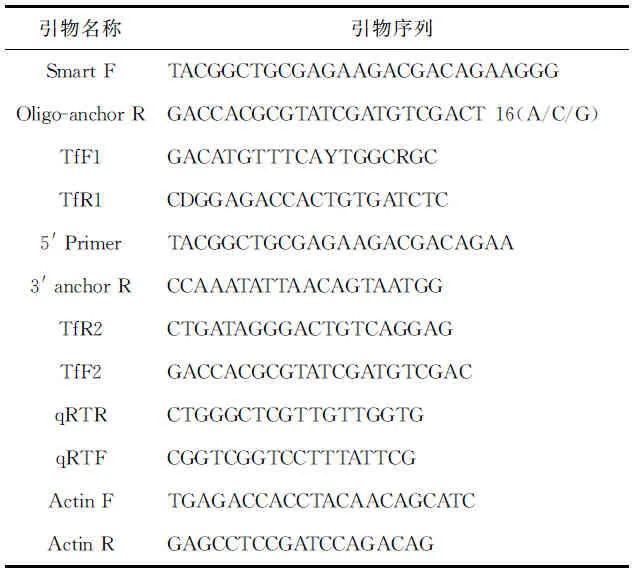
表1 本研究所用的PCR引物序列Tab.1 The sequences of PCR primers
3 实验结果
3.1 TfUbcE2-D2基因克隆和序列分析
通过对测序结果进行拼接,得到TfUbcE2-D2的cDNA序列全长993 bp,包括5′非编码区308 bp、3′非编码区220 bp,开放阅读框444 bp,编码147个氨基酸(见图1)。3′端有加尾信号(AATAAA),加尾信号后16 bp处有polyA尾巴。经ExPASy在线预测,TfUbcE2-D2蛋白质分子量(MW)为16.5 kD,理论等电点(PI)为6.80。通过SignalP 4.1预测N端没有信号肽。SMART预测发现该蛋白在第4~147位有一个结构域Ubcc,主要为泛素结合酶催化区域。
3.2 同源比对和系统进化树构建
将TfUbcE2-D2蛋白分别与人(NP_862821.1Homosapiens),白尾海雕(XP_009912166.1Haliaeetusalbicilla),绿海龟(XP_007054447.1Cheloniamydas),爪蟾(NP_001084434.1Xenopuslaevis),大西洋鲑(ACN12778.1Salmosalar),白斑狗鱼(ACO13579.1Esoxlucius),胡瓜鱼(ACO09151.1Osmerusmordax),斑点叉尾鮰(NP_001187535.1Ictaluruspunctatus)和斑马鱼(NP_957253.1Daniorerio)的UbcE2-D2 蛋白进行氨基酸比对,其相似度介于 74.15%~91.84%。10个物种氨基酸序列的同源性为92.31%(见图2)。
通过MEGA4.0的NJ法(Neighbor-joining),构建了罗非鱼(XP_003447669.1Oreochromisniloticus)、大黄鱼(XP_010752718.1Larimichthyscrocea)、红鳍东方鲀(XP_003978539.1Takifugurubripes)、绿海龟(XP_007054447.1Cheloniamydas)、白尾海雕(XP_009912166.1Haliaeetusalbicilla)、家鼠(NP_064296.1Musmusculus)和TfUbcE2-D2的系统进化树。结果显示,松江鲈TfUbcE2-D2与同为鲈形总目的罗非鱼和大黄鱼的UbcE2-D2关系最近,所有鱼类的UbcE2-D2单独聚为进化树的一大分支,其他脊椎动物的UbcE2-D2 聚为一支(见图3)。
3.3 TfUbcE2-D2的表达分析
3.3.1 TfUbcE2-D2的组织分布
real-time PCR结果表明,TfUbcE2-D2广泛表达于松江鲈各组织,且表达存在组织特异性,其中在肾脏的表达量最高,其次是鳃,表达量最低的是胃(见图4)。
3.3.2 鳗弧菌刺激后TfUbcE2-D2的表达模式分析
受鳗弧菌刺激后,TfUbcE2-D2于松江鲈的脾脏、肝脏和鳃中表达量急剧上升,分别在6 h、12 h、6 h时上调至最高点。在血液中,刺激后2 h TfUbcE2-D2表达量稍有上调,为对照组的1.4倍。但是在肾脏中,受刺激后表达下调,直至实验结束表达量仍低于正常水平(见图5)。
4 讨论
泛素-蛋白酶体途径广泛参与细胞凋亡、周期调控、信号转导、转录调控等多种生命活动过程[5]。其中UbcE2负责在泛素和底物蛋白之间催化形成异肽键,拥有一个大约由150个氨基酸组成的Ubcc结构域。在该结构域内,具有一个特殊的半胱氨酸残基,该残基在泛素和E2酶之间形成硫酯键起关键作用[7]。本实验结果表明TfUbcE2-D2具有一个Ubcc结构域,内含保守的半胱氨酸残基。将TfUbcE2-D2和多个已知的其他物种泛素结合酶E2-D2进行氨基酸序列比对,发现蛋白保守度高,尤其第85位半胱氨酸残基各物种保持一致,且其前后的氨基酸也高度保守,多为I(/V)CL。
作为参与机体基础代谢的酶类,大部分研究表明UbcE2在维持机体自身稳态和生殖方面发挥着重要的作用[8—10],而陈安静研究发现,对虾(Penaeusorientalis)的泛素结合酶E2(FcUbc)通过介导泛素化而抑制了白斑综合症病毒(WSSV)的复制[4]。本研究结果显示,TfUbcE2-D2广泛表达于松江鲈10个组织,而在肾脏中表达量最高,鳃次之。TfUbcE2-D2表达的普遍性说明其可能在松江鲈基础代谢方面发挥着重要的生理功能。肾脏是鱼类的一个重要的免疫器官,其吞噬细胞可吞噬自身衰老细胞及病原微生物等。大菱鲆(Scophthalmusmaximus)中的趋化因子受体CCR3和CCR9[11]、草鱼(Ctenopharyngodonidellus)中的C-型溶菌酶[12]、红笛鲷(Lutjanussanguineus)中的非特异性细胞毒性细胞膜受体(NCCRP-1)[13]等在肾脏中的表达量很高,另外,松江鲈的免疫相关基因硫氧还蛋白1(Trx1)[14]、髓样分化因子MyD88[15]、CD302(未发表)等在肾中的表达量也很高。鳃是鱼体内的黏膜相关淋巴组织(MALT),内含淋巴细胞、巨噬细胞和各类粒细胞[16],为防止生物体感染提供了关键的免疫监视[17]。TfUbcE2-D2在松江鲈肾脏和鳃中高表达量表明 TfUbcE2-D2可能参与免疫。

图1 TfUbcE2-D2的cDNA序列全长及演绎的氨基酸序列Fig.1 Nucleotide sequence and the deduced amino acid sequence of TfUbcE2-D2起始密码子和终止密码子用粗体标注,“*”代表终止密码子,阴影部分是UBCc结构域,加尾信号用下划线标出,保守半胱氨酸残基用方框标出The start and stop condons in bold,the asterisk (*) represented the stop codon,the structure domain was shown in shadow,the predicted polyadenylation signal AATAAA was underlined and conservative cysteine was shown in box

图2 松江鲈TfUbcE2-D2和其他物种的UbcE2-D2的氨基酸多序列比对Fig.2 Alignment of the amino acid sequences of TfUbcE2-D2 with the other UbcE2-D2 proteins using Clustal W method TfUbcE2-D2的催化位点用矩形框标出Catalytic sites of TfUbcE2-D2 was indicated with rectangular box
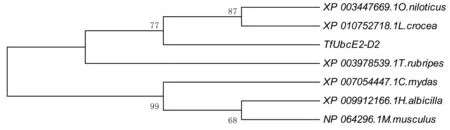
图3 基于TfUbcE2-D2的系统进化树分析Fig.3 Phylogenetic analysis of TfUbcE2-D2 with the other UbcE2-D2 proteins
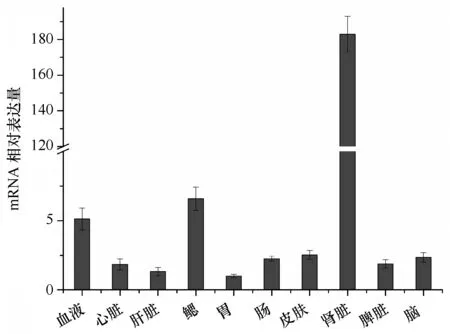
图4 TfUbcE2-D2在正常组织中的表达模式(n=3)Fig.4 Constitutive expression of TfUbcE2-D2 in different tissues of normal Roughskin soulpin(n=3)
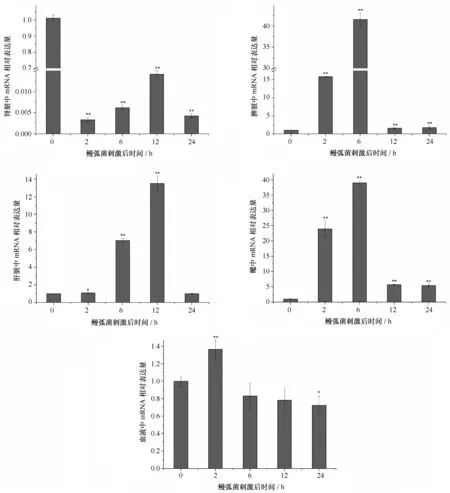
图5 TfUbcE2-D2受鳗弧菌刺激后不同组织表达模式变化Fig.5 Temporal expressions of TfUbcE2-D2 analyzed by real-time PCR after Vibrio anguillarum challenge柱状图显示了实时定量PCR的数据分析结果,星号指示刺激组与对照组(0 h)之间的T检验结果,“*”表明有显著性差异,“**”表示有极显著差异;误差线是通过对3次独立实验进行统计分析所得到的标准差;(* P<0.05; **P<0.01)The results of real-time PCR was expressed as histogram,the asterisk represented the differences from the control samples(*, P<0.05; **,P<0.01) .The error bars represent ±SD of three independent PCR amplifications and quantifications
受鳗弧菌刺激后,松江鲈脾脏、肝脏和鳃中的TfUbcE2-D2 表达量明显上调,其中在脾脏和鳃中达到了40倍左右。脾脏是真骨鱼中唯一的淋巴结样器官,其黑素-巨噬细胞中心具有吞噬细胞功能,同时在体液免疫中也发挥着一定的作用[16]。鱼类肝脏通过对病原体的吞噬、细菌的凝集等在宿主防御微生物入侵过程中起到非常重要的作用[18—19]。 鲤鱼的Akirin2[20]经鳗弧菌刺激后,在脾和肝脏中表达量均明显上调;松江鲈免疫相关基因C-型凝集素[21]、MyD88、 半乳糖凝集素[21]、白细胞介素-1受体相关激酶4(IRAK-4)[22],受刺激后在脾和肝脏中均迅速上调表达 。鳗弧菌刺激后TfUbcE2-D2基因在松江鲈脾和肝脏中表达上调可能与TfUbcE2-D2迅速参与外来蛋白降解有关系。受刺激后TfUbcE2-D2在鳃中大幅上调可能与其抵抗外来病原体也有一定的关系。刺激后肾脏中TfUbcE2-D2的下调,可能是因为mRNA迅速合成蛋白用于对外来病原体蛋白的降解。但其确切下调机理有待进一步研究。
综上所述,TfUbcE2-D2作为UPP途径中的一个重要酶,推测其参与了松江鲈的先天免疫,并在其先天免疫中发挥重要作用。本实验结果为研究泛素结合酶在鱼类先天性免疫作用奠定了一定的基础,也为
松江鲈的保护提供了参考,但关于其在免疫应答中的具体作用机制仍待进一步深入探讨。
[1] 吴慧娟,张志刚. 泛素-蛋白酶体途径及意义[J]. 国际病理科学与临床杂志,2006,26(1): 7-10.
Wu Huijuan,Zhang Zhigang. Ubiquitin-Proteasome pathway and its significance[J]. Journal of International Pathology and Clinical Medicine,2006,26(1): 7-10.
[2] 董合玲,徐晓阳. 泛素—蛋白酶体途径的组成及其生物功能[J]. 南京体育学院学报(自然科学版),2011,10(3): 35-37.
Dong Heling,Xu Xiaoyang. The composition of ubiquitin-proteasome pathway and its biological function[J]. Journal of Nanjing Institute of Physical Education (Natural Science),2011,10(3): 35-37.
[3] Von Kampen J,Wettem M,Schulz M. The ubiquitin system in plants[J]. Physial Plant,1996,97(3): 618-624.
[4] 陈安静. 泛素化与类泛素(SUMO)化在甲壳动物免疫反应中的功能[D]. 济南: 山东大学,2013.
Chen Anjing. Functional study of ubiquitination and SUMOylation in crustacean immune responses[D]. Ji’nan: Shandong University,2013.
[5] 徐豫松,王华兵. 家蚕泛素结合酶新基因的克隆与基因组结构及5′调控区分析[J]. 蚕业科学,2005,31(4): 439-443.
Xu Yusong,Wang Huabing. Analysis of a novel ubiquitin conjugating enzyme gene from Silkworm,Bombyxmori[J]. Canye Kexue,2005,31(4): 439-443.
[6] Livak K J,Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod[J]. Methods,2001,25(4): 402-408.
[7] 卓越,樊峥,叶棋浓,等. 人泛素结合酶9的原核表达与纯化[J]. 生物技术通讯,2007,18(1): 19-21.
Zhuo Yue,Fan Zheng,Ye Qinong,et al. Expression and purification of human ubiquitin conjugating enzyme 9[J]. Letters in Biotechnology,2007,18(1): 19-21.
[8] 郑眉. 人泛素活化酶UBE1DC1、UBE1及人泛素结合酶UBE2F的功能研究[D]. 上海: 复旦大学,2008
Zheng Mei. The function research of hunman Ubiquitin activating enzyme UBE1DC1、UBE1 and Ubiquitin Conjugating Enzyme UBE2F[D]. Shanghai: Fudan University,2008.
[9] Rajapurohitam V,Morales C R,El-Alfy M,et al. Activation of a UBC4-dependent pathway of ubiquitin conjugation during postnatal development of the Rat Testis[J]. Developmental Biology,1999,212(1): 217-228.
[10] 李游. 鳜鱼泛素活化酶、泛素结合酶基因的克隆、表达和功能[D]. 广州: 中山大学,2007.
Li You. Gene cloning,recombinant expression and fuctional research of ubiquitin activating enzyme,ubiquitin conjugating enzyme from mandarin fish,SinipercaChuatsi[D]. Guangzhou: Zhongshan University,2007.
[11] 孟艳青,刘晓飞,刘洋,等. 大菱鲆趋化因子受体CCR3和CCR9基因的克隆及组织表达[J]. 中国水产科学,2013,20(5): 918-930.
Meng Yanqing,Liu Xiaofei,Liu Yang,et al. Chemokine receptor genesCCR3 andCCR9 in turbot (Scophthalmusmaximus): Cloning and tissue distribution[J]. Journal of Fishery Sciences of China,2013,20(5): 918-930.
[12] 张莉莉. 草鱼g-型和c-型溶菌酶基因的克隆、组织分布与原核表达[D]. 湛江: 广东海洋大学,2009.
Zhang Lili. Gene cloning,tissue distribution and prokaryotic expression of g-lysozyme and c-lysozyme in grass carp,Ctenopharyngodonidellu[D]. Zhanjiang: Guangdong Ocean University,2009.
[13] 魏世娜. 红笛鲷NCCRP-1基因的克隆和表达分析[D]. 湛江: 广东海洋大学,2010.
Wei Shina. Cloning and expression analysis ofNCCRP-1 gene in crimson snapper (Lutjanussanguineus)[D]. Zhanjiang: Guangdong Ocean University,2010.
[14] 刘莹莹. 松江鲈(Trachidermusfasciatus)抗氧化相关基因的克隆、表达与功能分析[D]. 威海: 山东大学,2012.
Liu Yinying. Cloning,expression and functional analysis of antioxidant genes in roughskin sculpin (Trachidermusfasciatus)[D]. Weihai: Shandong University,2012.
[15] 毕彩红,张秋霞,于珊珊,等. 松江鲈(Trachidermusfasciatus)髓样分化因子MyD88基因克隆与组织表达分析[J]. 生物技术通报,2015,31(2): 135-142.
Bi Caihong,Zhang Qiuxia,Yu Shanshan,et al. Molecular cloning and expression analysis of MyD88 in Roughskin Soulpin,TrachidermusFasciatus[J]. Biotechnology Bulletin,2015,31(2): 135-142.
[16] 唐海蓉,陈仕均,王选年. 鱼类免疫组织的研究进展[J]. 现代畜牧兽医,2006(9): 52-54.
Tang Hairong,Chen Shijun,Wang Xuannian. The research progress of fish immune tissues[J]. Modern Journal of Animal Husbandry and Veterinary Medicine,2006(9): 52-54.
[17] Ellis A E. Innate host defense mechanisms of fish against viruses and bacteria[J]. Developmental & Comparative Immunology,2001,25(8/9): 827-839.
[18] Kurobe T,Yasuike M,Kimura T,et al. Expression profiling of immune-related genes from Japanese flounderParalichthysolivaceuskidney cells using cDNA microarrays[J]. Developmental & Comparative Immunology,2005,29(6): 515-523.
[19] Rhee J S,Kim B M,Kim R O,et al. Analysis of expressed sequence tags from the liver and ovary of the euryhaline hermaphroditic fish,Kryptolebiasmarmoratus[J]. Comparative Biochemistry and Physiology Part D: Genomics and Proteomics,2011,6(3): 244-255.
[20] 张晓研. 鲤鱼Akirin基因的分子克隆及免疫功能研究[D]. 济南: 山东师范大学,2010.
Zhang Xiaoyan. Molecular cloning and immunological characterization of Akirin in common carp (CyprinuscarpioL.)[D]. Ji’nan: Shandong Normal University,2010.
[21] Yu Shanshan,Yang Hui,Chai Yingmei,et al. Molecular cloning and characterization of a C-type lectin in roughskin sculpin (Trachidermusfasciatus)[J]. Fish & Shellfish Immunology,2013,34(2): 582-592.
[22] Liu Yingying,Yu Shanshan,Chai Yingmei,et al. Lipopolysaccharide-induced gene expression of interleukin-1 receptor-associated kinase 4 and interleukin-1β in roughskin sculpin (Trachidermusfasciatus)[J]. Fish & Shellfish Immunology,2012,33(4): 690-698.
Molecular cloning and expression analysis of ubiquitin-conjugating enzyme E2-D2 in roughskin sculpin,Trachidermus Fasciatus
Chen Xuezhao1,Zhang Lei1,Yu Shanshan1,Bi Caihong1,Liu Chunying1,Zhu Qian1
(1.SchoolofMarineScience,ShandongUniversity(Weihai),Weihai264209,China)
Ubiquitin-conjugating enzyme is the second enzyme in the process of protein ubiquitination and plays an important role in ubiquitin transferring and substrate specific recognition. In this study,we cloned the full-length cDNA from the Roughskin sculpin,Trachidermusfasciatusby RACE,and named as TfUbcE2-D2. The cDNA of TfUbcE2-D2 is 993 bp,which contained an open reading frame (ORF) of 444 bp encoding a polypeptide of 147 amino acids. The deduced amino acid sequence had a domain called Ubcc,which was extremely conservative. The mRNA expression of TfUbcE2-D2 in healthy andVibrioanguillarumchallenge was detected by quantitative real-time PCR,results showed that TfUbcE2-D2 was expressed in all the detected tissues,mainly expressed in kidney and gill. The up-regulated of TfUbcE2-D2 post challenge withVibrioanguillarumin blood,spleen,liver and gill indicated that it might be involved in the innate response of Roughskin sculpin.
ubiquitin-conjugating enzyme;Trachidermusfasciatus;gene clone;innate immunity
2015-03-25;
2015-07-28。
威海市科技攻关计划项目(0000413420608); 威海市科委项目(1070432121313)。
陈学昭(1990—), 女,山东省临沂市人,主要研究方向为松江鲈免疫基因。E-mail:chenxuezhao900601@163.com
*通信作者:祝茜, 博士生导师, 教授。E-mail:qianzhu@sdu.edu.cn
10.3969/j.issn.0253-4193.2015.10.013
Q95
A
0253-4193(2015)10-0133-08
陈学昭,张雷,于珊珊,等. 松江鲈(Trachidermusfasciatus)泛素结合酶E2-D2基因的分子克隆及组织表达分析[J].海洋学报,2015,37(10):133—140,
Chen Xuezhao,Zhang Lei,Yu Shanshan,et al. Molecular cloning and expression analysis of ubiquitin-conjugating enzyme E2-D2 in roughskin sculpin,TrachidermusFasciatus[J]. Haiyang Xuebao,2015,37(10):133—140,doi:10.3969/j.issn.0253-4193.2015.10.013

