气相色谱-质谱联用法测定油用牡丹花蕊和花粉中角鲨烯含量
刘延平,于荟,马文平,王鲁霞,李建新
(菏泽市产品检验检测研究院食品检验中心,山东菏泽 274000)
气相色谱-质谱联用法测定油用牡丹花蕊和花粉中角鲨烯含量
刘延平,于荟,马文平,王鲁霞,李建新
(菏泽市产品检验检测研究院食品检验中心,山东菏泽 274000)
建立气相色-谱质谱联用(GC-MS)测定油用牡丹花蕊及花粉中角鲨烯含量的方法。牡丹花蕊及花粉经索氏抽提法提取脂肪后,用氢氧化钾-乙醇溶液皂化,石油醚萃取净化,正己烷溶解,提取物经HP-5MS柱分离后进入质谱仪检测,外标法定量。结果表明:油用牡丹花蕊和花粉中角鲨烯含量分别为2.73,1.75 g/kg。在0.08~400 mg/L范围内角鲨烯含量与定量离子m/z69的峰面积线性相关,相关系数为0.999 6,方法的检出限为11 ng/kg。在1.00~3.00 g/kg范围内进行加标回收试验,平均回收率为92.5%~102.6%,测定结果的相对标准偏差为3.4%~5.3%(n=6)。该方法具有较好的准确性和重复性,适用于油料植物和植物油中角鲨烯含量的测定。
油用牡丹;牡丹花蕊;牡丹花粉;角鲨烯;气相色谱-质谱联用法
角鲨烯(化学名为2,6,10,15,19,23-六甲基-2,6,10,14,18,22-二十四碳六烯)是一种高度不饱和脂肪族烃类化合物,为无色或黄色透明油状液体,是从深海鲨鱼肝油中提炼而成[1-5]。它具有提高体内超氧化物歧化酶(SOD)活性、促进新陈代谢、提高机体免疫力、降低血清总胆固醇、防止动脉粥样硬化[6-7]和抗衰老、抗疲劳、抗肿瘤等多种生理功能,是一种无毒性的生物活性物质[8-9],因此被广泛应用于医药、化妆品等相关领域[10-11]。Bakes M J[12]指出角鲨烯主要来源于深海鲨鱼肝油,植物性产品橄榄油中角鲨烯含量也较高[13]。
牡丹是我国特有的木本名贵花卉,其花大、色艳、型美、香浓,极具观赏性,不仅花美,其根可入药,称为“丹皮”,具有清热凉血、活血化瘀的功效[14],因此,牡丹一直被用作观赏花卉和药用植物。牡丹籽油是由油用牡丹种籽生产的一种新型木本植物油,其不饱和脂肪酸含量高达90%,其中α-亚麻酸占40%以上,具有很高的营养价值。国务院指出要大力发展木本油料产业,加快推进牡丹籽油生产基地建设,开发利用新的木本植物油资源,实现牡丹产业化。伴随着油用牡丹大规模种植,大量牡丹副产物—牡丹花蕊和花粉引起了人们的关注,成为了中国特有的营养产品,如不能加以利用将会造成资源大量浪费。牡丹不产花蜜,为风媒木本植物,因此牡丹花粉不被蜜蜂等其它昆虫采收污染,质量好、产量高。由牡丹花蕊冲泡的茶,色泽金黄,清香宜人[15],初步试服结果表明,牡丹花蕊对男性前列腺疾病有独特效果。牡丹花蕊、花粉营养价值极高,但是对其含有的生物活性物质的研究,国内外很欠缺,成分的研究也只是局限于某类成分的总体分析,并未对单体成分进行定量。因此笔者选择了合适的分离提取技术提取牡丹花蕊和花粉中的天然功效成分角鲨烯,并对其进行了定性和定量分析,目前国内外还没有这方面研究的报道。笔者建立了样品皂化后,经石油醚萃取净化,正己烷溶解,气质联用法进行牡丹花蕊和花粉中功能性成分角鲨烯含量的定量检测方法。与毛多斌[16]和谢勇[17]的研究相比,本方法优于用正己烷溶解后直接进样,因为直接进样干扰大,峰型容易变形,且对气相的衬管、毛细管柱以及质谱检测器污染大。由于角鲨烯是一种脂质不皂化物[18],因此笔者先将油脂皂化脱脂,然后用石油醚萃取提取角鲨烯。该方法重现性好,灵敏度高,峰型尖锐且干扰峰少,目标峰分离效果好,定量准确。
1 实验部分
1.1 主要仪器与试剂
气相色谱仪(7890A型)串联质谱仪(5975C型):美国安捷伦科技有限公司;
旋转蒸发器:RE52AA型,菏泽市鑫源仪器仪表有限公司;
电热恒温水浴锅:XMTD-4000型,北京市永光明医疗仪器有限公司;
数控超声波清洗器:KQ-500DB型,昆山市超声仪器有限公司;
电子天平:AL204型,梅特勒-托利多仪器(上海)有限公司;
角 鲨 烯 标 准 品:99.5%,0.5 mL/支,批 号140721-200601,中国药品生物制品检定所;
正己烷:色谱纯,天津市科密欧化学试剂有限公司;
石油醚:分析纯,沸程30~60℃,天津市富宇精细化工有限公司;
KOH:分析纯,天津市永大化学试剂有限公司;
NaCl、无水硫酸钠、无水乙醇:分析纯,天津市科密欧化学试剂有限公司;
牡丹花蕊和花粉:山东菏泽尧舜牡丹生物科技有限公司。
1.2 角鲨烯标准储备溶液的制备
准确称取0.100 0 g角鲨烯标准品于100 mL容量瓶中,加适量正己烷,振荡超声使之完全溶解,再用正己烷定容至标线,混匀,制成浓度为1 000 mg/L的标准储备液。
1.3 角鲨烯标准使用液的制备
利用1 000 mg/L的标准储备液,配制0.04~800 mg/L的系列标准使用液,进行线性和检出限实验。
1.4 样品处理
按照国标GB/T 5009.6-2003中第一法索氏抽提法提取花蕊和花粉中的脂肪。称取0.2 g左右所提取的脂肪样品,放入50 mL锥形瓶中,加入25 mL的2 mol/L KOH-乙醇溶液,置于85℃恒温水浴锅中皂化1 h,冷却后转移至150 mL分液漏斗中,分别加入25 mL饱和氯化钠溶液和石油醚,振荡萃取1 min,静置分层后,将上层有机相转入150 mL分液漏斗中,下层皂化液再分别用25 mL和15 mL石油醚萃取两次,将合并的3次萃取液用去离子水洗至中性,经无水硫酸钠脱水后,于30℃水浴锅中旋转蒸发至近干,用正己烷定容至10 mL,取上清液用气相色谱质谱联用仪测定。
1.5 仪器工作条件
1.5.1 色谱条件
色谱柱:HP-5MS石英毛细柱(30 m×250 µm,0.25 µm,美国安捷伦科技有限公司);升温程序:200℃保持0 min,以40℃/min升至280℃,保持10 min;进样口温度:280℃;载气:高纯氦气,流量为1.0 mL/min;进样方式:不分流进样;进样量:1 µL。
1.5.2 质谱条件
离子源:电子轰击离子源(EI);离子源温度:230℃;四级杆温度:150℃;采集模式:选择离子监测;溶剂延迟:3.00 min;定量离子:m/z69;定性离子:m/z81,95,137。
2 结果与讨论
2.1 角鲨烯的定性与定量离子选择
对角鲨烯标样通过质谱全扫描模式得到质谱图与标准谱库NIST11.L做相似度检索匹配度为99%,确定其主要的碎片离子的质荷比m/z69,81,95,137,再设置选择离子监测模式,选择检测离子为m/z69,81,95,137。在选择离子监测模式对目标物进行定量时,通常选择灵敏度高且抗扰能力强的碎片离子作为目标物定量的离子,实验选择定量离子为m/z69,定性离子为m/z81,95,137。角鲨烯的总离子流图和质谱图分别见图1、图2。
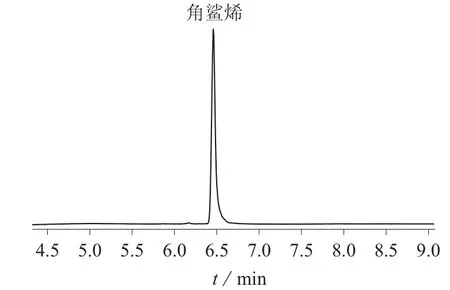
图1 角鲨烯标准品的总离子流图

图2 角鲨烯标准品的质谱图
2.2 样品中角鲨烯的定性与定量
通过与角鲨烯标准品的出峰时间和面积相对比,确定样品中角鲨烯的含量。牡丹花蕊和花粉提取的脂肪中角鲨烯的总离子流图分别见图3、图4,质谱图分别见图5、图6。

图3 牡丹花蕊的总离子流图

图4 牡丹花粉的总离子流图
从图3、图4可以看出,样品中角鲨烯色谱峰基线稳定,目标峰峰型尖锐,重现性好,并能与其它干扰峰较好地区分开来。由图5和图6的质谱峰可以看出提取物的质谱峰与角鲨烯标准品的质谱峰相近,与标准谱库NIST11.L做相似度检索匹配度为96%,因此可以确定提取物是角鲨烯。用标准曲线法对样品中的角鲨烯进行定量。
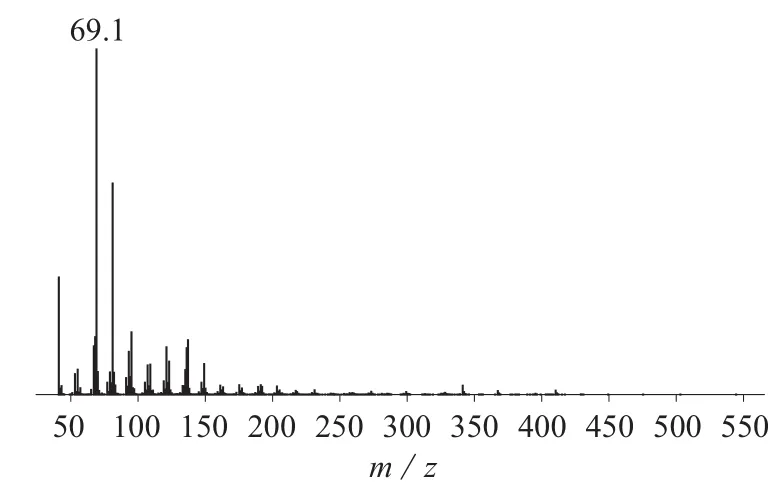
图5 牡丹花蕊的质谱图
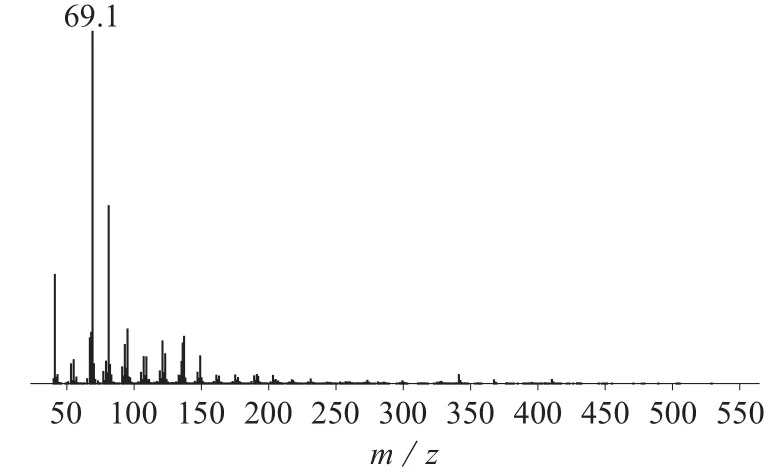
图6 牡丹花粉的质谱图
2.3 色谱条件选择
由于角鲨烯是一种高度不饱和烃类化合物,相对分子质量大,沸点高(280℃),难挥发,故选用HP-5MS非极性耐高温(325℃)毛细管柱,进样口温度280℃,分离效果好,峰型尖锐,干扰少,此色谱条件适用于角鲨烯的测定。
2.4 线性方程、线性范围和检出限
利用1 000 mg/L的角鲨烯标准储备液,配制成0.04,0.08,0.16,0.40,1.60,4.00,8.00,16.00,40.00,80.00,120.00,400.00 mg/L的标准使用液,试验发现0.04和800 mg/L这两个点偏离了线性范围,因此方法的线性范围是0.08~400 mg/L。按照设定的色谱条件,以角鲨烯的质量浓度为横坐标,定量离子m/z69的峰面积为纵坐标,进行线性回归,得线性方程为y=9.962×105x-9.816×105,线性相关系数r=0.999 6。当信噪比(S/N)为3时,角鲨烯的检出限为11 ng/kg。
2.5 精密度试验
对牡丹花蕊和牡丹花粉样品重复测定6 次,结果见表1。由表1可知,牡丹花蕊和牡丹花粉中角鲨烯测定结果的相对标准偏差分别为3.4%,5.3%,说明该方法具有良好的精密度。

表1 精密度试验结果
2.6 回收试验
在牡丹花蕊和牡丹花粉样品中,分别添加1.00,2.00,3.00 g/kg的角鲨烯标准品,前处理方法同1.4,测定后计算回收率,结果见表2。
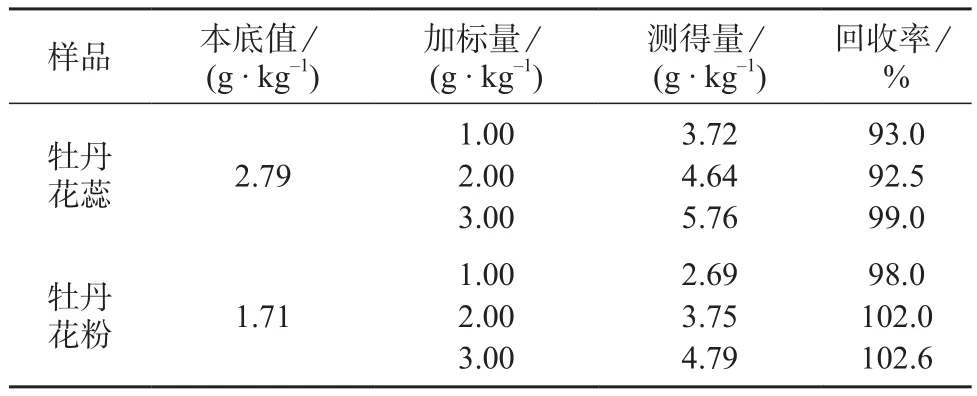
表2 加标回收试验结果
由表2可见,回收率在92.5%~102.6%之间,说明该方法的加标回收率满足方法学要求,适合角鲨烯含量的测定。
2.7 样品测定
实验中选取了油用牡丹花蕊和花粉作为样品,按照实验方法测定了其中的角鲨烯含量,结果见表1,其平均值分别为2.73,1.75 g/kg,此结果表明:牡丹花蕊和花粉中含有大量的角鲨烯,其含量要远高于一般植物油如花生油、大豆油、亚麻籽油、葵花籽油等。
3 结论
采用气质联用法测定牡丹花蕊和花粉中功能性成分角鲨烯的含量。结果表明,此方法重现性好,灵敏度高,峰型尖锐且干扰峰少,目标峰分离效果好,定量准确。牡丹花蕊和花粉中的角鲨烯含量很高,这对开发其药用和食用价值、指导牡丹产业的深加工、深度挖掘油用牡丹的应用价值、促进油用牡丹产业化发展和提高资源利用率有一定的意义。关于牡丹花蕊和花粉中角鲨烯含量的测定国内外还没有文献报道,因此本课题的研究对以后角鲨烯的研究有一定的指导意义。
[1] 陈学兵,史宣明,赵抒娜,等.植物油中提取角鲨烯的研究进展[J].中国油脂,2013,38(11): 72-75.
[2] 邹海民,曹铸,曾红燕.功能食品中角鲨烯的气相和液相色谱方法比较[J].现代预防医学,2014,41(2): 293-299.
[3] 钟冬莲,汤富彬,沈丹玉,等.油茶籽油中角鲨烯含量的气相色谱法测定[J].分析试验室,2013,30(11): 104-106.
[4] Gunawan S,Kasim N S,Ju Y. Separation and purification of squalene from soybean oil deodorizer distillate[J]. Separation & Purification Technology,2008,60(2): 128-135.
[5] Vázquez L,Torres C F,Fornari T,et al. Recovery of squalene from vegetable oil sources using countercurrent supercritical carbon dioxide extraction[J]. Journal of Supercritical Fluids,2007,40(1): 59-66.
[6] 汪运明,陈华勇,杨继国,等.气相色谱质谱联用测定茶油中角鲨烯含量[J].食品工业科技,2011,32(6): 404-406.
[7] Warleta F,Campos M,Allouche Y,et al. Squalene protects against oxidative DNA damage in MCF10A human mammary epithelial cells but not in MCF7 and MDA-MB-231 human breast cancer cells[J]. Food & Chemical Toxicology,2010,48(4): 1 092-1 100.
[8] 官波,郑文诚.角鲨烯提取、纯化及其应用[J].粮食与油脂,2010(2): 44-46.
[9] Huang Z R,Lin Y K,Fang J Y. Biological and pharmacological activities of squalene and related compounds: potential uses in cosmetic dermatology[J]. Molecules,2009,14(1): 540-554.
[10] Harivardhan R L,Couvreur P. Squalene: a natural triterpene for use in disease management and therapy[J]. Advanced Drug Delivery Reviews,2009,61(15): 1 412-1 426.
[11] 张东生,薛雅琳,金青哲,等.油茶籽油中角鲨烯含量的测定[J].中国油脂,2013,38(11): 85-88.
[12] Michael J Bakes,Peter D Nichols. Lipid,fatty acid and squalene composition of liver oil from six species of deep-sea sharks collected in southern Australian waters[J]. Comp Biochem Physiol B: Biochem Mol Biol,1995,110B (1): 267-275.
[13] 张青龄.橄榄油中角鲨烯含量的气相色谱/质谱法分析[J].福建分析测试,2011,20(3): 1-4.
[14] 国家药典委员会.中华人民共和国药典:一部[M].北京:中国医药科技出版社,2010: 160-161.
[15] 刘卫.牡丹花蕊茶[EB/OL]. http: //www.ruipumudan.com/ mudanchanpin/mudanhuaruicha/,2014-02-12/2015-03-16.
[16] 毛多斌,贾春晓,孙晓丽,等.几种功能性植物油中角鲨烯和维生素E分析[J].中国粮油学报,2007,22(2): 79-82.
[17] 谢勇,苏素娇,梁一池.气相色谱法测定茶籽油中角鲨烯含量的研究[J].河南工业大学学报,2012,33(1): 42-44.
[18] 许瑞波,刘玮炜.角鲨烯的制备及应用进展[J].山东医药,2005,45(35): 69-70.
Determination of Squalene in Peony Stamen and Pollen for Oil by Gas Chromatograph-Mass Spectrometry
Liu Yanping, Yu Hui, Ma Wenping, Wang Luxia, Li Jianxin
(Heze Institute of Product Inspection and Testing, Food Inspection Center, Heze 274000, China)
A method for quantitative of squalene in peony stamen and pollen for oil was determined by GC-MS. The peony stamen and pollen oil was extracted by Soxhlet extraction. The extracted oil samples were saponified with potassium hydroxide-ethanol solution,extracted with petroleum ether and dissolved withn-hexane. The extracted solutions were separated on a HP-5MS column and determined with mass spectrometer. The squalene content in oil peony stamen and pollen were 2.73 and 1.75 g/kg. The contents of squalene had good linear relationship in the range of 0.08-400 mg/L with the peak area of quantitative ionm/z69,and the correlation coefficient reached 0.999 6. The method of detection limit was 11 ng/kg. The recoveries of squalene ranged from 92.5% to 102.6% at fortification levels of 1.00-3.00 g/kg,and the relative standard deviation was 3.4%-5.3%(n=6). This method has good accuracy and repeatability which can be applied to the determination of squalene in oil plants and vegetable oil.
peony for oil; peony stamen; peony pollen; squalene; gas chromatograph-mass spectrometry
O657.63
:A
:1008-6145(2015)06-0052-04
10.3969/j.issn.1008-6145.2015.06.013
联系人:刘延平;E-mail: 2005013004@163.com
2015-07-08

