亚低温下干旱胁迫对番茄幼苗叶片水分及活性氧代谢的影响
杜清洁,李建明,潘铜华,常毅博,刘国英,黄红荣
(西北农林科技大学 园艺学院,陕西 杨凌 712100)
亚低温下干旱胁迫对番茄幼苗叶片水分及
活性氧代谢的影响
杜清洁,李建明,潘铜华,常毅博,刘国英,黄红荣
(西北农林科技大学 园艺学院,陕西 杨凌 712100)
【目的】 探讨亚低温下干旱胁迫对番茄幼苗叶片水分状况以及活性氧代谢系统的影响,为日光温室冬春季水分的科学管理提供参考。【方法】 以“金鹏1号”番茄为材料,利用植物气候箱,采用盆栽试验,以常温(昼/夜温度25 ℃/18 ℃)下正常水分(田间持水量的75%~85%)处理为对照,研究了常温下干旱胁迫(田间持水量的55%~65%,以下简称干旱胁迫)处理及亚低温(昼/夜温度15 ℃/8 ℃)下正常水分(以下简称亚低温)处理和干旱胁迫(以下简称亚低温干旱胁迫)处理的番茄幼苗叶片中水分含量、渗透调节物质、活性氧物质、抗氧化酶活性及AsA-GSH循环物质的变化。【结果】 亚低温处理下番茄叶片水分含量减少,亚低温干旱处理不会进一步加剧水分的减少,但影响番茄叶片水分的恢复。干旱胁迫下渗透调节物质以脯氨酸为主,亚低温胁迫下以可溶性糖为主,亚低温干旱胁迫下两者含量均最高。亚低温干旱胁迫比单一胁迫处理叶片MDA含量高、细胞膜相对透性大。不同处理的活性氧产生及清除机制不同,亚低温处理下活性氧积累主要为超氧阴离子,活性氧清除以SOD及CAT为主;干旱胁迫下则主要为过氧化氢,活性氧清除以SOD及POD为主;亚低温干旱胁迫下,活性氧积累最多,SOD和CAT活性最高。与对照相比,在亚低温干旱胁迫下,AsA-GSH循环中APX活性、GR活性、AsA含量和GSSG含量均最高。【结论】 设施栽培番茄叶片对亚低温胁迫比干旱胁迫更敏感,科学灌水可减少亚低温对番茄幼苗造成的伤害。
番茄;亚低温;干旱胁迫;叶片水分;活性氧代谢
近年来,可周年生产的设施栽培不断增多,而冬春季北方地区设施内经常处于亚低温环境,因此亚低温已成为番茄设施生产中重要的限制因素[1]。水分作为环境因子中的一种,不仅在植物体内占植株总鲜质量的85%以上,而且参与植物体内各种代谢过程,对植物的生长发育有重要影响。由于植物生长的环境是由多种环境因子构成的,所以探讨温度及水分等多环境因子对番茄生长生理的影响更具实际意义。目前有关温度或水分单一因素对番茄生理特性影响的研究较多,但探讨亚低温和水分交互作用对番茄的影响较少。李建明等[2]和徐菲等[3]研究表明,在亚低温条件下补充蒸腾蒸发量的100%,可改善植株生长状况,增加干物质积累;但其并没有对植株的水分状况及活性氧(ROS)清除机制进行深入的探讨。研究发现,低温或干旱单一逆境条件下植株体内活性氧含量迅速升高,为保持细胞免受活性氧伤害,植物体内活性氧清除机制也迅速启动,表现为抗氧化物质含量增多、抗氧化酶活性升高及AsA-GSH循环加快等[4-5]。本试验以“金鹏1号”番茄为材料,研究亚低温和水分交互作用对番茄植株的水分状况及活性氧代谢系统的影响,进一步揭示亚低温下水分对番茄幼苗影响的机理,以期为日光温室冬春季水分的科学管理提供一定的理论依据。
1 材料与方法
1.1 试验材料与处理
供试材料为番茄品种“金鹏1号”。于2013年10月播种,待长至3叶1心时,选取健壮、长势均匀的幼苗定植于直径10 cm、高8 cm的花盆内,每盆定植1株,共200株,移至人工气候培养箱中培养。盆土取自外界大田,土壤最大田间持水量为30.3%,土壤体积质量为1.3 g/cm3,每盆装土300 g。培养箱中环境条件设置为:昼/夜周期为14 h/10 h,昼/夜温度为25 ℃/18 ℃,光照强度5 500 lx,相对湿度60%。缓苗5 d后,开始进行温度及水分处理。试验共设4个处理,每个处理50盆。先将植株分为2组分别置于常温(昼/夜温度为25 ℃/18 ℃)及亚低温(昼/夜温度为15 ℃/8 ℃)的培养箱中,再将每组分为2个小组进行水分处理,分别为田间持水量的75%~85%(正常水分)和55%~65%(干旱胁迫)。4个处理分别为常温下正常水分处理(CK)、常温下干旱胁迫处理(以下简称干旱胁迫处理)、亚低温下正常水分处理(以下简称亚低温处理)和亚低温下干旱胁迫处理(以下简称亚低温干旱胁迫处理)。2个培养箱除温度不同外,其余环境条件均相同,水分控制采用称重法。
1.2 测定指标与方法
分别于处理第0,4,8,12,16,20天,取样测定各处理功能叶的生理生化指标,测定重复3次。叶片相对含水量(RWC)测定参考高俊凤[6]的方法,可溶性糖测定采用蒽酮比色法[6],脯氨酸(Pro)测定采用酸性茚三酮比色法[6],丙二醛(MDA)测定采用硫代巴比妥酸法[6],质膜相对透性测定采用电导率仪[6],超氧阴离子测定采用王爱国等[7]的方法,过氧化氢(H2O2)含量测定采用四氯化钛比色法[8],超氧化物歧化酶(SOD)活性测定采用氮蓝四唑(NBT)光还原法[6],过氧化氢酶(CAT)活性测定采用紫外分光光度法[6],过氧化物酶(POD)活性测定采用愈创木酚法测定[6],抗坏血酸过氧化物酶(APX)活性测定参照Nakano等[9]的方法,谷胱甘肽还原酶(GR)测定参照Ma等[10]的方法,抗坏血酸(AsA)、脱氢抗坏血酸(DHA)测定采用Foyer等[11]的方法,还原性谷胱甘肽(GSH)、氧化型谷胱甘肽(GSSG)含量测定参考孙群[12]和Ma等[10]的方法。
1.3 数据处理
试验数据采用SPSS 19.0进行统计分析,采用Excel 2003进行图形的绘制,处理间差异分析采用Duncan’s法(P=0.05)。
2 结果与分析
2.1 亚低温下干旱胁迫对番茄叶片水分及渗透调节物质含量的影响
2.1.1 对叶片水分的影响 植株叶片相对含水量可反映植株水分亏缺的状况,是研究植物水分生理的一个重要指标[13]。从图1可以看出,番茄叶片相对含水量随各胁迫处理时间的延长,表现为先降低后又恢复或维持在一定水平。叶片相对含水量在干旱胁迫处理下第4天达最低值,第8天恢复到对照水平;在亚低温处理下第8天达最低值,第12天恢复到对照的96%;在亚低温干旱胁迫处理下第8天后基本维持在对照的94%左右。这说明由低温和干旱胁迫引起的叶片水分亏缺机制不同,亚低温可引起叶片水分含量减少,亚低温下干旱胁迫处理不会进一步加剧水分的减少,但影响叶片水分恢复。
2.1.2 对渗透调节物质含量的影响 植株感受到水分亏缺,会促使细胞合成大量的渗透调节物质来维持细胞的水分平衡,以保证细胞的正常代谢。可溶性糖和脯氨酸为重要的渗透调节物质。由图2可知,番茄叶片中脯氨酸和可溶性糖含量均随各胁迫处理时间的延长而增加。脯氨酸含量在处理初
期(0~4 d)亚低温处理高于干旱处理,中后期(8~20 d)则低于干旱处理,二者可溶性糖含量变化关系则刚好相反。亚低温干旱处理下2种物质含量均处于最高值,与其他处理间差异达显著水平。说明亚低温干旱处理可同时诱导可溶性糖和脯氨酸对干旱与低温胁迫的响应机制,增强植株的渗透调节能力,但在处理不同时期诱导的主因不同:处理初期(0~4 d)脯氨酸积累以温度胁迫诱导为主、可溶性糖以水分胁迫诱导为主,中后期则相反。以上结果说明脯氨酸和可溶性糖的诱导机制不同。
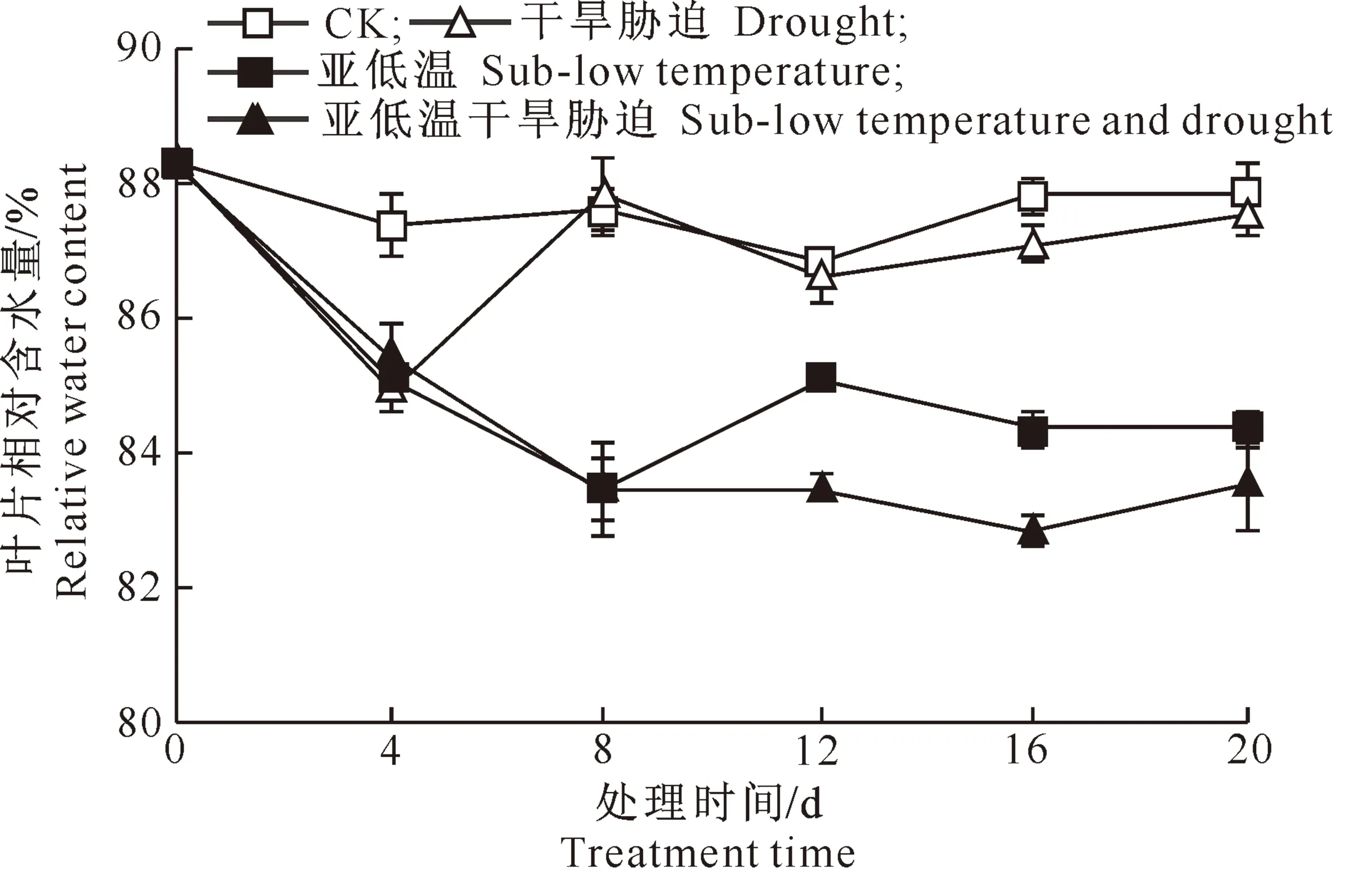
图1 亚低温下干旱胁迫对番茄叶片相对含水量的影响

图2 亚低温下干旱胁迫对番茄叶片脯氨酸和可溶性糖含量的影响
2.2 亚低温下干旱胁迫对番茄叶片质膜过氧化的影响
MDA为细胞膜脂过氧化的最终产物,质膜相对透性可反映细胞膜的选择透性,二者可作为判断细胞受伤害程度的指标。如图3所示,与对照相比,处理开始后番茄叶片MDA含量在干旱胁迫下略有增加但无显著差异;在亚低温处理下增加显著;在亚低温干旱胁迫下增加最多且达最大值,处理第16天时该处理MDA含量比对照、干旱胁迫、亚低温处理分别高204%,150%和58%。此外,各处理番茄叶片质膜相对透性的变化与MDA含量变化趋势相似,干旱胁迫、亚低温处理及亚低温干旱胁迫均使番茄叶片质膜相对透性较对照显著增加,其中以亚低温干旱胁迫下增加最多,亚低温处理下次之,干旱胁迫下增加最少。这表明亚低温和干旱胁迫相互作用对细胞的伤害加剧。

图3 亚低温下干旱胁迫对番茄叶片丙二醛和相对电导率的影响
2.3 亚低温下干旱胁迫对番茄叶片活性氧物质含量的影响
如图4所示,与对照相比,干旱胁迫、亚低温处理和亚低温干旱胁迫处理番茄叶片中超氧阴离子和H2O2含量增加。处理开始后,各处理下超氧阴离子含量由高到低依次为:亚低温干旱胁迫>亚低温处理>干旱胁迫>对照,第8天后各处理间差异达显著水平;H2O2含量变化在处理初期(0~4 d)与超氧阴离子含量变化趋势相同,而在处理第8天后其含量由高到低为:亚低温干旱胁迫>干旱胁迫>亚低温处理>对照。可见,亚低温胁迫下超氧阴离子积累较多,干旱胁迫下H2O2积累较多,亚低温干旱共同胁迫下两者积累均最多。
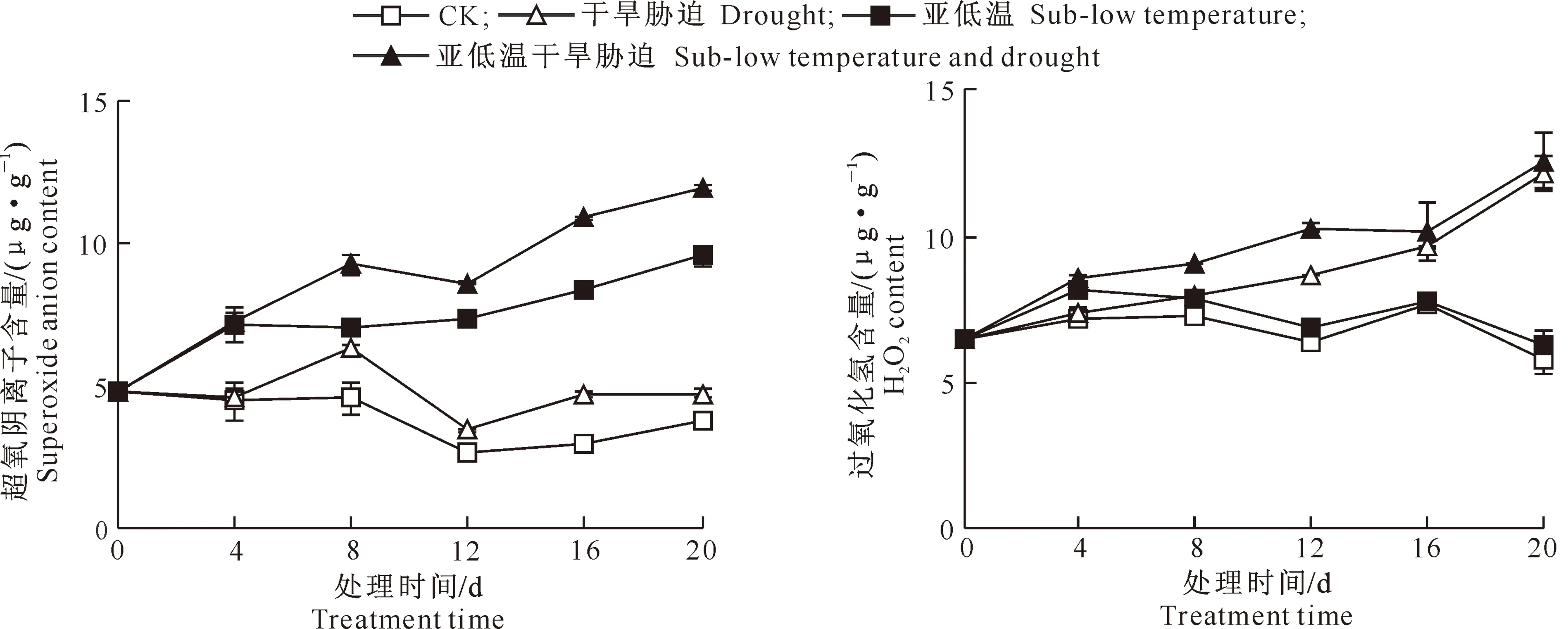
图4 亚低温下干旱胁迫对番茄叶片超氧阴离子和过氧化氢含量的影响
Fig.4 Effects of drought under sub-low temperature on superoxide anion and H2O2contents of tomato leaves
2.4 亚低温下干旱胁迫对番茄叶片抗氧化酶活性的影响
从图5可以看出,与对照相比,干旱胁迫、亚低温及亚低温干旱处理番茄叶片中SOD、POD和CAT活性均升高。亚低温干旱处理下SOD活性虽高于干旱胁迫和亚低温处理,但并无显著差异。POD活性在处理初期(0~4 d)各处理间差异不显著,处理第8天后,各处理间差异达显著水平,干旱胁迫处理活性最高,亚低温干旱胁迫处理次之,亚低温处理最小。CAT活性在处理前期(0~8 d)以亚低温处理最高,处理第8天后亚低温干旱胁迫处理最高,亚低温处理除第8天、20天外均显著高于干旱胁迫处理。不同胁迫处理下活性氧的种类及含量不同,造成各抗氧化酶对不同胁迫处理的敏感程度及响应机制也不同。
2.5 亚低温下干旱胁迫对番茄叶片AsA-GSH循环的影响
AsA-GSH循环是清除活性氧、生成AsA和GSH的重要途径。在这个循环中有4种酶参与,APX、GR分别作为起始和末端在AsA-GSH循环中起重要作用。由图6可知,与对照相比,干旱胁迫处理前期(0~8 d)番茄叶片GR活性显著升高,中后期(8~20 d)降低但仍高于对照(CK),而APX活性除在处理第8,16天显著高于对照外,其余时间变化不显著;亚低温处理下GR活性在中后期(8~12 d)、APX活性在后期(12~20 d)均显著增高;亚低温干旱处理下两者活性均呈阶梯形增加,处理20 d后,APX、GR活性分别是对照的390%和230%。以上结果说明,亚低温干旱处理下AsA-GSH循环反应速度显著加快且呈阶段性增加,而单一干旱和亚低温处理需要一定时间的诱导。

图5 亚低温下干旱胁迫对番茄叶片SOD、POD及CAT活性的影响
Fig.5 Effects of drought under sub-low temperature on SOD,POD and CAT activities of tomato leaves
AsA和GSH作为重要的抗氧化物质,也是AsA-GSH循环的底物。从图6可以看出,不同处理的ASA和GSH含量变化有所差异。与对照相比,随处理时间的延长,亚低温和亚低温干旱处理下AsA含量均呈增加趋势,处理前期(0~8 d)亚低温处理AsA含量较亚低温干旱处理高,而中后期(8~20 d)则相反;与对照相比,亚低温和亚低温干旱处理GSH含量均显著升高,且亚低温处理比亚低温干旱处理高8%~34%。干旱处理番茄叶片中AsA和GSH含量均比对照高,但AsA含量仅第8天显著高于对照,GSH含量在第6、16天显著高于对照。
DHA、GSSG作为AsA和GSH的氧化态,其含量变化有所不同。如图6所示,DHA含量除对照和干旱胁迫处理外,其他处理均随处理时间的延长表现为增高-降低的变化趋势;亚低温处理与亚低温干旱处理均在第16,20天低于对照;干旱胁迫处理DHA含量随处理时间的延长表现为增高-降低-增高的变化趋势,但始终高于对照。GSSG含量在亚低温干旱处理和干旱胁迫处理下均高于对照,且以亚低温干旱处理最高,亚低温处理下其含量呈下降趋势,从第8天起低于对照,处理20 d时较对照低41%。可见,胁迫会导致植株体内抗氧化物质含量增加来维持氧化还原势,抗氧化物质对温度胁迫反应较为敏感,而亚低温干旱胁迫下抗氧化物质的氧化还原反应更活跃。
3 结论与讨论
3.1 亚低温下干旱胁迫对番茄叶片水分状况与渗透调节物质的影响
植株体内的水分状况主要是由根系对水分的吸收和叶片的蒸腾作用来决定的。本试验结果表明,干旱胁迫和亚低温处理引起番茄植株叶片含水量不同程度下降及恢复,这可能是不同胁迫下植株维持体内水分平衡的机制不同引起的。前人研究表明,干旱条件下植株根系可吸收的土壤有效水分减少,诱导根系生成大量ABA,运输至叶片导致气孔关闭,从而减少水分的散失,维持水分平衡[14-15]。Aroca等[16]的研究结果表明,在低温条件下,引起叶片水分亏缺的主要原因是土壤及细胞中水分黏滞力变大,水分移动困难,根系吸水能力下降;此外,邹国元等[17]发现,在低温下由于植株代谢减弱,ABA合成较慢,影响气孔关闭,导致植株水分恢复能力有限。本试验中亚低温干旱处理下叶片含水量下降后持续维持在较低水平,可能与干旱和亚低温胁迫下的水分平衡机制共同作用有关。

图6 亚低温下干旱胁迫对番茄叶片AsA-GSH循环的影响
植株在胁迫下会积累大量的脯氨酸和可溶性糖,用来调节细胞渗透势,维持细胞水分平衡。本试验结果表明,干旱、亚低温下番茄叶片中脯氨酸和可溶性糖含量均增加,这与潘昕等[18]和Luo等[19]的研究结果一致。其中干旱胁迫下以脯氨酸的积累较多,这也证明了任文伟等[20]的结论,脯氨酸是植物对干旱胁迫反应较为敏感的一种渗透调节物质。本试验中亚低温下可溶性糖积累较多,Jacobsen等[21]通过对藜麦的研究也发现,4 ℃下处理10 d,可溶性糖含量增加了10倍,而脯氨酸含量增加了4.3倍,可能是由于可溶性糖不仅可以降低冰点,还可作为储能物质,充当抗冻物质保护蛋白质结构和功能[22]。而亚低温干旱处理下的植株同时受低温和干旱胁迫,导致脯氨酸和可溶性糖进一步积累。
3.2 亚低温下干旱胁迫对番茄叶片细胞氧化伤害及活性氧代谢的影响
活性氧的产生是有氧代谢不可避免的结果,在正常条件下植物自身的清除机制会使其含量维持在一定水平内。但在胁迫条件下,活性氧产生与清除的平衡被打破,过多的活性氧积累则会对细胞造成氧化伤害[23]。白洁等[24]和刘景安等[25]发现,在8~15 ℃的亚低温条件下,植物的细胞膜相对透性、超氧阴离子、H2O2及丙二醛含量会显著升高,且随处理时间延长持续增加;在干旱条件下,也有相同的变化。本研究也证明了这种变化,但同时也发现,不同的环境刺激产生的活性氧种类不同。亚低温条件下产生MDA及超氧阴离子较多,而干旱胁迫下以产生H2O2为主。亚低温干旱共同胁迫下三者含量均最高,对细胞的伤害更大,这可能与清除ROS的各种抗氧化酶对胁迫的敏感程度不同有关。
活性氧虽对细胞造成了氧化伤害,但ROS作为第二信使可以启动各种植株体内的防御体系,减轻对细胞的伤害[26]。SOD、POD及CAT作为抗氧化酶体系中的重要成员,SOD主要负责清除超氧阴离子,90%以上的超氧阴离子可通过SOD催化发生歧化作用生成H2O2而被清除[27]。这个过程伴随超氧阴离子含量的减少及H2O2积累的增多。CAT对H2O2的清除有专一性,但对H2O2的亲和力较低[28];此外,CAT还是一种光失活酶,需要在光下不断合成CAT蛋白才能维持其活力,其光修复对外界因素异常敏感[29]。本试验中,亚低温下CAT活性升高,而刘玉凤等[30]发现在昼25 ℃/夜9 ℃下CAT活性下降,这可能就与CAT的光修复对温度的要求有关。H2O2在植物体内还可以通过POD和APX清除。本试验中,干旱胁迫处理下番茄叶片H2O2过量积累,而CAT和APX活性升高不显著,所以其清除可能主要依靠POD;亚低温下则主要依靠CAT;亚低温干旱胁迫下可同时启动CAT、APX及POD清除,但APX起主要作用。
AsA-GSH循环是APX清除H2O2的主要途径。APX作为该循环的起始,催化AsA和H2O2反应生成DHA。本试验中,处理前期(0~8 d)亚低温处理的AsA、DHA含量均增加,且以AsA增加最为显著,APX活性变化不明显;中后期(12~20 d)AsA含量和APX活性上升,而DHA含量下降。说明亚低温胁迫前期主要激发了ASA的合成系统,后期ASA不再新合成而是由DHA还原后生成。而罗娅等[4]以草莓为材料,在0 ℃下进行的研究认为,ASA的氧化速率大于生成速率,这可能与材料及温度胁迫程度不同有关。本试验中干旱胁迫处理的AsA、DHA含量和APX活性均高于对照,但差异不显著,且亚低温干旱胁迫处理的APX、AsA及DHA变化与亚低温处理相似,可见抗坏血酸系统变化对低温敏感,这与前人的研究结论[4,30]相同。这可能是因为低温促进了APX基因的表达,进而影响一些抗冷基因的表达[31-32]。
GR催化AsA-GSH循环的最后一步,将NADPH的电子传给GSSG形成GSH[33]。其中GSH含量及GR活性提高可增强植株抗氧化能力,可作为抗氧化状态的重要标志。前人研究发现,用PEG预处理的种子或经低温锻炼的植株GSH含量均比不经处理的植株高,GR活性的升高有利于GSH含量的提高,保持谷胱甘肽库处于还原态[34-35]。本研究中各胁迫处理下各种抗氧化酶、抗氧化物质含量显著增加,但同时活性氧含量增大,细胞受害程度加剧,说明胁迫下活性氧的生成速率超过了清除速率,造成细胞膜受到伤害。
综上所述,亚低温胁迫对叶片水分的影响较干旱胁迫大,亚低温干旱胁迫下叶片水分下降且不可恢复。亚低温和干旱胁迫下因渗透调节物质性质不同,物质的积累也不同,但亚低温干旱共同胁迫具有低温胁迫和干旱胁迫信号,可同时积累大量脯氨酸和可溶性糖。亚低温和干旱胁迫对番茄植株叶片造成了氧化伤害,启动了抗氧化机制,亚低温胁迫造成的氧化伤害较干旱胁迫大,抗氧化系统活性也较干旱胁迫高;亚低温干旱胁迫下氧化伤害进一步加剧,但抗氧化系统中各抗氧化组分并没有全部表现为最大活性。
[1] 宋永骏,杨延杰.亚低温对茄子幼苗叶片渗透调节物质含量及活性氧清除物质的影响 [J].华北农学报,2011,26(4):228-231.
Song Y J,Yang Y J.Effects of sub-low temperature treatment on content of osmoregulation substances and scavenging substances of active oxygen in eggplant seedlings leaves [J].Acta Agriculturae Boreali-Sinica,2011,26(4):228-231.(in Chinese)
[2] 李建明,王 平,李 江.灌溉量对亚低温下温室番茄生理生化与品质的影响 [J].农业工程学报,2010,26(2):129-134.
Li J M,Wang P,Li J.Effect of irrigation amount on physiology,biochemistry and fruit quality of greenhouse tomato under sub-low temperatures [J].Transactions of the Chinese Society of Agricultural Engineering,2010,26(2):129-134.(in Chinese)
[3] 徐 菲,李建明,赵志华,等.亚低温及水分双因素对番茄幼苗生理特性的影响 [J].西北农林科技大学学报:自然科学版,2013,41(5):127-135.
Xu F,Li J M,Zhao Z H,et al.Effects of sub-low temperature and water physiological properties of tomato double factors on seedling [J].Journal of Northwest A&F University:Natural Science Edition,2013,41(5):127-135.(in Chinese)
[4] 罗 娅,汤浩茹,张 勇.低温胁迫对草莓叶片SOD和AsA-GSH循环酶系统的影响 [J].园艺学报,2007,36(6):1405-1410.
Luo Y,Tang H R,Zhang Y.Effect of low temperature stress on activities of sod and enzymes of ascorbate-glutathione cycle [J].Acta Horticulturae Sinica,2007,34(6):1405-1410.(in Chinese)
[5] 马玉华,马锋旺,马小卫,等.干旱胁迫对苹果叶片抗坏血酸含量及其代谢相关酶活性的影响 [J]. 西北农林科技大学学报:自然科学版,2008,36(3):150-154,160.
Ma Y H,Ma F W,Ma X W,et al.Effects of drought stress on ascorbic acid contents and activities of related metabolic enzymes in apple leaves [J].Journal of Northwest A&F University:Natural Science Edition,2008,36(3):150-154,160.(in Chinese)
[6] 高俊凤.植物生理学实验指导 [M].北京: 高等教育出版社,2006.
Gao J F.Plant physiology experiment instruction [M].Beijing:Higher Education Press,2006.(in Chinese)
[7] 王爱国,罗广华.植物的超氧物自由基与羟胺反应的定量关系 [J].植物生理学通讯,1990(6):55-57.
Wang A G,Luo G H.Quantitative relation between the reaction of hydroxylamine and sugeroxide anion radicals in plants [J].Plant Physiology Communications,1990(6):55-57.(in Chinese)
[8] 林植芳,李双顺,林桂珠,等.衰老叶片和叶绿体中H2O2的累积与膜脂过氧化的关系 [J].植物生理学报,1988,14(1):16-22.
Lin Z F,Li S S,Lin G Z,et al.The accumulation of hydrogen peroxide in senescing leaves and chloroplasts in relation to lipid peroxidation [J].Acta Phytophysiol Sinica,1988,14(1):16-22.(in Chinese)
[9] Nakano Y,Asada K.Purification of ascorbate peroxidase in spinach chloroplasts;its inactivation in ascorbate-depleted medium and reactivation by monodehydroascorbate radical [J].Plant and Cell Physiology,1987,28(1):131-140.
[10] Ma F W,Cheng L L.Exposure of the shaded side of apple fruit to full sun leads to up-regulation of both the xanthophyll cycle and the ascorbate-glutathione cycle [J].Plant Science,2004,166(6):1479-1486.
[11] Foyer C H,Halliwell B.The presence of glutathione and glutathione reductase in chloroplasts:A proposed role in ascorbic acid metabolism [J].Planta,1976,133(1):21-25.
[12] 孙 群.植物生理学研究技术 [M].陕西杨凌:西北农林科技大学出版社,2006.
Sun Q.Plant physiology research techniques [M].Yangling,Shaanxi:Science and Technology Press of Northwest A&F University,2006.(in Chinese)
[13] 李建明,王静静,王 平,等.亚低温条件下水分对温室番茄生理生化指标及产量的影响 [J].西北农林科技大学学报:自然科学版,2010,38(6):127-132.
Li J M,Wang J J,Wang P,et al.Influence of sub-low temperatures on the physiological,biochemical and yield indice of tomato in different irrigation amounts in greenhouse [J].Journal of Northwest A&F University:Natual Science Edition,2010,38(6):127-132.(in Chinese)
[14] 闫志利,轩春香,牛俊义,等.干旱胁迫及复水对豌豆根系内源激素含量的影响 [J].中国生态农业学报,2009,17(2):297-301.
Yan Z L,Xuan C X,Niu J Y,et al.Effect of drought stress and water recovery on endogenous hormone content in roots of pea [J].Chinese Journal of Eco-Agriculture,2009,17(2):297-301.(in Chinese)
[15] 周宇飞,王德权,陆樟镳,等.干旱胁迫对持绿性高粱光合特性和内源激素ABA、CTK含量的影响 [J].中国农业科学,2014,47(4):655-663.
Zhou Y F,Wang D Q,Lu Z B,et al.Effects of drought stress on photosynthetic characteristics and endogenous hormone ABA and CTK contents in green-stayed sorghum [J].Scientia Agricultura Sinica,2014,47(4):655-663.(in Chinese)
[16] Aroca R,Vernieri P,Irigoyen J J,et al.Involvement of abscisic acid in leaf and root of maize (ZeamaysL.) in avoiding chilling-induced water stress [J].Plant Science,2003,165(3):671-679.
[17] 邹国元,杨志福,李晓林.低温下钾在植物水分调节中的作用 [J].中国农业大学学报,1999,4(1):21-25.
Zou G Y,Yang Z F,Li X L.Effect of potassium application on water regulation of maize plant under low temperature [J].Journal of China Agricultural University,1999,4(1):21-25.(in Chinese)
[18] 潘 昕,李吉跃,王军辉,等.干旱胁迫对青藏高原4种灌木生理指标的影响 [J].林业科学研究,2013,26(3):352-358.
Pan X,Li J Y,Wang J H,et al.The impact of drought stress on physiological indicators of four shrub species on the Qinghai-tibet plateau [J].Forest Research,2013,26(3):352-358.(in Chinese)
[19] Luo Y,Tang H R,Zhang Y.Production of reactive oxygen species and antioxidant metabolism about strawberry leaves to low temperatures [J].Journal of Agricultural Science,2011,3(2):89-96.
[20] 任文伟,钱 吉,马 骏,等.不同地理种群羊草在聚乙二醇胁迫下含水量和游离脯氨酸含量的比较 [J].生态学报,2000,20(2):349-352.
Ren W W,Qian J,Ma J,et al.Comparative study ofLeymuschinensis’s water content and free proline of different geographic populations under the force of different consistency PEG [J].Acta Ecologica Sinica,2000,20(2):349-352.(in Chinese)
[21] Jacobsen S E,Monteros C,Corcuera L J,et al.Frost resistance mechanisms in quinoa (ChenopodiumquinoaWilld.) [J].European Journal of Agronomy,2007,26(4):471-475.
[22] Matysik J,Bhalu B,Mohanty P.Molecular mechanisms of que-nching of reactive oxygen species by proline under stress in plants [J].Current Science,2002,82(5):525-532.
[23] Sharma P,Jha A B,Dubey R S,et al.Reactive oxygen species,oxidative damage,and antioxidative defense mechanism in plants under stressful conditions [J].Journal of Botany,2012,2012:1-26.
[24] 白 洁,蒋卫杰,余宏军,等.外源ABA、Put和BR对亚适温条件下番茄幼苗叶片保护酶活性的影响 [J].中国农学通报,2007,23(6):317-320.
Bai J,Jiang W J,Yu H J,et al.Effect of extrinsic ABA,Put and BR on protective enzyme activities of tomato seedlings under sub- optimal temperature [J].Chinese Agricultural Science Bulletin,2007,23(6):317-320.(in Chinese)
[25] 刘景安,孙玉文,祁家保,等.持续亚低温对甜瓜幼苗生理生化指标的影响 [J].中国农学通报,2008,24(11):240-243.
Liu J A,Sun Y W,Qi J B,et al.Influence of sustained sub-low temperature on the physiological and biochemical indices of muskmelon (CucumismelonL.) seedings [J].Chinese Agricultural Science Bulletin,2008,24(11):240-243.(in Chinese)
[26] Ray P D,Huang B W,Tsuji Y.Reactive oxygen species (ROS) homeostasis and redox regulation in cellular signaling [J].Cellular Signalling,2012,24(5):981-990.
[27] 李凯龙,王艺潼,韩晓雪,等.低钾胁迫对番茄叶片活性氧及抗氧化酶系的影响 [J].西北植物学报,2013,33(1):66-73.
Li K L,Wang Y T,Han X X,et al.Changes in reactive oxygen species and antioxidative defense mechanism in tomato leaves under low potassium stress [J].Acta Botanica Boreali-Occidentalia Sinica,2013,33(1):66-73.(in Chinese)
[28] 李潮海,尹 飞,王 群.不同耐旱性玉米杂交种及其亲本叶片活性氧代谢对水分胁迫的响应 [J].生态学报,2006,26(6):1912-1919.
Li C H,Yin F,Wang Q.Response of activated oxygen metabolism to water stress in different drought-tolerant maize hybrids and their parents [J].Acta Ecologica Sinica,2006,26(6):1912-1919.(in Chinese)
[29] 赵丽英,邓西平,山 仑.活性氧清除系统对干旱胁迫的响应机制 [J].西北植物学报,2005,25(2):413-418.
Zhao L Y,Deng X P,Shan L.The response mechanism of active oxygen species removing system to drought stress [J].Acta Botanica Boreali-Occidentalia Sinica,2005,25(2):413-418.(in Chinese)
[30] 刘玉凤,李天来,高晓倩.夜间低温胁迫对番茄叶片活性氧代谢及AsA-GSH循环的影响 [J].西北植物学报,2011,31(4): 707-714.
Liu Y F,Li T L,Gao X Q.Active oxygen metabolism and ascorbate-glutathione cycle of tomato leaves under low nocturnal temperature [J].Acta Botanica Boreali-Occidentalia Sinica,2011,31(4):707-714.(in Chinese)
[31] Maruta T,Noshi M,Tanouchi A,et al.H2O2-triggered retrograde signaling from chloroplasts to nucleus plays specific role in response to stress [J].Journal of Biological Chemistry,2012,287(15):11717-11729.
[32] Duan M,Feng H L,Wang L Y,et al.Overexpression of thylakoidal ascorbate peroxidase shows enhanced resistance to chilling stress in tomato [J].Journal of Plant Physiology,2012,169(9):867-877.
[33] Wu J C,Wu J J,Liang J,et al.Effects of exogenous NO on AsA-GSH circulation metabolism in young loquat fruit mitochondria under low temperature stress [J].Pakistan Journal of Botany,2012,44(3):847-851.
[34] Dong X,Bi H,Wu G,et al.Drought-induced chilling tolerance in cucumber involves membrane stabilisation improved by antioxidant system [J].International Journal of Plant Production,2013,7(1):67-80.
[35] Zhang Y,Luo Y,Hou Y X,et al.Chilling acclimation induced changes in the distribution of H2O2and antioxidant system of strawberry leaves [J].Agricultural Journal,2008,3(4):286-291.
Effects of drought under sub-low temperature on water content and reactive oxygen metabolism of tomato leaves
DU Qing-jie,LI Jian-ming,PAN Tong-hua,CHANG Yi-bo, LIU Guo-ying,HUANG Hong-rong
(CollegeofHorticulture,NorthwestA&FUniversity,Yangling,Shaanxi712100,China)
【Objective】 The relationship between water supply under low temperature and water status as well as ROS metabolism of tomato leaves was explored to provide theoretical basis for water management of greenhouse in winter. 【Method】 Tomato variety Jinpeng 1 was used for pot experiment in climatic chamber and changes in water content,osmotic substances,reactive oxygen,anti-oxidase activities and AsA-GSH recycle in leaves were studied.The treatments included normal temperature (day/night 25 ℃/18 ℃) and water (75%-85% of field capacity),normal temperature and drought (55%-65% of field capacity),sub-low temperature (day/night 15 ℃/8 ℃) and normal water,and sub-low temperature and drought. 【Result】 Water contents in leaves declined under chilling condition,and chilling and drought did not enhance moisture reduction but stopped the recovery of water contents.Pro was the main osmotic substance under drought,soluble sugar was the main one under chilling,and both of them were the highest under chilling and drought condition.Both MDA and relative permeability under simultaneous stress were greater than separate treatment of either chilling or drought.The generation and elimination mechanisms of ROS were different for different treatments.Under chilling condition,ROS was accumulated mainly by O-·2,and cleared by SOD and CAT.Under drought condition,ROS was accumulated mainly by H2O2,and cleared by SOD and POD.Under chilling and drought stress,ROS,SOD and CAT were the highest.APX,GR,AsA and GSSG were also the highest in AsA-GSH recycle compared to the control.【Conclusion】 Tomato leaves were more sensitive to sub-low temperature,and the damage could be mitigated by reasonable irrigation.
tomato;sub-low temperature;water stress;leaves water;ROS metabolism
时间:2015-11-11 16:16
10.13207/j.cnki.jnwafu.2015.12.022
2014-04-08
国家“十二五”科技支撑计划项目(2011BAD29B01);国家“863”高新技术研究与发展计划项目(2011AA100504)
杜清洁(1991-),男,山西长子人,硕士,主要从事设施作物生理生态研究。 E-mail:duqj91@163.com
李建明(1966-),男,陕西洛川人,教授,博士生导师,主要从事设施园艺研究。E-mail:lijianming66@163.com
S641.201
A
1671-9387(2015)12-0151-09
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20151111.1616.044.html

