三条两亲性多肽的自组装行为及酸敏特性
梁 菊 来丹玉 吴文澜 李国芝 李军波 方财林(河南科技大学化工与制药学院,河南洛阳4703;河南科技大学医学院,河南洛阳4703)
三条两亲性多肽的自组装行为及酸敏特性
梁 菊1,*来丹玉1吴文澜2李国芝1李军波1方财林1
(1河南科技大学化工与制药学院,河南洛阳471023;2河南科技大学医学院,河南洛阳471023)
通过固相合成法制备了三条疏水端不同的两亲性多肽VVVVVVKKGRGDS(AP1)、C12KKGRGDS (AP2)、FAFAFAKKGRGDS(AP3).自组装行为研究表明,三条多肽在中性条件下(pH 7.0)均能形成球形纳米胶束,透射电子显微镜(TEM)检测其粒径为~30 nm,动态光散射(DLS)测试其粒径分布均一.当pH下降为5.0时,肽链AP1的胶束结构被破坏,TEM视野中没有发现任何自组装体,而肽链AP2和AP3的胶束结构在pH 5.0时依然存在,但AP2的纳米粒子之间明显发生了部分聚集,表现为团聚样分布,AP3组装体的粒径明显增大,形貌变得不规则.DLS测试结果显示,当pH下降到5.0时,肽链AP1在1-1000 nm范围内没有出现吸收峰,AP2呈多峰分布,AP3呈宽单峰分布.DLS的测试结果很好地印证了TEM的测试结果.为了探究三条多肽组装性能不同的二级结构因素,我们对AP1、AP2和AP3进行了圆二色谱(CD)和傅里叶变换红外(FT-IR)光谱测试.结果表明,三条多肽在中性条件下二级结构中均存在一定含量的β-折叠,当pH下降到5.0时,AP1结构中的β-折叠成分显著下降,出现部分无规卷曲.AP2和AP3的β-折叠成分虽有变化,但其CD主峰依然存在.以姜黄素作为模型药物,进一步确认AP1载药胶束的释药行为也具有优良的酸敏感特性.AP1、AP2和AP3在酸性条件下自组装行为的不同,表明调控两亲性多肽的疏水端组成有可能是调控多肽自组装性能的有效手段.AP1组装体有望成为理想的pH响应性载体材料.
自组装;纳米胶束;酸敏感材料;圆二色谱;傅里叶变换红外光谱;多肽二级结构
1 引言
多肽由于自身具有良好的生物相容性和多样的生理功能,作为一类新型的载体材料,在纳米科学和材料学等领域引起了学者们的极大兴趣,1-4尤其是两亲性多肽优良的组装性能,近年来其自组装研究日益成为国际上的热点.
两亲性多肽的概念最早由Kunitake5提出,这类多肽含有一个亲水头和一条疏水尾巴,通过合理调控结构中疏水性尾部长短、间隔区以及亲水性头部的长短可以得到胶束、囊泡、层膜、纳米纤维、纳米管、纳米盘等组装体.6-8例如,Zhang等9对完全由氨基酸残基组成的两亲性多肽分子进行了研究,如A6D、V6D、V6K2等,结果表明这些小分子多肽可以自组装形成纳米管和囊泡结构.Yang等10合成了一系列两亲性多肽((AmX)nH5K15),研究了这些多肽分子的自组装行为,结果表明(AF)6H5K15可以自组装成稳定的纳米胶束.Wang等11研究表明,在功能肽R8的N端引入疏水烷基链可以帮助多肽分子形成稳定的组装体.亲水端的非共价键,如氢键作用和疏水端的疏水缔合作用是组装的根本动力,12但目前各种形貌组装体的形成主要是通过调整肽链的亲、疏水端的长短而实现.
通常来说,两亲性多肽疏水端的组成可以是脂肪族氨基酸、芳香族氨基酸或者烷基链.在水溶液中,脂肪族氨基酸之间可以通过弱的疏水缔合作用结合在一起,烷基链和烷基链之间同样可以通过疏水缔合作用结合,而芳香族氨基酸之间则存在强烈的π-π堆积作用.13因此,疏水端成分的不同,会直接影响两亲性多肽在水中的缔合能力和组装性能.因此,我们设想改变两亲性多肽的疏水端组成,设计合成疏水端不同的两亲性多肽,研究和比较它们的组装性能,为调控两亲性多肽的组装性能提供新的思路和方法.
鉴于以上研究背景,本文设计制备了三条亲水端为KKGRGDS,疏水端不同的两亲性小分子多肽VVVVVVKKGRGDS(AP1)、C12KKGRGDS(AP2)、FAFAFAKKGRGDS(AP3),研究三条两亲性多肽分子的自组装性能和酸敏特性,试图为设计和寻找新的功能化载体材料提供重要参考.
2 实验原料
Fmoc-Arg(Pbf)-OH、Fmoc-Gly-OH、Fmoc-Val (Fmoc)-OH、Fmoc-Phe(Fmoc)-OH、Fmoc-Lys(Fmoc)-OH、Fmoc-Ser(tBu)-OH、Fmoc-Ala-OH、Fmoc-Asp (OtBu)-OH,O-苯并三氮唑-四甲基脲六氟磷酸酯(HBTU)以及2-氯-三苯甲基氯树脂(100-200目,取代度0.4 mmol·g-1,1%二乙烯基苯(DVB)均购于上海吉尔生化有限公司,可直接使用.哌啶、三氟乙酸(TFA)、二甲基亚砜(DMSO)、1,2-乙二硫醇(EDT)、苯酚、硬脂酸均购自国药集团(上海)化学试剂公司,直接使用.苯甲硫醚于Acros购得.二异丙基乙胺(DiEA)、N,N-二甲基甲酰胺(DMF)和二氯甲烷(DCM)购自上海化学试剂公司,加无水硫酸镁干燥,重蒸后使用.姜黄素(Curcumin)购于阿拉丁试剂公司,磷酸盐缓冲溶液(PBS)从Gibco购得.
3 小分子多肽的制备及其表征
3.1 小分子多肽的制备
采用多肽固相合成法,14-16以“Fmoc化学”策略手动合成,17AP1、AP2、AP3其化学结构式如图1所示.
以AP1多肽的合成为例,具体步骤如下:(1)树脂溶胀:称取1.5 g 2-氯-三苯甲基氯树脂(取代度0.4 mmol·g-1)加于含有DMF的反应柱中,搅拌1 h以充分溶胀树脂.(2)氨基酸缩合:除去DMF,加入Fmoc-Ser(tBu)-OH和DiEA的DMF溶液.其中,氨基酸和DiEA的投料量分别相当于树脂中氯取代度的2倍(1.2 mmol)和4倍(2.4 mmol),室温下搅拌2 h.(3)甲醇封闭:用DMF洗涤3次后,加入含有过量甲醇和2.4 mmol DiEA的DMF混合溶液继续搅拌1 h,使树脂中未参与氨基酸连接反应的活性氯基团完全封闭.(4)脱Fmoc保护:DMF洗涤3次后,加入15 mL 20%哌啶/DMF(体积比)溶液搅拌,除去多肽序列末端氨基酸上的Fmoc保护基,处理10 min,2次,之后用DMF洗涤4次.然后,将1.8 mmol Fmoc保护氨基酸、2.4 mmol HBTU、2.4 mmol HOBt和3.6 mmol DiEA溶解于DMF中,活化羧基后加入反应柱,重复步骤(2),完成后续氨基酸的缩合反应.反应完毕,用茚三酮的甲醇溶液(10 mg·mL-1)验证氨基是否缩合完全,若溶液发蓝或发红表示缩合不完全,需重复缩合步骤,若溶液为明亮黄色或未变色,表示此步缩合反应完成.用4×10 mL CH2Cl2洗涤树脂,充分洗干,于真空干燥箱中干燥24 h,得目标多肽.用电喷雾电离质谱仪(ESI-MS)检测多肽的分子量,通过多电荷峰计算分子量与理论值一致,确认三条肽链的化学结构正确.

图1 三条两亲性多肽的分子结构示意图Fig.1 Schematic of the molecular structures of three amphiphilic peptides
3.2 多肽组装体的TEM测试和DLS测试
将多肽AP1、AP2和AP3直接溶解于pH 7.0的二次蒸馏水和pH 5.0的稀盐酸溶液中,静置数分钟.18多肽组装体的形貌用透射电子显微镜(JEM-100CX II型,Japan)观测.样品制备过程:将带有Formvar膜的铜网在多肽溶液中浸泡后取出,沉积数分钟后吸去多余的液体,之后用磷钨酸溶液负性染色,干燥后进行观测.多肽组装体在水相中的粒径以及粒径分布通过动态光散射仪(DLS)在37°C的环境下进行测定.
3.3 多肽组装体的二级结构研究
将pH 7.0和pH 5.0多肽AP1、AP2和AP3的水溶液分别置于体积为200µL、厚度为0.5 mm的石英样品池中,用圆二色谱(CD)仪(J-810型,Jasco Ltd.)分析自组装多肽的二级结构.扫描波长范围为185-500 nm,扫描速率为0.25 nm·s-1,最终的CD图谱为3次扫描的叠加.
将pH 7.0和pH 5.0多肽AP1、AP2和AP3的水溶液于-45°C下冷冻干燥.分别取少量pH 7.0和pH 5.0的冻干粉和KBr研磨压制成圆片,使用红外分光光度计(AVATAR 360型,Perkin-Elmer)检测样品的红外吸收光谱.
3.4 AP1的药物包载及体外释药
将多肽AP1(10 mg)与姜黄素(2 mg)溶解于5 mL DMSO中,置于截留分子量为1000 Da的透析袋中,将其放入装有2000 mL pH 7.0的PBS中透析4 h.4 h后将PBS更换为pH 7.0的二次蒸馏水,继续透析24 h.19
将包载了姜黄素的多肽组装体冷冻干燥后溶解于1 mL的DMSO中,在485 nm处测得药物的紫外吸收值,从标准工作曲线中计算出组装体对姜黄素的包封率(EE)和载药量(LL).包封率和载药量分别定义如下:

药物包载完毕后,将透析袋直接浸入装有10 mL二次蒸馏水的50 mL离心管中,于37°C下进行体外药物释放实验(振荡器转速为120 r·min-1).按设定的时长,每隔一段时间取出离心管中的全部溶液,另加10 mL新鲜的蒸馏水至离心管中.姜黄素的含量通过荧光光度计(LS55型,Perkin-Elmer)测定.姜黄素的最大激发波长为440 nm,最大发射波长为530 nm.通过标准工作曲线计算药物浓度.实验采用3组平行样释药,通过平均值得到相应的积累释放量.
4 实验结果与讨论
4.1 多肽组装体的形貌研究
多肽组装体的形貌通过TEM观察,如图2所示.结果表明,三条多肽在中性条件下(pH 7.0)能形成形态均一的小尺寸纳米胶束(图2(a-c)),TEM显示其粒径均为~30 nm.当pH下降为5.0时,多肽分子AP1的胶束结构被破坏,TEM视野中没有发现任何自组装体.多肽AP2和AP3的胶束结构在pH 5.0时依然存在,但AP2的纳米粒之间明显发生了部分聚集,表现为团聚样或纤维状分布,AP3的胶束粒径增大,形貌变得不规则(图2(d,e)).
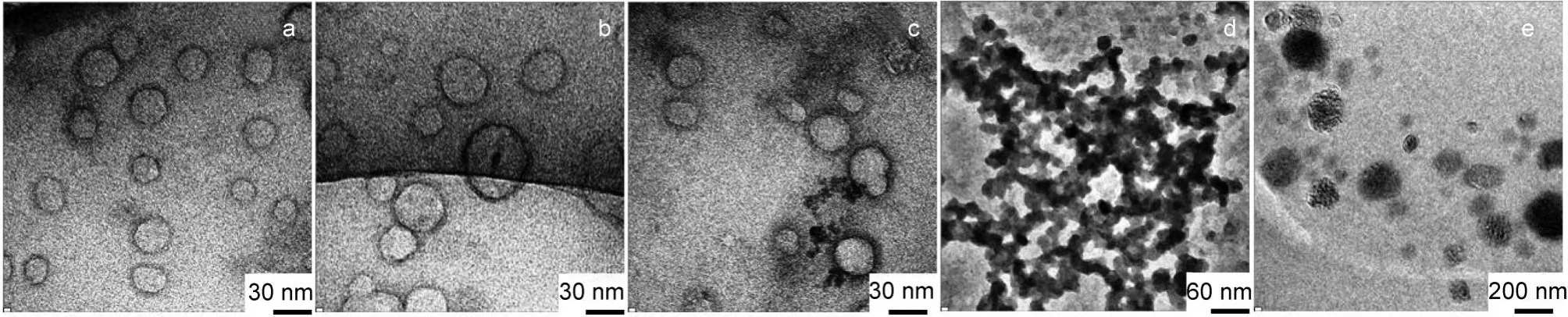
图2 三种两亲性多肽自组装体在中性(pH 7.0)(a:AP1;b:AP2;c:AP3)和酸性(pH 5.0)(d:AP2;e:AP3)介质中的TEM图片Fig.2 TEM images of three self-assembled amphiphilic peptides in neutral medium(pH 7.0)
同时,我们利用DLS对三条多肽的粒径和粒径分布进行了检测.结果显示,中性条件下,AP1、AP2和AP3的平均粒径分别为~89 nm(PDI 0.239)、~142 nm(PDI 0.371)和~116 nm(PDI 0.208),三者在中性条件下的自组装性能良好,形成了形态均一的纳米胶束,与TEM的测试结果相符合.酸性条件下(pH 5.0),AP1的DLS结果显示,在1-1000 nm范围内未检测到吸收峰的出现,AP2和AP3的DLS吸收峰呈现多重峰或宽峰分布,推测原因是由于酸性条件下,胶束发生了团聚或形貌变的不规则,这个结果也在一定意义上佐证了TEM的测试结果.三条多肽的DLS测试结果如图3所示.
4.2 多肽的二级结构研究
圆二色谱和傅里叶变换红外(FT-IR)光谱测试发现,pH 7.0时多肽AP1在水溶液中存在部分β-折叠构象,在195 nm处出现正峰,而当pH下降为5.0时,此处的吸收峰消失,出现典型的无规卷曲峰形.从FT-IR图谱来看,pH 7.0时AP1在酰胺I带(1600-1700 cm-1)1634和1680 cm-1处出现了强吸收的β-折叠特征峰,而在pH 5.0时该处的吸收峰相对强度明显减弱.多肽AP2和AP3在pH 7.0时,其CD图谱显示,与AP1相似,同样存在一定的β-折叠构象,在195 nm处出现正峰,当pH下降到5.0时,AP2在195 nm处仍然出现正峰,但峰型稍变宽,多肽AP3在pH 5.0时,195 nm处的峰出现裂分,强度下降.多肽AP2和AP3在pH 7.0时的FT-IR图谱同样出现了酰胺I带特征的β-折叠峰,分别位于1629、1686 cm-1和1630、1682 cm-1.当pH下降到5.0时,AP2和AP3酰胺I带吸收峰的强度变化不明显,但AP2的峰型明显变宽.由此可以看出,随着pH下降,多肽AP1分子结构中β-折叠的相对含量下降,AP2和AP3结构中的β-折叠成分虽有变化,但其CD主峰依然存在.三条多肽在pH 7.0和pH 5.0时的CD图谱和FT-IR图谱如图4和图5所示.
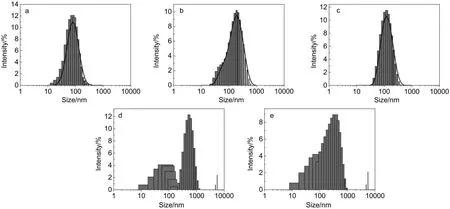
图3 三种两亲性多肽自组装体在中性(pH 7.0)(a:AP1;b:AP2;c:AP3)和酸性(pH 5.0)(d:AP2;e:AP3)介质中的粒径分布情况Fig.3 Size distribution of three self-assembled amphiphilic peptides in neutral medium(pH 7.0) (a:AP1;b:AP2;c:AP3)and acid medium(pH 5.0)(d:AP2;e:AP3)
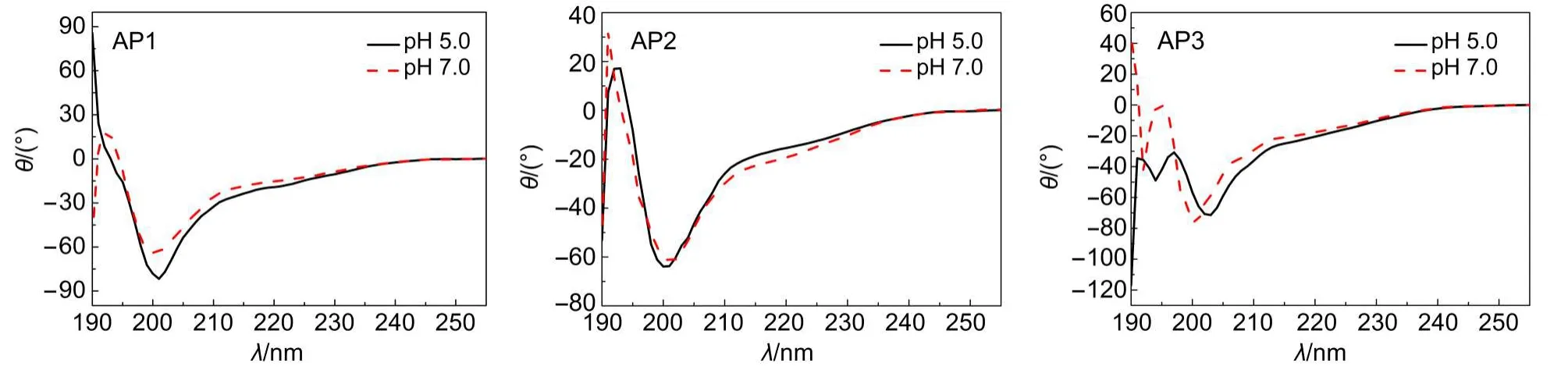
图4 三种多肽自组装体在中性(pH 7.0)和酸性(pH 5.0)介质中的CD图谱Fig.4 CD spectra of three self-assembled peptides in neutral medium(pH 7.0)and acidic medium(pH 5.0)
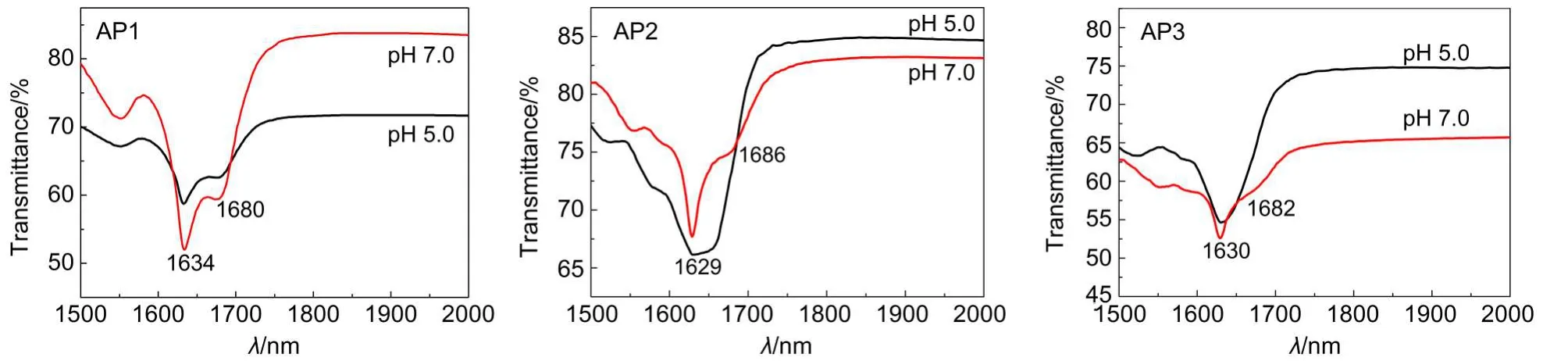
图5 三种多肽自组装体在中性(pH 7.0)和酸性(pH 5.0)介质中的FT-IR图谱Fig.5 FT-IR spectra of three self-assembled peptides in neutral medium(pH 7.0)and acidic medium(pH 5.0)
4.3 多肽AP1的药物包载及药物释放行为
为测试多肽AP1的药物包载和释放能力,选用疏水性抗癌药物姜黄素作为模型药物,研究了AP1的体外药物释放行为.结果显示,AP1组装的纳米胶束对姜黄素的包封率和载药量分别为(4.06±0.30)%和(1.60±0.10)%.从所测得数据,可以看出AP1纳米胶束对姜黄素的包封率和载药量较小,分析原因可能是多肽AP1疏水端VVVVVV形成的胶束内核相对较小导致的.我们对AP1载药胶束进行了体外释药研究,结果显示,pH 7.0时姜黄素的释放速率缓慢,72 h的累积释药量仅为28%,当改变释药介质pH为5.0后,姜黄素的释放出现了暴释现象,4 h的累积释药量达到86%,表明AP1载药胶束的释药行为也具有显著的酸依赖性(如图6所示).

图6 中性(pH 7.0)和酸性(pH 5.0)介质中姜黄素从AP1载药胶束中的释药行为Fig.6 Release behavior of curcumin fromAP1 micelles in neutral medium(pH 7.0)and acidic medium(pH 5.0)
5 结论
设计制备了三种新型的两亲性多肽VVVVVV KKGRGDS(AP1)、C12KKGRGDS(AP2)、FAFAFAK KGRGDS(AP3).在中性介质(pH 7.0)中,三条多肽均能形成形态均一的小尺寸纳米胶束,当pH下降为5.0时,多肽AP1的胶束结构被破坏,而AP2和AP3的胶束结构依然存在,表明多肽AP1的自组装行为具有显著的酸敏感特性.CD和FT-IR测试结果进一步证实了在中性和酸性条件下多肽AP1的二级结构发生了变化,AP2和AP3的二级结构特征变化不明显.分析三条多肽的分子结构(如图1所示),我们可以看出,多肽AP1的疏水端是VVVVVV,亲水端是KKGRGDS,在中性条件下,疏水端通过疏水缔合作用,亲水端通过氢键作用形成壳核结构状的稳定胶束,当改变环境为酸性时,亲水端赖氨酸(K,pKa=10.54)和精氨酸(R,pKa=12.48)残基的离子化程度加剧,导致多肽分子间的静电斥力增强,削弱了多肽分子间的氢键作用力,再加上疏水端VVVVVV之间的疏水缔合作用也比较弱(V的侧基脂肪链为异丙基,属于较短的脂肪链),导致胶束稳定性下降,胶束结构消失.多肽AP2和AP3在酸性条件下的胶束结构虽然有变化,但依然存在组装体,分析原因可能是因为AP2和AP3的亲水端虽然和AP1相同,但他们的疏水端分别是C12脂肪链和FAFAFA,C12脂肪链之间存在较强的疏水缔合作用,而F和F之间具有较强的π-π堆积力,这种疏水端较强的作用力导致其在酸性条件下依然可以形成组装体.据此,我们可以推断两亲性多肽疏水端疏水缔合作用的强弱是影响其自组装稳定性的重要因素.这种疏水端变化导致两亲性多肽自组装稳定性发生变化的现象对设计新的功能化多肽材料具有重要的借鉴意义,值得我们后续去深入研究.
肿瘤区域具有区别于正常组织的特殊微环境,如pH值偏低等特点.基于此,近年来,各种pH敏感型的药物载体被合成出来用于抗癌药物的传递,20,21这些材料不仅可以实现在肿瘤部位的智能释药,而且可以有效降低药物的毒副作用,提高抗肿瘤效果.然而,这些载体材料大多是一些嵌段高聚物,其制备方法复杂,形成的纳米组装体粒径较大,生物相容性差.因此,鉴于肿瘤组织的酸性微环境特征和多肽自身良好的生物相容性,AP1多肽组装体有望成为新的、理想的pH敏感型载体材料,用于抗癌药物的智能传递.
(1) Mao,X.B.;Wang,C.X.;Liu,L.;Ma,X.J.;Niu,L.;Yang,Y. L.;Wang,C.Acta Phys.-Chim.Sin.2010,26(4),850.[毛晓波,王晨轩,刘 磊,马晓晶,牛 琳,杨延莲,王 琛.物理化学学报,2010,26(4),850.]doi:10.3866/PKU.WHXB20100440
(2) Chen,C.;Chu,Y.Q.;Dai,X.H.;Fang,X.;Ding,C.F.Acta Phys.-Chim.Sin.2013,29(6),1336.[陈 琛,储艳秋,戴新华,方 向,丁传凡.物理化学学报,2013,29(6),1336.] doi:10.3866/PKU.WHXB201303155
(3) Zhou,C.C.;Wang,M.Z.;Zou,K.D.;Chen,J.;Zhu,Y.Q.;Du, J.Z.ACS Macro Letters 2013,2,1021.doi:10.1021/mz400480z
(4) Chen,J.;Wang,F.Y.K.;Liu,Q.M.;Du,J.Z.Chemical Communications 2014,50,14482.
(5) Kunitake,T.Angew.Chem.Int.Edit.Engl.1992,31(6),709.
(6) Hartgerink,J.D.;Beniash,E.;Stupp,S.I.Science 2001,294 (5547),1684.doi:10.1126/science.1063187
(7) Hartgerink,J.D.;Beniash,E.;Stupp,S.I.Proc.Natl.Acad.Sci. U.S.A.2002,99(8),5133.doi:10.1073/pnas.072699999
(8) Cui,H.G.;Webber,M.J.;Stupp,S.I.Biopolymers 2010,94 (1),1.doi:10.1002/bip.21328
(9) Vauthey,S.;Santoso,S.;Gong,H.Y.;Watson,N.;Zhang,S.G. Proc.Natl.Acad.Sci.U.S.A.2002,99(8),5355.
(10) Wiradharma,N.;Tong,Y.W.;Yang,Y.Y.Macromol.Rapid Commun.2010,31,1212.doi:10.1002/marc.v31:13
(11) Wang,H.Y.;Chen,J.X.;Sun,Y.X.;Deng,J.Z.;Li,C.;Zhang, X.Z.;Zhuo,R.X.J.Control Release 2011,155(1),26.doi: 10.1016/j.jconrel.2010.12.009
(12) Xu,X.D.;Jin,Y.;Liu,Y.;Zhang,X.Z.;Zhuo,R.X.Colloids Surf.B Biointerfaces 2010,81(1),329.doi:10.1016/j. colsurfb.2010.07.027
(13) Zhang,S.G.Nat.Biotechnol.2003,21,1171.
(14) Lee,E.S.;Gao,Z.;Kim,D.;Park,K.,Kwon,I.C.;Bae,Y.H. J.Control Release 2008,129(3),228.doi:10.1016/j. jconrel.2008.04.024
(15) Xu,X.D.;Lin,B.B.;Feng,J.;Wang,Y.;Cheng,S.X.;Zhang, X.Z.;Zhuo,R.X.Macromol.Rapid Commun.2012,33(5), 426.doi:10.1002/marc.201100689
(16) Wiranharma,N.;Tong,Y.W.;Yang,Y.Y.Biomaterials 2009,30 (17),3100.doi:10.1016/j.biomaterials.2009.03.006
(17) Chang,C.;Wei,H.;Feng,J.;Wang,Z.C.;Wu,X.J.;Wu,D.Q.; Cheng,S.X.;Zhang,X.Z.;Zhuo,R.X.Macromolecules 2009, 42(13),4838.doi:10.1021/ma900492v
(18) Guo,X.D.;Tangiono,F.;Wiranharma,N.;Khor,D.;Tan,C.G.; Khan,M.;Qian,Y.;Yang,Y.Y.Biomaterials 2008,29(36), 4838.doi:10.1016/j.biomaterials.2008.07.053
(19) Liang,J.;Wu,W.L.;Xu,X.D.;Zhuo,R.X.;Zhang,X.Z. Colloids and Surfaces B:Biointerfaces 2014,114,398.doi: 10.1016/j.colsurfb.2013.10.037
(20) Li,Q.;Li,M.;Jin,Y.G.;Du,L.N.;Su,C.;Dong,J.X.J.Int. Pharm.Res.2013,40(2),233.
(21) Chen,D.W.;Yan,L.;Qiao,M.X.;Hu,H.Y.;Zhao,X.L.; Chen,X.;Deng,Y.H.Acta Pharmaceutica Sinica 2008,43 (10),1066.
Self-Assembly and Acid-Responsive Behavior of Three Amphiphilic Peptides
LIANG Ju1,*LAI Dan-Yu1WU Wen-Lan2LI Guo-Zhi1LI Jun-Bo1FANG Cai-Lin1
(1Chemical Engineering and Pharmaceutics School,Henan University of Science and Technology,Luoyang 471023, Henan Province,P.R.China;2Medical School,Henan University of Science and Technology, Luoyang 471023,Henan Province,P.R.China)
Three amphiphilic peptides containing KKGRGDS as hydrophilic heads and VVVVVV,C12,and FAFAFAas hydrophobic tails(VVVVVVKKGRGDS(AP1),C12KKGRGDS(AP2),FAFAFAKKGRGDS(AP3))were designed and prepared using the standard solid-phase peptide synthesis(SPPS)technique.Three peptides assembled into spherical micelles under neutral conditions(pH 7.0)with a size of~30 nm determined by transmission electron microscope(TEM).Dynamic light scattering(DLS)tests showed that their size distributions were uniform and narrow.In dilute hydrochloric acid(pH 5.0),peptideAP1 presented a sharp aciddependent demicellization transition,with no assembled particles found by TEM and no DLS peak in the range 1-1000 nm.However,the micellar structures of the amphiphilic peptidesAP2 andAP3 did not disappear at pH 5.0.TEM results showed that AP2 assembly appeared through aggregation and the shape of AP3 micellar particles became non-spherical or irregular.AP2 assembly at pH 5.0 showed a multiple peak distribution and AP3 assembly showed a broad peak distribution in DLS,consistent with the TEM results.The changes insecondary structures of amphiphilic peptidesAP1,AP2,andAP3 at pH 7.0 and 5.0 were confirmed by circular dichroism(CD)and Fourier transform infrared(FT-IR)spectroscopy.We then selected curcumin as a model drug to investigate the drug-loading capacity and in vitro release behavior of peptideAP1 micelles.As a result, AP1 is expected to comprise an ideal acid-responsive drug carrier for the intelligent delivery of anticancer drugs. The differences betweenAP1,AP2,andAP3 assembly behaviors in neutral and acidic conditions provide a novel and effective approach for regulating self-assembly of peptides.AP1 is expected to offer an ideal pH-responsive functional material.©Editorial office ofActa Physico-Chimica Sinica
Self-assembly;Nano-sized micelle;Acid-sensitive material;Circular dichroism; Fourier transform infrared spectroscopy;Secondary structure of peptide
O648
10.3866/PKU.WHXB201503031www.whxb.pku.edu.cn
Received:October 16,2014;Revised:March 2,2015;Published on Web:March 3,2015.
∗Corresponding author.Email:liangju@haust.edu.cn:Tel:+86-379-64231914.
The project was supported by the National Natural Science Foundation of China(51403055).
国家自然科学基金(51403055)资助项目

