杉木中等位酶与早期生长性状间的相关研究
翁春媚,齐 明,王海蓉,华朝晖,包小梅
(1. 浙江省遂昌县林业技术推广总站,浙江 遂昌 323300;2. 中国林业科学研究院亚热带林业研究所,浙江 富阳 311400)
杉木中等位酶与早期生长性状间的相关研究
翁春媚1,齐 明2*,王海蓉1,华朝晖1,包小梅1
(1. 浙江省遂昌县林业技术推广总站,浙江 遂昌 323300;2. 中国林业科学研究院亚热带林业研究所,浙江 富阳 311400)
从杉木种子园中采集 11个优良品种自由授粉家系的分系种子开展杉木等位酶与早期生长性状间的相关研究,PAGE等位酶实验共筛选出 9个等位酶用于遗传分析。结果表明,苗高、地径在家系间存在显著差异,研究群体存在丰富的遗传变异;有5个等位酶位点(基因型)与苗高生长显著相关,其中X8(MNR-1)和X14(SKDH-1)为正效应,其它X2(GOT-2)、X9(MNR-2)和X15(SKDH-2)均为负效应,不同位点对苗高性状表达的作用不等效;有5个等位酶位点与地径的生长显著相关,其中除了X15为正效应外(纯合体有利于地径的生长),其它X7(MDH-4)、X12(6PGD-2)、X14(SKDH-1)和X17(Me-2)均为负效应,不同位点对地径性状表达的作用也不等效;比较地径和苗高,还发现SKDH-1和SKDH-2同时对地径苗高有作用,但作用方向相反:SKDH-2纯合体BB有利于地径生长,SKDH-2杂合体AB有利于苗高的生长;SKDH-1纯合体BB有利于苗高生长,SKDH-1杂合体AB有利于地径的生长。
杉木;等位酶;PAGE;早期鉴定
林木的早期性状一直倍受育种工作者的重视,因为将它们用于早期鉴定、早期选择时,会缩短林木的育种周期。Li和Mckeand[1]指出,即使在早晚相关较弱的情况下,早期选择也会节约时间和财力。早期选择的假设是假定一组的基因在早期控制某一经济性状的表达,并且在林木生长发育(成熟)过程中继续表达,这构成了林木早晚相关的基础。由于林木在不同的生长阶段,林木的生长、发育和成熟是由多种类型的多基因控制的,当然也会有部分基因一直表达[2]。尽管林木发育阶段多基因调控的复杂性,但是早期生长性状是后来生长、发育的基础和表现良好的指示剂[3]。成本和收益分析[4]揭示出,即使早晚相关低到 0.6,调整早期选择的方法进行早期选择比推迟选择划算。因为这个原因,评价早期生长性状仍然是值得做的工作。因为基因型选择比表型选择更可靠,早期选择的遗传基础是等位酶与早期性状间的相关。只要这种相关在统计上是显著的,便可用于选择优良的基因型。
近年来,随分子生物学的发展,利用分子标记研究生物变异也越来越广泛。但相比而言,用同工酶研究林木遗传变异具有操作简单、成本低、共显性表达、能间接反映DNA水平的变异等优点。等位酶技术已经广泛地应用在众多的用材树种的遗传育种工作中,十分成熟。
通过利用中性标记与影响数量性状的基因位点之间的连锁或相关关系,进行标记辅助选择(MAS)的方法,来改良现有的商业用材林。MAS能够在早期淘汰那些不具有生长潜力的亲本或个体,从而大大地降低了子代测定的规模与时间。本研究采用Bush[5]和Smouse[6]的适应距离法来研究生长性状与等位酶间的相关,目的是为标记辅助选择、育种材料的早期鉴定以及杂交育种亲本选配提供参考依据。
1 材料与方法
1.1 育苗试验
2010年从浙江省遂昌县杉木(Cunninghamia lanceolata)种子园中采集11个自由授粉家系的分系种子,它们是龙15、闽33、阳11、1391、1419、高37、1366、靖70、丽55、1278、1339,江西红心杉混种作对照,共12份品种。于2011年3月,在富阳万市展开容器育苗,塑料杯高13 cm、直径14 cm,培养基质为稻田土与河沙按3:1的比例进行混均,再加3 g/kg复合肥,每个培养杯播5粒种子,完全随机区组设计,三个区组10株行状小区,5月份间苗至每杯1株。整个试验到12月结束,进行苗高、地径调查,采用Matlab7.0软件进行数据分析。
1.2 等位酶分析
抽取 11个优良家系进行等位酶分析(红心杉对照不包括在PAGE实验中)。PAGE等位酶实验是用每个品种10粒种子的胚乳。电泳缓冲体系,染色方法、酶的命名都是沿用国际著名学者(如:Yeh FC)淀粉胶电泳的体系,酶的遗传控制与连锁的研究结果亦与他们一致[7~12]。
经过预备试验,从21个等位酶系统中,筛选出9个等位酶,用于遗传分析,参与分析的这9个等位酶是6-磷酸葡萄糖脱氢酶(6-PGD E.C.1.1.1.44)、苹果酸脱氢酶(MDH,EC.1.1.1.37)、苹果酸酶(ME, E.C.1.1.1.40)、α-淀粉酶(α-Amylase, E.C.3.2.1.1)、甲酸脱氢酶(FDH, E.C.1.2.1.2)、莽草酸脱氢酶(SKDH, E.C.1.1.1.26)、谷氨酸草酰乙酸转氨酶(Got, E.C.2.6.1.1)、维生素K3降解酶(Mnr, E.C.1.6.99.2)、磷酸葡萄糖异构酶(PGI E.C.5.3.1.9),共9个酶系统21位点,18个多态位点,每个位点2个基因。所有这些酶系统显示出孟德尔方式遗传和共显性表达,并且到现在为止,在杉木中尚未发现这些酶位点形成紧密连锁群。
1.3 回归分析
在回归分析前,我们假定[13~17]:①11个自由授粉的家系采自多系种子园,种子园花粉随机授粉,同一家系的种子间是半同胞关系(因此家系平均值即为一般配合力);②等位酶标记在等位基因间是共显性;③在不同的位点间等位酶标记间不存在上位效应;④等位酶不同位点间简单而稳定的遗传,不存在连锁;⑤遗传符合孟德尔遗传规律;⑥数量性状是由多基因控制的;⑦与某个数量性状相关的等位酶基因位于相同或不同的染色体上。
基于以上假设,采用如下模型(表 1)进行相关性研究。一个位点两个基因A和B,对应基因频率分别是p和q,群体近交比率s = 0.1[18]。
以亲本苗高和地径平均值为变量,等位酶位点上的基因型值为自变量,采用DPS软件进行回归分析,以研究等位酶与数量性状间的相关,分析结果如下。

表1 使用遗传变量来预测基因型的适合度[9]Table 1 Fitness for predicting genotypes by genetic variables
以亲本苗高和地径平均值为变量,等位酶位点上的基因型值为自变量,采用DPS软件进行回归分析,以研究等位酶与数量性状间的相关,分析结果如下。
2 结果与分析
2.1 苗高地径的差异性分析
育苗基质等环境条件一致,可采用单因素组内观察数不等的模型,进行数据处理,结果见表2。
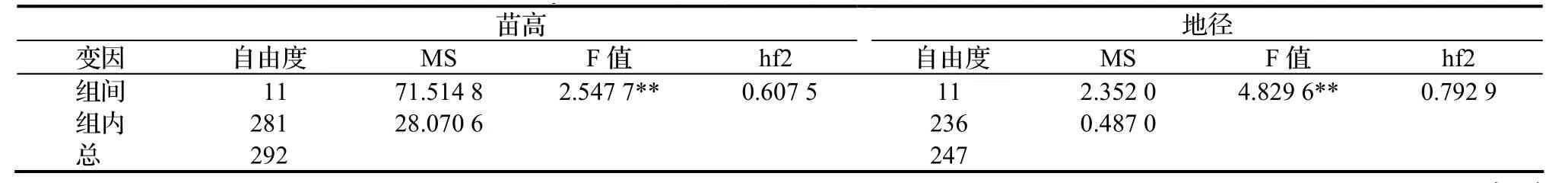
表2 12个杉木品种一年生时苗高、地径方差分析结果Table 2 ANOVA on 1-year seedling height and ground diameter of 12 C. lanceolata families
由表2可见,苗高、地径在家系间存在显著差异,研究群体存在丰富的遗传变异。苗高、地径在家系水平上的遗传力分别为0.607 5和0.792 9。
2.2 等位酶对苗高的回归分析结果
苗高经方差分析,获得亲本的一般配合力,以此为因变量 Z,以不同位点的基因型为自变量,多元回归结果如下:
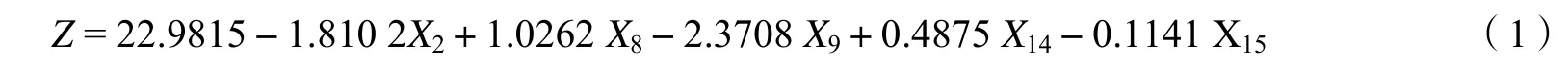
式中,X2为GOT-2上的基因型,X8为MNR-1上的基因型,X9为MNR-2上的基因型,X14为SKDH-1上的基因型,X15为SKDH-2上的基因型,Z是亲本的苗高的一般配合力。

表3 方差分析Table 3 Analysis of variance
由表3可见,(1)式的F值= 2 332.738 6***,所求回归函数极其显著。
(1)式的决定系数R2= 0.999 9,复相关系数R = 0.999 99***的显著性,达到1‰的统计水平。
综合以上结果,可以得出如下结论,(1)式所求回归函数十分有效。入选变量的分析结果列于表4。
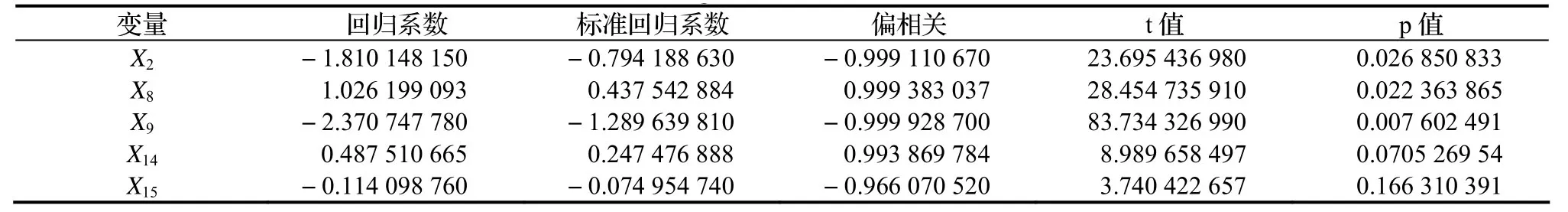
表4 入选变量的回归信息Table 4 Regression of selected variables
由表4可见,逐步回归函数中的自变量(等位酶基因型)与苗高间有显著的相关;不同酶位点对苗高生长的表达不等效,其影响力的顺序为:X9> X2> X8> X14> X15。
2.3 等位酶对地径的回归分析结果
以地径Y为因变量,以不同位点的基因型为自变量,逐步回归函数如下:Y = 3.910 97-0.396 229X7-0.040 962 X12-0.228 84X14+0.039 946 X15-0.02 633 7X17(2)
式中,X7为MDH-4上的基因型,X12为6PGD-2上的基因型,X14为SKDH-1上的基因型,X15为SKDH-2上的基因型,X17为Me-2上的基因型,Z是亲本的地径的一般配合力。
由表5可见,(2)式的F值 = 53 046.068***,所求回归函数极其显著,(2)式的决定系数R2=0.999 9,复相关系数R = 0.999 99***的显著性,达到1‰的统计水平。
综合以上结果,可以得出如下结论,(2)式所求回归函数十分有效。入选变量的分析结果列于表6。

表5 方差分析结果Table 5 Result of ANOVA
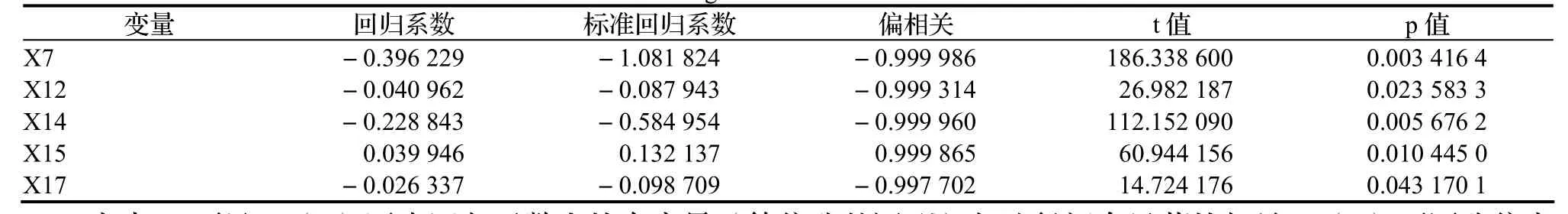
表6 入选变量的回归信息Table 6 Regression of selected variables
由表6 可见,(1)逐步回归函数中的自变量(等位酶基因型)与地径间有显著的相关;(2)不同酶位点对地径生长的表达不等效,其影响力的顺序为:X7> X14> X15> X17> X12,这一研究结果与苗高一致。
3 结论与建议
通过逐步回归分析揭示出,有5个等位酶位点(基因型)与杉木的苗高生长显著相关,其中X8(MNR-1)和X14(SKDH-1)为正效应(纯合体有利于苗高的生长),其它X2(GOT-2)、X9(MNR-2)和X15(SKDH-2)均为负效应,即在这些位点上,杂合体有利于苗高的生长。同时发现不同位点对苗高性状表达的作用不等效。
通过等位酶分析和逐步回归分析,发现亦有5个等位酶位点(基因型)与地径的生长显著相关,其中除了X15(SKDH-2)为正效应外(纯合体有利于地径的生长),其它X7(MDH-4)、X12(6PGD-2)、X14(SKDH-1)和X17(Me-2)均为负效应,即在这些位点上,杂合体有利于地径的生长。与苗高一样,不同位点对地径性状表达的作用不等效。
比较地径和苗高的分析结果,还发现SKDH-1和SKDH-2同时对地径苗高有作用,但作用方向相反:SKDH-2纯合体BB有利于地径生长,SKDH-2杂合体AB有利于苗高的生长;SKDH-1纯合体BB有利于苗高生长,SKDH-1杂合体AB有利于地径的生长。有相同的等位酶作用于苗高、地径的生长,很可能是苗高地径间存在相关的一个原因。
已有的研究表明:同工酶具有组织多型性和组织特异性。Second 和tronslot以及Second发表了他们在水稻中研究的结果:多数的等位酶会在多个器官中表达,只是酶的活力和酶谱式样存在变化。针对这一现象,在杉木遗传改良中如何运用本研究的成果呢?首先要选择相同研究材料,如发芽种子胚乳;其次要采用相同的实验条件,尤其是相同的电泳缓冲体系(注:电极缓冲体系决定了等位酶酶谱式样),那么等位酶实验结果是一致的、可重复的。本研究揭示:有6个等位酶的信息,就可以对杉木种子园中的待测亲本进行初步评选。但本研究有几个问题:在该模型中其一就是BB纯合体总比AA优越,这是模型造成的,所有的学者都这么用这个适合度模型;其二,由于本试验参试家系较少,苗木数较少,未能进行多点造林试验,生长量仅一年生苗高、地径,所以本研究仅是一种探索,研究结果作为未来研究的一种参考;其三,今后要进行扩大试验,采用多地点多年度的资料来详细研究等位酶与经济性状的相关。
[1] Li B, Mckeand J B. Stability of loblolly pine families in the southeastern US[J]. Silvae Genet, 1989(38):96-101.
[2] Aradhya K M, Phillips V D. Lack of association between allozyme heterozygosity and juvenile traits in Eucalyptus[J].New For, 1995(9):97 -110.
[3] Lowe W J, van Buijtenen J P. The incorporation of early testing procedures into an operational tree improvement program[J]. Silvae Genet, 1989 (38):181-184.
[4] Nanson A. Juvenile and correlated trait selection and its effect on selection programs[C]/ Proc. IUFRO 2nd meeting on Quantitative Geneitics, Raleigh, NC. USDA Forest Ser., Southern Forest Exp. Sta., New Orleans, Louisiana. 17-26.
[5] Bush R.M.,Smouse P. E., Ledig F. TH. The fitness consequences of multiple-locus heterozygosity: the relationship between heterozygosity and growth rate in pitch pine[J]. Evolution,1987, 41(4):787-798.
[6] Smouse P E. The fitness consequences of multiple-locus heterozygosity under the multiplicative overdominance and inbreeding depression model[J]. Evolution, 1986(40):946-957.
[7] Yeh F C, D O’Malley. Enzyme variations in natural populations of Douglas-fir, Pseudotsuga menziesii (Mirb.)Franco,from British Columbia. I. Genetic variation patterns in Coastal Populations[J]. Silvae Genet, 1980, 29(2/3):83-92.
[8] Yeh F C, Layton C. The organization of genetic variability in central and marginal population of lodgepole pine (Pinus contorta spp. latifolia)[J]. Can J Genet Cytol, 1979(21):487-503.
[9] Yeh F C, Morgan K. Mating system and multilocus association in a natural population of Pseudotsuga menziesii (Mirb.)[J]. Theor Appl Genet,
1987(73):799-808.
[10] El-kassably Y A, Yeh F C, Sziklai O. Inheritance of allozyme variants in coastal Douglas-fir(Pseudotsuga menzzeszz var menzzeszz )[J]. Can J Genet Cytol, 1982(24):325-335.
[11] Vladimir V Potenko. Inheritance of allozymes and genetic variation in natural population of Japanese yew in peitrov island,Russia[J]. For Genet, 2001, 8(4):307-313.
[12] W T Adams, D B Neale, A H Doerksen, et al. Inheritance and linkage of isozyme variants from seed and vegetative bud tissues in coastal
douglas-fir[Pseudotsuga menziesii var. menziesii(Mirb.)Franco][J]. Silvae Genet, 1990, 39(3/4):153-157.
[13] 李学斌. 动物分子标记辅助选择的回归模型[J]. 河南职业技术师范学院学报,2002,30(4):44-46.
[14] 魏志刚,杨传平,潘华. 利用多元回归分析鉴定与白桦纤维长度性状相关的分子标记[J]. 分子植物育种,2006,4(6):835-840.
[15] Prasanta K K, Poem P S, Arvind K A, et al. Genetic variability and association of ISSR markers with some biochemical traits in mulberry genetic resources available in India[J]. Tree Genet Genom, 2008(4):75-83.
[16] David P. Modeling the genetic basis of heterosis: tests of alternative hypothesis[J]. Evolution, 1997(51):1 049-1 057.
[17] Schmidting R C, Carrolli E, Lafarge T. Allozyme Diversity of selected and Natural loblolly pine populations[J]. Silvae Genet, 1999, 48(1):35 -44.
[18] 齐明. 杉木双系种子园异交率的初步研究[J]. 林业科学研究,2004,17(SP):71-77.
Correlation between Allozyme and Early Growth Traits in Cunninghamia lanceolata
WENG Chun-mei1,QI Ming2*,WANG Hai-rong1,HUA Chao-hui1,BAO Xiao-mei
(1. Suichang Forestry Extension Station of Zhejiang, Suichang 323300, China; 2. Research Institute of Subtropical Forestry, Chinese Academy of Forestry, Fuyang, 311400, China)
11 plus families were selected in 2010 from Cunninghamia lanceolata seed orchard in Suichang, Zhejiang province, for container seedling cultivation with one control in March, 2011 in Fuyang of the same province. Determinations of height and ground diameter were implemented in December of the same year. 9 allozymes were selected by polyacrylamid gel electrophoresis method using 10 embryosperms of 11 tested families. Adaptive distance model by Smouse(1986)and Bush (1987) was used, regression models between growth traits and allozyme genotypes had been established. The results showed that seedling height and ground diameter had great differences among families, five allozyme loci had evident correlation with seedling height growth and 5 ones hade significant correlation with ground diameter. The experiment proved that different allozyme loci had different marginal effects on fitness. The result demonstrated that allozyme analysis could be used for the early selection of parents in seed orchard of C. lanceolata.
Cunninghamia lanceolata; allozyme; PAGE; early selection
S718.46
:A
1001-3776(2015)06-0045-05
2015-07-05;
2015-10-25
浙江省”十二五”竹木育种专题“杉木高生产力优质新品种选育及示范”(2012C12908-11)
翁春媚(1965-),女,浙江遂昌人,从事林木遗传育种研究;*通讯作者。

