多聚磷酸盐提取甘薯果胶的物化特性
多聚磷酸盐提取甘薯果胶的物化特性
梁新红,孙俊良*,马汉军,王田林
(河南科技学院食品学院,河南 新乡 453003)
对多聚磷酸钠法提取甘薯果胶的物化性质进行比较研究,并对该方法提取果胶进行凝胶层析,干燥后进行电镜观察及红外光谱分析。结果表明:多聚磷酸盐提果胶黏度为(27.46±0.46)mPa·s,酯化度为(58.22±1.46)%,胶凝度为(151.15±1.32)%,其值均高于盐酸提果胶,与苹果果胶相接近。对果胶进行凝胶层析,表明多聚磷酸盐提果胶的小分子质量成分分布较广。通过电镜观察,多聚磷酸盐法提取的果胶比酸提法提取的果胶结构更为蓬松。红外光谱显示,二者均具有果胶的特征官能团,吸收波数在指纹区略有差异。果胶物化特性分析表明,多聚磷酸盐提甘薯果胶更适合食品工业应用。
多聚磷酸钠;甘薯果胶;物化特性
果胶是一种以半乳糖醛酸为主的复合多糖类聚合物,是植物细胞壁成分之一。果胶物质广泛存在于植物中[1-2]。其化学结构和分子质量在不同的植物组织中不同。果胶通常部分以甲酯化形式存在,天然果胶中约20%~60%的羧基被酯化,分子质量为1~40 kD[3-5]。
果胶在食品工业上主要作为亲水性乳化剂、凝胶剂和增稠剂来使用[6]。因其具有降糖、降胆固醇、促肠胃蠕动及抗肿瘤等功能,故近几年来在功能性食品领域也有较多应用[1,7-9]。
目前国内外提取果胶的方法有水提法[10]、酸提法[11]、盐提法[12]和离子交换树脂法[13]等。其中水提法必须在微波辅助或酶辅助条件下才能进行,离子交换树脂法虽然提取果胶效果较好,但难以实现工业化生产[10]。酸提取法是工业生产果胶较普遍的方法,但研究表明,应用酸提法提取的甘薯果胶黏度、酯化度及凝胶度等物化特性均低于盐提法提取的果胶[11];盐提取法的提取剂一般为草酸铵和多聚偏磷酸钠[12],草酸铵自身是一种有毒化学物质,且在高温下会释放出氨气。而多聚磷酸钠提取果胶具有安全、无污染等特性,更适合果胶的工业化生产及果胶在食品中的应用。
由于我国近几年来甘薯产业的迅速发展,每年产生上千万吨的薯渣,大部分用于饲料或者作为肥料,同时,由于鲜薯渣含水量高达80%,不易贮运[14],因此废弃干薯渣的处理问题亟待解决。研究分析表明,干的甘薯渣中含10%~30%的果胶物质[15-16]。Takamine等[17]认为甘薯渣中富含果胶,是提取果胶的良好材料。
本实验主要对以多聚磷酸盐为提取剂提取甘薯废渣中果胶的黏度、酯化度、胶凝度等物化特性进行研究,并与传统酸提法甘薯果胶及Alfa Aesar公司苹果果胶进行比较,同时对多聚磷酸盐提取甘薯果胶与苹果果胶的电镜扫描图片及红外光谱进行了分析,以期对甘薯果胶的进一步开发及工业化应用具有理论及实践意义。
1 材料与方法
1.1 材料与试剂
甘薯:徐薯18号,采自河南科技学院甘薯实验田。
苹果果胶(纯度≥82%)英国Alfa Aesar公司;多聚磷酸钠、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、盐酸天津市德恩化学试剂有限公司;所用试剂均为分析纯。
1.2 仪器与设备
Alphal-4LSC型真空冷冻干燥机德国Christ公司;RVA-Tecmaster型快速黏度分 析仪波通瑞华科学仪器有限公司;Quanta200型环境扫描电子显微镜美国FEI公司;TENSOR27型红外光谱仪德国Bruker公司;WFJ 7200型分光光度计上海尤尼柯仪器有限公司;FW177型粉碎机天津泰斯特仪器有限公司。
1.3方法
1.3.1甘薯果胶提取方法
果胶提取工艺流程:原料→粉碎→去淀粉→去淀粉后的薯渣→提取→过滤→抽滤→超滤→滤液→酒精沉淀→离心→冷冻干燥→粉碎→成品。
工艺要点:1)去淀粉[18]:将一定量的新鲜甘薯用粉碎机粉碎,过40目筛,鲜薯渣水洗数次后,添加适量水加热至95 ℃时加入高温淀粉酶水解30 min,冷却至60 ℃,加入糖化酶、普鲁兰酶水解,水解液依据GB/T 5009.9—2008《食品中淀粉的测定》,检测无淀粉后,以3 000 r/min离心30 min,弃去上清液,沉淀甘薯渣部分烘干备用;2)提取:盐酸法提取的工艺条件为料液比1∶50(m/V,下同)、pH 1.5、提取液温度95 ℃、提取时间2.2 h。多聚磷酸盐的提取条件为料液比1∶50,多聚磷酸钠浓度0.05 mol/L、EDTA浓度0.017 5 mol/L、提取液pH 7.0、提取时间4 h、提取液温度80 ℃。3)沉淀:向经超滤浓缩好的提取中液加入体积分数95%的酒精,使得提取液酒精体积分数达60%以上,在加酒精的过程中应使酒精呈细流状慢慢流下且不断快速搅拌,然后静置1 h,果胶沉淀形成,以6 000 r/min离心30 min,得到果胶沉淀物。4)干燥:果胶沉淀物在冷冻干燥机中冷冻干燥12 h,干燥后的果胶备用。
1.3.2 凝胶柱层析纯化果胶[19]
将果胶粉溶解过Sepharose CL-6B柱,每次上样量为10 mL,沿壁缓缓加入,再加入少许蒸馏水封顶,流速10 mL/15 min,BS-100A自动收集器收集,收集速率为每管15 min,检测果胶含量(A525nm),以吸光度为纵坐标,洗脱管数为横坐标,绘制洗脱曲线。将出峰部分的管内液体合并,冷冻干燥。
1.4分析方法
1.4.1 甘薯果胶纯度测定
采用咔唑比色法[20]测定。
1.4.2 甘薯果胶黏度测定[21]
称量0.25 g的干基果胶溶入25 mL水中,配成质量浓度为1 g/100 mL的溶液,然后在温度为20℃,时间为2 min,转速为160 r/min的快速黏度分析仪中测定其黏度。
1.4.3 甘薯果胶酯化度测定
采用酸碱滴定法[22]测定。
1.4.4 甘薯果胶胶凝度测定
参照QB 2484—2000《食品添加剂 果胶》[22]方法测定。
1.4.5 甘薯果胶电镜观察
采用环境扫描电镜观察。
1.4.6 甘薯果胶的红外光谱
采用红外光谱仪,压片法测定。将干燥的果胶样品与KBr压制成片,在4 000~400 cm-1波数范围测定光谱吸收值。
2 结果与分析
2.1盐酸提取的果胶和多聚磷酸盐提取的果胶纯度和得率分析
表1 盐酸与多聚磷酸盐提取果胶的纯度与得率测定结果(±s,n==44)TTaabbllee 11 PPuurity and yield of sweet potato pectin extracted by hydrochloric acid and polyphosphate ((x±s,, n == 44))
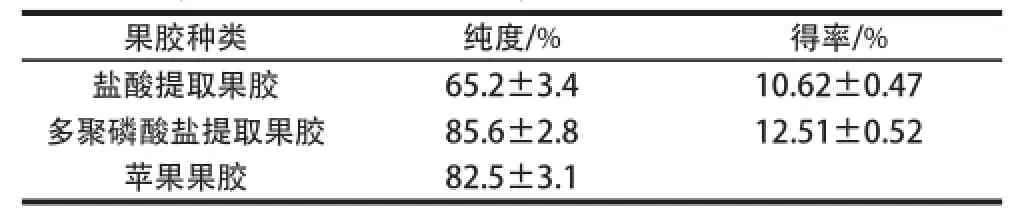
表1 盐酸与多聚磷酸盐提取果胶的纯度与得率测定结果(±s,n==44)TTaabbllee 11 PPuurity and yield of sweet potato pectin extracted by hydrochloric acid and polyphosphate ((x±s,, n == 44))
果胶种类纯度/%得率/%盐酸提取果胶65.2±3.410.62±0.47多聚磷酸盐提取果胶85.6±2.812.51±0.52苹果果胶82.5±3.1
由表1可知,多聚磷酸盐提取果胶的纯度为(8 5.6±2.8)%,远高于盐酸提取果胶的纯度(65.2±3.4)%,略高于苹果果胶;且多聚磷酸盐提取果胶的得率为(12.51±0.52)%,高于盐酸提取果胶的得率(10.62±0.47)%。实验进一步对两种提取剂提取的果胶进行黏度、酯化度和胶凝度等物化特性的检测及分析。
2.2 甘薯果胶黏度分析
果胶溶液流变特性与盐类,特别是钙盐的存在高度相关,另外还与pH值和平均分子质量等相关。果胶的黏度特性影响其在食品中,尤其是饮料中的添加效果。将多聚磷酸钠法与盐酸提取甘薯果胶与苹果果胶的黏度进行比较,结果如图1。
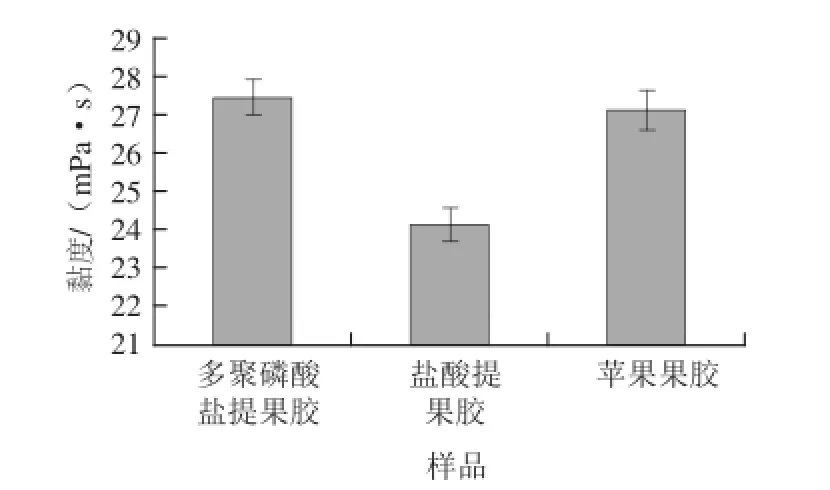
图1 多聚磷酸盐与盐酸提取甘薯果胶黏度的比较(x±s,n==44)Fig.1 Viscosity of sweet potato pectin extracted by hydrochloric acid and polyphos phate ((x±s,, n == 44))
由图1可知,不同提取方法对果胶的黏度是有影响的,盐酸提取的甘薯果胶黏度为(24.14±0.51)mPa·s,多聚磷酸盐提取的甘薯果胶黏度为(27.46±0.46)mPa·s,苹果果胶的黏度为(27.13±0.45)mPa·s。多聚磷酸盐提取的甘薯果胶的黏度明显高于盐酸提取法,同时高于报道的磷酸氢二钠提取法[11],与苹果果胶相接近。这可能与提取剂中含有的盐类与果胶组分有关。
2.3 甘薯果胶酯化度分析
酯化度是果胶分类的最基本指标,也与果胶的各种应用性质密切相关,比如胶凝性、增稠性、蛋白质稳定性等;酯化度亦影响果胶带电荷数量。对多聚磷酸盐提取甘薯果胶酯化度进行分析,结果见图2。
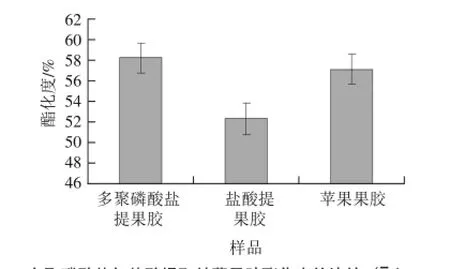
图2 多聚磷酸盐与盐酸提取甘薯果胶酯化度的比较(x±s,n==44)Fig.2 Esterification degree of sweet potato pectin extracted byhydrochloric acid and polyphosphate (x±s,, n == 44))
由图2可知,不同的提取方法对果胶的酯化度是有影响的,多聚磷酸盐提取甘薯果胶产品的酯化度为(58.22±1.46)%,盐酸提取甘薯果胶产品的酯化度为(52.30±1.54)%,苹果果胶的酯化度为(57.12±1.48)%。结果表明,多聚磷酸盐提取甘薯果胶的酯化度明显高于盐酸提取法,并且高于苹果果胶的酯化度,与报道的磷酸氢二钠提取法相近[11]。
2.4 甘薯果胶胶凝度分析
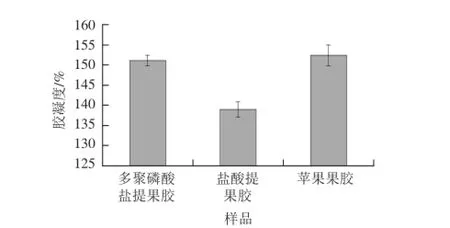
图3 多聚磷酸盐与盐酸提取甘薯果胶胶凝度的比较(x±s,n==44)Fig.3 Gelation degree of sweet potato pectin extracted by hydrochloric acid and polyphosphate (x±s,, n == 44))
果胶在一定条件下能形成凝胶,故广泛应用于食品行业。果胶的胶凝度与提取原料、提取方法及提取工艺条件等有关。对多聚磷酸钠法与盐酸法提取甘薯果胶和苹果果胶的胶凝度进行测定,结果见图3。由图3可知,多聚磷酸盐法提取果胶的胶凝度为(151.15±1.32)%,盐酸法提取果胶的胶凝度为(1 3 9.0 1±1.8 5)%,苹果果胶的胶凝度为(152.36±2.31)%。多聚磷酸盐提取甘薯果胶的胶凝度明显高于盐酸提取法,且高于报道的磷酸氢二钠提取法[11],与苹果果胶的胶凝度相接近。影响果胶胶凝度的因素主要是果胶分子质量和酯化度,高酯化度果胶的胶凝度与二者呈正比,多聚磷酸盐提取果胶胶凝度高可能和其酯化度有关,而且盐酸提取果胶更易水解,分子质量变小,故胶凝度较低。
2.5 甘薯果胶凝胶层析及分级
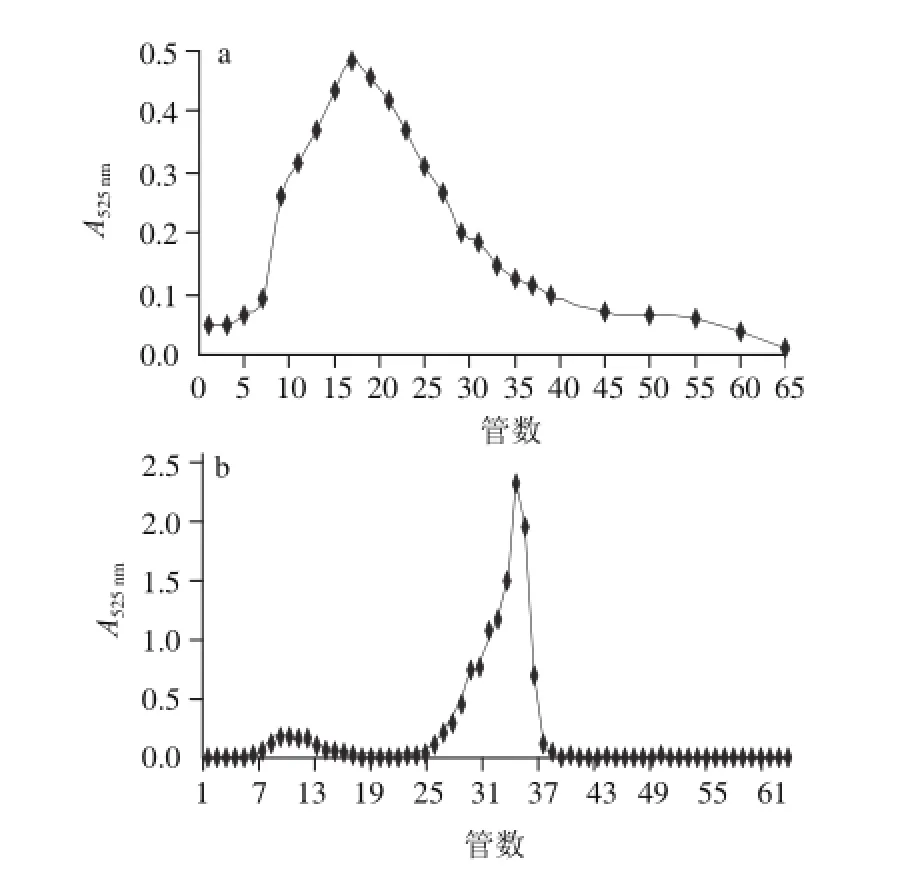
图4 多聚磷酸钠提取(a)和盐酸提取(b)两种方法提取的甘薯果胶洗脱曲线Fig.4 Elution curves of pectin extracted by polyphosphate (a) and hydrochloric acid (b)
凝胶过滤色谱可根据多糖分子的大小和形状不同而将其进行分离。以蒸馏水为洗脱液,经Sepharose CL-6B色谱柱分离,共收集65管样品,收集分离后的果胶液,于525 nm波长处测其吸光度,结果见图4。甘薯果胶经色谱柱分离得到的洗脱图都只有一个对称峰,则表示组分较为均一。由图4a可知,多聚磷酸盐提取的呈现脱尾状,主峰出现后无明显的峰再出现,说明这些小分子果胶分子质量较广。相比之下,盐酸提取果胶在明显大峰前面出现了小峰,说明果胶含量较低,盐酸提取的果胶分子质量从图4b上看相对集中。
2.6 果胶的电镜观察分析
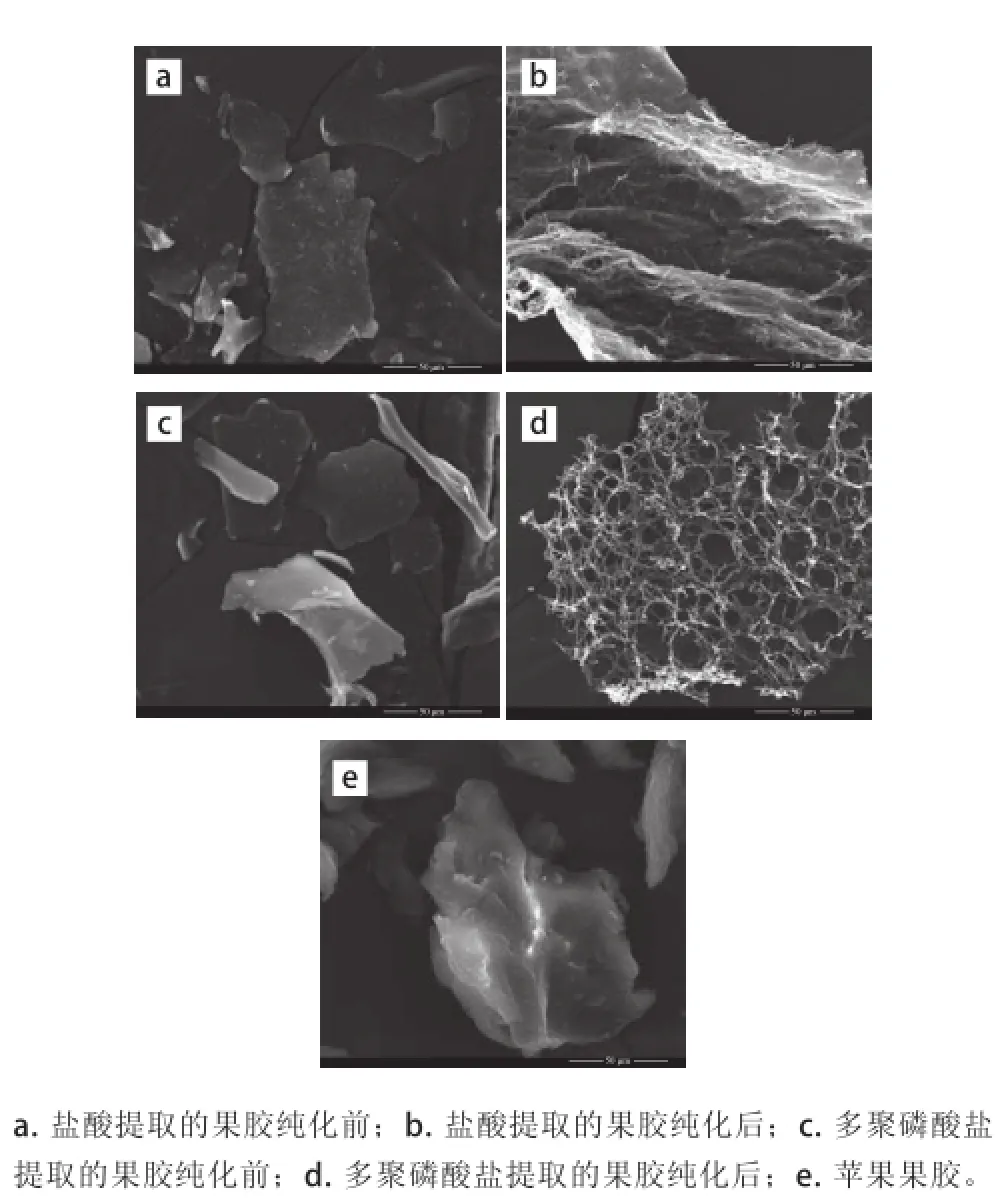
图5 不同处理的甘薯果胶和苹果果胶电镜图Fig.5 Electron micrographs of pectin extracted by phosphate and hydrochloric acid before and after purification
由图5a可知,盐酸提取果胶纯化前多呈片状,厚薄不均一,片上附有颗粒,丝状等杂质。可能是一些淀粉颗粒或纤维类物质。由图5b可知,盐酸提取果胶纯化后结构较为蓬松,类似团状,有空隙。表面附着的较小颗粒的物质较少。由图5c可知,未经纯化的多聚磷酸盐提取的果胶粉碎后电镜下观察多呈厚薄不均匀的无规则片状,上面附有小块状物质,也有呈棒状。由图5d可知,经纯化后的多聚磷酸盐提取果胶骨架为多孔状的网络结构,网孔多且较为均匀。上面几乎未附有其他形态物质。由图5e可知,购买的苹果果胶多呈团块状,透明度较好,表面附着有一些形状较小的物质。由果胶电镜图可以看出,纯化后果胶上附着的形状较小的物质明显减少。主要可能是因为凝胶柱把不同分子质量的物质分开了,这样就去除了一些分子质量较小的和过大的杂质。纯化前大多呈片状或块状,纯化后以网状或絮状出现。可能是果胶的分子质量或其他杂质影响其骨架结构。多聚磷酸盐提取果胶的网状结构较盐酸提取的更蓬松,网孔更加均匀,这样可能更有利于水分的进入,因而多聚磷酸盐提取的果胶更易溶解。
2.7 果胶的红外光谱分析
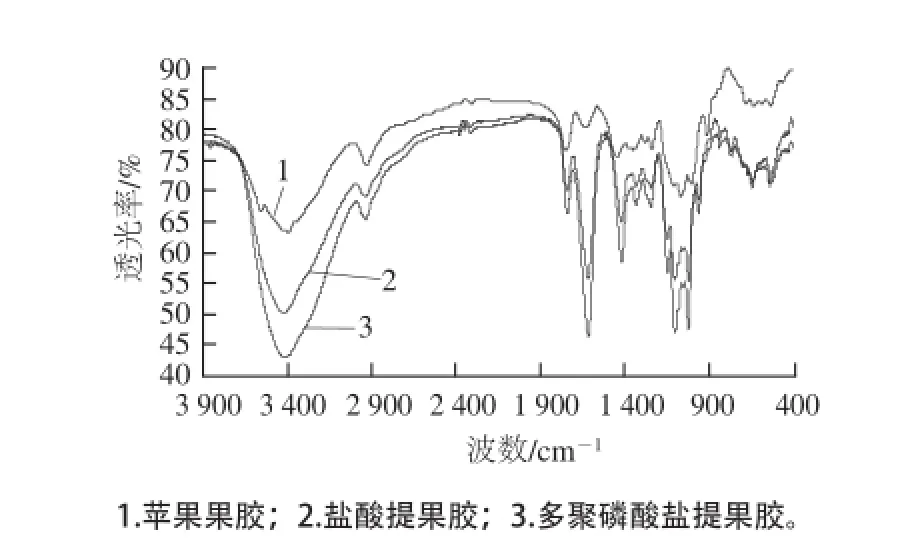
图6 3 种果胶的红外光谱Fig.6 Infrared spectra of three pectins
如图6所示,果胶中官能团对应的波数,在3 650~3 200 cm-1间较为宽广的峰是由O—H伸缩振动吸收引起的,这与果胶分子中半乳糖醛酸主链间或链内部的氢键有关,也可能是由于果胶中所含水分引起[23]。3 000~2 800 cm-1间的吸收峰是由C—H吸收引起的,主要包括—CH、—CH2和—CH3的伸缩振动。—CH2波数在2 930、2 850 cm-1附近。—CH3波数在2 960、2 876 cm-1附近。1 760~1 730 cm-1和1 630~1 600 cm-1间较强的吸收峰,分别由于酯化的羰基和未酯化的羰基红外吸收引起[24]。此外,1 400 cm-1附近还有一个较弱的羰基对称吸收峰;1 300~800 cm-1间有一些中等强度吸收峰,这些峰是果胶的指纹区,其中包括一些不太重要的官能团信息,如1 380cm-1处的C—H弯曲吸收峰,1 300~1 000 cm-1的C=O伸缩振动吸收峰[23]在环状结构的果胶分子中,1 200~1 100 cm-1之间还有R—O—R和C—C的吸收峰,如果有蛋白质与果胶分子结合,在1 560~1 540 cm-1会出现吸收峰[25]。
果胶红外光谱图(图6)表明,多聚磷酸盐提取果胶和盐酸提取果胶的红外光谱中特征官能团对应的波数基本相同。指纹区略有差异,差别不大。苹果果胶的与甘薯果胶在指纹区波数差别较大,可能是由于苹果果胶与甘薯果胶本身所带的侧链基团有差异。此外这几种果胶在1 540~1 560 cm-1均未见吸收峰,可以说明无结合态的蛋白质存在。
3 结 论
多聚磷酸盐提果胶黏度为(27.46±0.46)mPa·s,比盐酸提取果胶高13.75%,与苹果果胶相似;酯化度为(58.22±1.46)%,比盐酸提取果胶高11.32%,略高于苹果果胶;胶凝度为(151.15±1.32)%,比盐酸提取果胶高8.73%,与苹果果胶相似。对多聚磷酸盐提取果胶及盐酸提取果胶进行凝胶层析,表明多聚磷酸盐提取果胶小分子果胶分子质量较广。在电镜观察下,多聚磷酸盐法提取的果胶比盐酸提取法的果胶结构更为蓬松。红外光谱显示,二者均具有果胶的特征官能团,吸收波数在指纹区略有差异。因此,多聚磷酸盐提取甘薯果胶法更具有生产价值,研究对甘薯果胶的开发及生产具有理论及实践意义。
[1] WILLATS W G T, MCCARTNEY L, MACKIE W, et al. Pectin: cell biology and prospects for functional analysis[J]. Plant Molecular Biology, 2001, 47: 9-27.
[2]孙元琳,汤坚.果胶类多糖的研究进展[J].食品与机械, 2004, 20(6): 60-63.
[3]高建华,戴思齐,刘家明.六种果皮原料果胶的理化及凝胶特性比较[J].农业工程学报, 2012, 28(16): 288-292.
[4] KOUBALA B, KANSCI G, MBOME L I, et al. Effect of extraction conditions on some physicochemical characteristics of pectinsfrom“Améliorée” and “Mango”mango peels[J]. Food Hydrocolloids, 2008, 22(7): 1345-1351.
[5] KULKARNI S G, VIJAYANAND P. Effect of extraction conditions on the quality characteristics of pectin from passion fruit peel (Passiflora edulisf.flavicarpaL.)[J]. LWT-Food Science and Technology, 2010, 43: 1026-1031.
[6] FAGAN C C, DONNELL C P, CULLEN P J, et al. The effect of dietary fibre inclusion on milk coagulation kinetics[J]. Journal of Food Engineering, 2004, 77: 261-268.
[7]吕娇,苏昕峰,方国珊,等.果胶改善辣椒素对肠道发酵环境的影响[J].食品科学, 2013, 34(17): 273-277. doi: 10.7506/spkx1002-6630-201317058.
[8]董银萍,李拖平.山楂果胶的抗氧化活性[J].食品科学, 2014, 35(3): 29-32. doi: 10.7506/spkx1002-6630-201403006.
[9]李英华,朱威.果胶的抗肿瘤活性研究进展[J].世界科学技术:中医药现代化, 2014(2): 245-250.
[10] YEOH S, SHI J, LANGRISH T A G. Comparisons between different techniques for water-based extraction of pectin from orange peels[J]. Desalination, 2008, 218: 229-237.
[11]郭祖锋,梁新红,孙俊良.提取工艺对甘薯果胶物化特性影响的研究[J].食品科技, 2012, 37(8): 204-208.
[12]高健,马路山,胡建军.果胶提取技术研究进展[J].食品工业科技, 2014, 35(6): 368-372.
[13]张卫红,耿薇,王晓锋. D151H阳离子树脂法提取果胶的研究[J].食品工业, 2007, 28(6): 20-22.
[14]曹媛媛,木泰华.甘薯膳食纤维的开发[J].食品研究与开发, 2006, 27(9): 152-154.
[15]刘鲁林,木泰华,孙艳丽.不同品种甘薯块根营养成分及相关性分析[J].中国粮油学报, 2008, 23(1): 39-44.
[16]木泰华,魏海香,曹媛媛,等.甘薯果胶物化特性的研究[J].食品工业科技, 2007, 28(9): 179-180.
[17] TAKAMINE K, ABE J, SHIMONO K, et al. Physicochemical and gelling characterization of pectin extracted from sweet potato pulp[J]. Journal of Applied Glycoscience, 2007, 54: 211-216.
[18]孙俊良,梁新红,郭祖峰.甘薯果胶纯化工艺研究[J].食品工业科技, 2013, 34(2): 256-258.
[19]梁新红,孙俊良,唐玉.甘薯渣去除淀粉工艺研究[J].食品工业科技, 2013, 34(2): 205-207.
[20]中华人民共和国农牧渔业部. NY 82.11—1988果汁测定方法果胶的测定[S].北京:中国标准出版社, 1988.
[21] SYNYTSYA A, COPIKOVA J, MATEJIKA P, et al. Fourier transform Raman and infrared spectroscopy of pectins[J]. Carbohydrate Polymers, 2003, 54: 97-106.
[22] 浙江衢州果胶有限公司, 中国食品发酵工业研究所. QB 2484—2000食品添加剂果胶[S].北京:中国标准出版社, 2001.
[23] GNANASAMBANDAM R, PROCTOR A. Determination of pectin degree of esterification by diffuse reflectance Fourier transform infrared spectroscopy[J]. Food Chemistry, 2000, 68: 327-332.
[24] MANRIQUE G D, LAJOLO F M. FT-IR spectroscopy as a tool for measuring degree of methyl esterification in pecans isolated from ripening papaya fruit[J]. Postharvest Biology and Technology, 2002, 25: 99-107.
[25] MONSOOR M A. Effect of drying methods on the functional properties of soy hull pectin[J]. Carbohydrate Polymers, 2005, 61(3): 362-367.
Physicochemical Properties of Sweet Potato Pectin Extracted by Sodium Polyphosphate
LIANG Xinhong, SUN Junliang*, MA Hanjun, WANG Tianlin
(School of Food Science, Henan Institute of Science and Technology, Xinxiang 453003, China)
The physicochemical properties of sweet potato pectin extracted by sodium polyphosphate were investigated. The results showed that the viscosity of sweet potato pectin extracted by sodium polyphosphate was (27.46±0.46) mPa·s, the degree of esterification (58.22±1.46)%, and the degree of gelation (151.15±1.32)%, which were all higher than those of the pectin extracted by hydrochloric acid and similar to those of apple pectin. As observed under electron microscopy, the pectin extracted by polyphosphate was fluffier than that extracted by hydrochloric acid. The infrared spectra showed that both pectins extracted from sweet potato had typical functional groups of pectin, but the wavenumbers varied somewhat in the fingerprint region. This study demonstrates that sodium polyphosphate-extractable pectin from sweet potato has a wider range of application in the food industry.
sodium polyphosphate; sweet potato pectin; physicochemical properties
TS202.3
1002-6630(2015)11-0081-05
10.7506/spkx1002-6630-201511016
2014-07-01
河南省科技计划项目(122102110037);国家自然科学基金面上项目(31171641);
河南省高校科技创新团队支持计划项目(13IRTSTHN006)
梁新红(1971—),女,副教授,博士,研究方向为食品生物技术。E-mail:liangxinhong2005@163.com
*通信作者:孙俊良(1964—),男,教授,博士,研究方向为食品生物技术。E-mail:sjl338@163.com

