荞麦黄酮和荞麦糖醇对胰脂肪酶的抑制作用
杨 鹏,李艳琴*
荞麦黄酮和荞麦糖醇对胰脂肪酶的抑制作用
杨 鹏,李艳琴*
(山西大学生物技术研究所,化学生物学与分子工程教育部重点实验室,山西 太原 030006)
目的:了解荞麦麸皮中活性成分抑制胰脂肪酶的活性。方法:以苦荞麸皮醇提物(主要成分为芦丁)、醇提残渣水解物(主要成分为芦丁、槲皮素和异槲皮素的混合物)和甜荞麸皮水提物(主要成分为荞麦糖醇)为实验材料,测定3 个样品对胰脂肪酶的抑制作用,以市售胰脂肪酶抑制剂——奥利司他为参照;通过研究底物、抑制剂和酶的加入顺序对抑制率的影响,初步确定醇 提水解物的抑制机理。结果:实验材料对胰脂肪酶的抑制作用依次为奥利司他>醇提水解物>醇提物>水提物,半数抑制浓度(IC50)分别为0.47、1.94、2.53、17.6 mg/mL;醇提水解物的抑制作用机理主要是通过苦荞黄酮与底物相互作用,从而阻碍了底物与酶的作用,属于竞争性抑制。结论:荞麦黄酮(即醇提物和醇提水解物)对胰脂肪酶有抑制活性;醇提残渣经高压水解后更有利于其对胰脂肪酶的抑制作用;荞麦糖醇(即水提物)在低质量浓度下抑制效果不明显,在较高的质量浓度下则表现出抑制活性。
荞麦黄酮;荞麦糖醇;芦丁;槲皮素;异槲皮素;胰脂肪酶;抑制剂
荞麦是蓼科(Polygobaceae)荞麦属的药食同源作物,有两个栽培种:苦荞(Fagopyrum tataricum)和甜荞(Fagopyrum esculentum),其中苦荞麸皮中黄酮含量高达7%以上[1]。苦荞黄酮能促进脂肪细胞分化,具有降血脂、降血糖、抗肿瘤和减缓便秘等多种药理活性[2-5]。荞麦糖醇大量富集在甜荞的胚胎和糊粉层,它们在肠道末端被细菌消化,释放出D-手性肌醇,能有效地降低血糖、血甘油三酯水平[6-9]。
胰脂肪酶是由胰腺分泌并对人体内甘油三酯消化吸收过程起关键作用的酶[10]。利用脂肪酶抑制剂可有效抑制肠道中脂肪酶的活性,从而减少进入体内的脂肪代谢,是治疗肥胖的有效策略[11-12]。目前已有文献报道了大黄柳叶、荷叶等植物的黄酮抽提物具有降脂的功效[13-14],但是关于荞麦黄酮、荞麦糖醇对胰脂肪酶的作用还鲜有报道。本实验以苦荞麸皮醇提物和甜荞麸皮水提物为材料,研究了荞麦黄酮(醇提物)和荞麦糖醇(水提物)对胰脂肪酶的抑制能力,并与奥利司他进行比较,筛选出对胰脂肪酶抑制作用较高的成分,以期为充分利用荞麦麸皮、合理开发荞麦降脂功能食品提供一定的依据。
1 材料与方法
1.1材料与试剂
荞麦麸皮提取物由山西省农业科学院农产品加工研究所提供[15]。苦荞麸皮醇提物的主要成分:总黄酮含量为74.0%,其中86.5%是芦丁,槲皮素和异槲皮素微量;醇提后残渣经高压水解得到醇提水解物,总黄酮含量为76.2%,其中,芦丁、槲皮素和异槲皮素分别占60.6%、25.2%、13.5%;甜荞麸皮水提物的主要成分为D-手性肌醇43.6%、肌醇2.9%。
胰脂肪酶、奥利司他、D-手性肌醇 美国Sigma公司;脂肪酶测定试剂盒 南京建成生物工程研究所;实验用水为超纯水。
1.2仪器与设备
Shimadzu-UV2550型紫外-可见分光光度计 日本岛津公司;Inolab精密pH计 德国WTW公司;Polyscience恒温水浴锅美国Polyscience公司。
1.3方法
1.3.1胰脂肪酶溶液配制及其活力测定
称取20 mg胰脂肪酶,溶于10 mL0.1 mol/L的KH2PO4-K2HPO4缓冲液(pH 7.4)中,酶用量为2 mg/mL或4×10-5mol/L。胰脂肪酶活力测定利用脂肪酶测定试剂盒[16]。胰脂肪酶活力单位定义为:在37℃、pH 7.4条件下,每克胰脂肪酶每分钟分解1μmol三油酸甘油酯为1个酶活力单位(U)。
1.3.2抑制剂与酶作用时间的确定
以醇提水解物为抑制剂,取4 mL、37 ℃预热的底物溶液(由试剂盒提供的三油酸甘油酯),加入25μL4 mg/mL的醇提水解物和25μL2 mg/mL的胰脂肪酶溶液,立即混匀,测定不同反应时间胰脂肪酶活性,计算抑制率。
1.3.2 节,反应10 min,测定胰脂肪酶活性,计算抑制率。
1.3.3 荞麦提取物对胰脂肪酶的影响
以不同质量浓度的荞麦麸皮提取物为抑制剂,方法同
1.3.4 醇提水解物抑制胰脂肪酶作用机理的确定
底物溶液、醇提水解物和胰脂肪酶按下列3 种顺序加入:反应体系1:底物溶液与醇提水解物混合后,加入胰脂肪酶溶液进行反应;反应体系2:底物溶液与胰脂肪酶混合后,加入醇提水解物进行反应;反应体系3:醇提水解物与胰脂肪酶混合后,再加入底物溶液进行反应。分别测定不同加入顺序的脂肪酶活力,计算抑制率。
1.4抑制率计算

式中:A1、A2、A3、A4分别为无抑制剂组(酶和底物)、空白组(只有底物)、加抑制剂组(酶、底物和抑制剂)和对照组(抑制剂和底物)在420 nm波长处的吸光度。
2 结果与分析
2.1抑制剂与酶作用时间的确定

图1 反应时间对抑制作用的影响Fig.1 Effect of reaction time on the inhibitory rate of lipase
由图1可知,在0~10 min范围内醇提水解物对胰脂肪酶的抑制率随着反应时间的延长而逐渐增大,到10 min时抑制率达到最大值。随后,抑制率略微下降、趋于稳定。这表明在反应10 min时,醇提水解物对胰脂肪酶的抑制作用最大,继续延长反应时间抑制效应也不会增强。可见实验的最佳反应时间为10 min。
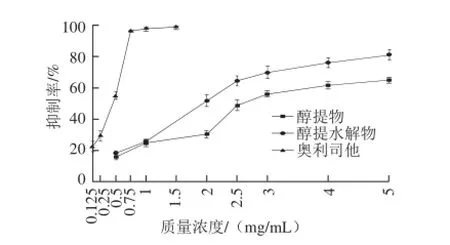
图2 醇提物、醇提水解物和奥利司他抑制胰脂肪酶活性的比较Fig.2 Inhibitory rates of pancreatic lipase by ethanol extract, hydrolysate and orlistat

图3 水提物、D-手性肌醇抑制胰脂肪酶活性的比较Fig.3 Inhibitory rates of pancreatic lipase by water extract andD-chiro-inositol (DCI)
2.2荞麦提取物对胰脂肪酶的影响由图2、3可知,醇提物、醇提水解物、水提物对胰脂肪酶的半数抑制浓度(IC50)分别为2.53、1.94、
17.6 mg/mL。苦荞醇提物经高压水解后,对胰脂肪酶的抑制作用略微增强,而作为目前市场上最成功的胰脂肪酶抑制剂——奥利司他在同样实验条件下的IC50为0.47 mg/mL。对胰脂肪酶的抑制能力:奥利司他>醇提水解物>醇提物>水提物。水提物和纯品D-手性肌醇在低质量浓度下抑制效果不明显,在较高的质量浓度下则表现出抑制活性。这一结果说明荞麦提取物对胰脂肪酶的抑制作用主要是通过荞麦黄酮来实现的,而荞麦糖醇及其降解产物D-手性肌醇对胰脂肪酶的抑制作用较微弱。故推测D-手性肌醇可能是通过其他途径来实现其降脂作用。
2.3 醇提水解物抑制胰脂肪酶作用机理的确定

图4 反应物加入顺序对抑制作用的影响Fig.4 Effect of the order of addition of reactants on the inhibitory rate of lipase
由图4可知,反应体系1对胰脂肪酶的抑制率最高,反应体系3次之,反应体系2最小。这表明荞麦醇提水解物对胰脂肪酶的抑制作用主要是通过苦荞黄酮与底物相互作用,从而阻碍了底物与酶的作用,属于竞争性抑制作用。
3 讨论与结论
荞麦麸皮作为荞麦面粉加工过程中的副产品,一般用于畜禽饲料。荞麦麸皮占籽粒干质量的11.5%~24%,且富含多种功能成分;苦荞麸皮总黄酮含量约7.7%[17],是种子含量的4~8 倍;甜荞麸皮富含荞麦糖醇,在人体内可被降解为D-手性肌醇。荞麦被誉为“五谷之王”,三降食品(降血压、降血糖、降血脂),因此,多食荞麦麸皮对人体有很大的益处。但由于麸皮直接食用口感差、不易消化、功能成分不能发挥其有效的作用,故提取荞麦麸皮有效成分、开发功能食品和药品具有重要的应用前景。
目前,对黄酮成分降血脂作用的研究较多,但对其降脂机理的研究较少。大黄柳叶黄酮提取物能够抑制高脂饲料引起的小鼠肥胖和脂肪肝,但无抑制胰脂肪酶活性的作用[13];槐角总黄酮对高脂血症大鼠脂代谢紊乱具有较好的调节作用[18];玳玳果黄酮滴丸对大鼠高脂血症有明显的预防作用,并能够阻止高脂血症大鼠的肝脏脂肪变性[19];苦荞黄酮亦有明显的降血脂作用[20]。本研究证明苦荞黄酮(醇提物和醇提水解物)具有抑制胰脂肪酶的能力;且经高压水解后,部分芦丁转化为槲皮素和异槲皮素,更有利于其提高抑制活性。尽管如此,醇提水解物的抑制活性最高也只达到82%,远低于奥利司他100%的最高抑制活性,但抑制率未达极限,也可能是天然提取物较安全的一个原因。另外,实验结果初步表明,苦荞黄酮并不直接与胰脂肪酶作用,主要是与底物结合阻碍底物与酶的结合来达到抑制作用。
D-手性肌醇是一种胰岛素受体的促敏剂,能够消除周围组织对胰岛素的抵抗,从根本上调节机体的生理机能和代谢平衡,从而对糖尿病及其并发症有显著疗效[21]。目前,D-手性肌醇和荞麦糖醇是否具有降脂功能鲜有报道。本研究结果表明,荞麸糖醇(水提物)和纯品D-手性肌醇在低质量浓度下抑制胰脂肪酶效果不明显,在较高的质量浓度下则表现出抑制活性。这说明甜荞麸皮的水提物抑制肥胖可能是通过D-手性肌醇有效地促进胰岛素的功能,来实现降低血糖、血甘油三酯水平等。
[1]LIU Benguo, ZHU Yongyi. Extraction of flavornoids from flavornoidrich parts in tartary buckwheat and identification of the main flavornoids[J]. Journal of Food Engineering, 2007, 78: 584-587.
[2]TIAN Hanying, ZHAO Wenjun, GUO Xudan, et al. Tartary buckwheat extracts regulate insulin sensitivity through IKKβ/IR/IRS-1/Akt pathway under inflammation condition in mice[J]. Journal of Food and Nutrition Research, 2014, 2(6): 321-329.
[3]GUO Xudan, MA Yujie, PARRY J, et al. Phenolics content and antioxidant activity of tartary buckwheat from different locations[J]. Molecules, 2011, 16(2): 9850-9867.
[4]QIN Peiyou, WU Li, YAO Yang, et al. Changes in phytochemical compositions, antioxidant andα-glucosidase inhibitory activities during the processing of tartary buckwheat tea[J]. Food Research International, 2013, 50(2): 562-567.
[5] 王静霞,黄艳菲,赵小燕,等.荞麦和商品苦荞茶中总黄酮的含量测定[J].食品工业科技, 2013, 34(2): 58-60.
[6]WON S R, KIM S K, KIM Y M, et al. Licochalcone A: a lipase inhibitor from the roots ofGlycyrrhiza uralensis[J]. Food Research International, 2007, 40: 1046-1050.
[7]WANG Li, LI Xiaodan, NIU Meng, et al. Effect of additives on flavonoids,D-chiro-inositol and trypsin inhibitor during the germination of tartary buckwheat seeds[J]. Journal of Cereal Science, 2013, 58(2): 348-354.
[8]SUSANNA R, ELISE K, EILA J, et al. The glycaemic and C-peptide responses of foods rich in dietary fiber from oat, buckwheat and lingonberry[J]. International Journal of Food Sciences and Nutrition, 2013, 64(5): 528-534.
[9]HU Yaohui, YU Yatong, PIAO Chunhong, et al. Methyl jasmonate and salicylic acid inducedD-chiro-inositol production in suspension cultures of buckwheat (Fagopyrum esculentum)[J]. Plant Cell, 2011, 106(3): 419-424.
[10]GARZA A L, MILAGRO F I, BOQUE N N, et al. Natural inhibitors of pancreatic lipase as new players in obesity treatment[J]. Planta Medica, 2011, 77(8): 773-785.
[11]MARRELLI M, LOIZZO M R, NICOLETTI M, et al.in vitroinvestigation of the potential health benefits of wild mediterranean dietary plants as anti-obesity agents withα-amylase and pancreatic lipase inhibitory activities[J]. Journal of the Science of Food and Agriculture, 2014, 94(11): 2217-2224.
[12]HOSSAIN P, KAWAR B, NAHAS M E. Obesity and diabetes in thedeveloping world: a growing challenge[J]. The New England Journal of Medicine, 2007, 356: 213-215.
[13] 许传莲,郑毅男,韩立坤,等.长白山大黄柳叶黄酮类成分促进脂肪分解作用的研究[J].中国药学杂志, 2005, 40(10): 753-756.
[14] 霍世欣,周陶忆,司晓晶,等.荷叶黄酮化合物对胰脂肪酶抑制作用的研究[J].天然产物研究与开发, 2008(2): 328-331.
[15] 李艳琴,周凤超,陕方,等.荞麦麸皮提取物与α-葡萄糖苷酶的作用[J].食品科学, 2010, 31(17): 10-13.
[16] LI Yanqin,YANG Peng, GAO Fei,et al.Probing the interaction between 3 fl avonoids and p ancreatic lipase by methods of fl uorescence spectroscopy and enzymatic kinetics[J]. European Food Research and Technology, 2011, 233: 63-69.
[17]WANG Min, LIU Jiaren, GAO Jinming, et al. Antioxidant activity of tartary buckwheat bran extract and its effect on the lipid profile of hyperlipidemic rats[J]. Journal of Agricultural and Food Chemistry, 2009, 57: 5106-5112.
[18] 王永红,龙晓莉,何菲,等.槐角总黄酮对高脂血症大鼠降血脂及抗氧化能力的实验研究[J].第四军医大学学报, 2009, 30(22): 2677-2681.
[19] 邱红鑫,陈丹,刘永静,等.玳玳果黄酮滴丸对高脂血症大鼠的降血脂作用研究[J].中国现代应用药学, 2011, 28(7): 597-601.
[20] 李洁,梁月琴,郝一彬.苦荞类黄酮降血脂作用的实验研[J].山西医科大学学报, 2004, 35(6): 570-571.
[21]YAO Yang, SHAN Fang, BIAN Junsheng, et al.D-Chiro-inositol enriched tartary buckwheat bran extract lowers the blood glucose level in KK-Ay mice[J]. Journal of Agricultural and Food Chemistry, 2008, 56(21): 10027-10031.
Inhibitory Effect of Flavonoids and Fagopyritols from Buckwheat on Pancreatic Lipase
YANG Peng, LI Yanqin*
(Key Laboratory of Chemical Biology and Molecular Engineering, Ministry of Education, Institute of Biotechnology, Shanxi University, Taiyuan 030006, China)
Objective: To understand the inhibitory activity of bioactive components in buckwheat bran on pancreatic lipase, which can provide evidence to explain its mechanism for lowing serum lipids. Methods: Ethanol extract of buckwheat bran (mainly containing rutin) and high-pressure hydrolysate of the residue left after ethanol extraction (a mixture of quercetin, isoquercetin and rutin) were obtained from tartary buckwheat bran, while water extract (mainly consisting of fagopyritols) was prepared from common buckwheat bran for evaluation of their inhibitory activity on pancreatic lipase in comparison with the lipase inhibitor orlistat. The mechanism of the hydrolysate for inhibiting pancreatic lipase was investigated by examining the effect of the order of addition of substrate, inhibitor and enzyme on the inhibitory activity. Results: The sequence of inhibitory activity toward pancreatic lipase was orlistat > hydrolysate > ethanol extract > water extract, with IC50values of 0.47, 1.94, 2.53 and 17.6 mg/mL, respectively. The inhibitory mechanism of the hydrolysate on pancreatic lipase belonged to the competitive type, which was mainly associated with the presence of flavonoids interacting with the substrate to block its interaction with the lipase. Conclusion: Buckwheat flavonoids present in the ethanol extract and the hydrolysate exert inhibitory effects on pancreatic lipase, especially those of the latter. Buckwheat fagopyritols in the water extract from common buckwheat bran show no inhibitory effect on pancreatic lipase at a low concentration, but can inhibit this enzyme at a high concentration.
buckwheat flavonoids; buckwheat fagopyritols; rutin; quercetin; isoquercetin; pancreatic lipase; inhibitor
TS201.2
A
1002-6630(2015)11-0060-04
10.7506/spkx1002-6630-201511012
2014-06-30
山西省科技攻关项目(20120311006-1)
杨鹏(1986—),男,硕士,研究方向为植物功能成分开发。E-mail:peng114011@163.com
*通信作者:李艳琴(1960—),女,教授,学士,研究方向为植物功能成分开发,微生物生态。E-mail:yanqin@sxu.edu.cn

