非酵母属酵母的接种顺序对混合发酵菠萝酒香气成分的影响
贾言言,刘四新,李卓婷,王艳梅,易锦豪,丁俊权,李从发*
非酵母属酵母的接种顺序对混合发酵菠萝酒香气成分的影响
贾言言,刘四新,李卓婷,王艳梅,易锦豪,丁俊权,李从发*
(海南大学食品学院,海南 海口 5702 28)
采用非酵母属的梅奇酵母P3-3与酵母属的酿酒酵母D254以不同接种顺序混合发酵菠萝酒。结果表明:顶空固相微萃取-气质联用法检测菠萝原果汁中共有20种香气成分,而先接种P3-3培养7 d后再接种D254(SI-Ⅰ组)、先接种D254培养2 d再接种P3-3(SI-Ⅱ组)和二者同时接种(CI组)的菠萝酒中则分别检出53、44、41种香气成分,SI-Ⅰ组所酿菠萝酒风味物质种类最多;SI-Ⅰ组中羧酸酯类相对含量为15.594%,而CI组和SI-Ⅱ组分别为13.042%和6.655%,表明SI-Ⅰ组所合成的羧酸酯类物质较多;菠萝特征香气成分的菠萝甲酯、菠萝乙酯、丁内酯等的含量在SI-Ⅰ组中为1.337%,CI组为0.844%,SI-Ⅱ组为0.819%,说明SI-Ⅰ组能更好地保留菠萝原果香;最后,SI-Ⅰ组感官品质最好。可见,采用先接种非酵母属酵母P3-3使其生长达到旺盛生长期,再接种发酵 力强的酵母属酵母D254的混合发酵方式,能更好地保留果酒中原果香的典型特征,增加菠萝酒香气成分的种类,并有效改善菠萝酒的品质、风味。
非酵母属酵母;梅奇酵母;混合发酵;菠萝酒;香气成分
菠萝(Ananas comosus(L.)Merr.)又名凤梨,凤梨科果子蔓属,单子叶多年生草本植物,是世界热带、亚热带特产水果之一,其中海南、广东、广西是我国菠萝生产主要产区[1]。成熟的菠萝果实中含有大量的糖、酸和芳香性物质,因此有大量的研究报道将菠萝酿制成果酒。但实践证明,经过发酵以后菠萝的原果香损失较大、香味组成发生了变化,导致菠萝酒的菠萝风味特征不典型、不丰满,酒香也单薄。因此,如何保香、增香是菠萝酒酿制研中的难度、重点。
果酒酿造中由于要得到一定酒精体积分数的产品,一般都使用发酵力强的酵母属酵母,如酿酒酵母(Saccharomyces cerevisiae)、贝酵母(Saccharomyces bayanus)等,但其在产香和香气形成方面一般比较单薄,风味欠佳。因此近年有不少研究采用非酵母属酵母进行发酵,它 们通常是一些筛自各种水果及其土壤环境、产香能力较好的非酵母属酵母,如梅氏酵母(Metschnikowia)、假丝酵母(Candida)、有孢圆酵母(Torulaspora)、Lachancea、克鲁维酵母(Kluyveromyces)、汉逊酵母(Hanseniaspora)和结合酵母(Zygosaccharomyces)等[2-4]。虽然使用非酵母属酵母具有很多对果酒品质有利的影响,但也存在一些缺陷,比如耐酒精能力弱、发酵力低、醋酸产量高等。因此,采用酵母属酵母与非酵母属酵母进行混合发酵[5-6],是当前的一个研究热点。Panjai等[7]对比了戴尔凯氏有孢圆酵母(T. delbrueckii)和酿酒酵母(S. cerevisiae)混合发酵和单一发酵的菠萝酒,结果表明,混合发酵的菠萝酒具有更明显的菠萝风味特征。然而,当非酵母属酵母与酵母属酵母混合发酵时,往往因为其不耐酒精、对营养物质的低竞争力等原因[8-11],会在接种的3~4 d后迅速大量衰亡[12-13],而其过早衰亡对果酒香气形成的贡献就很有限,因此,本实验为了延长非酿酒属酵母的生长时间,在接种顺序上进行了对比研究,将本课题组前期从番木瓜果皮上筛选到的一株产香良好的梅奇酵母属(Metschnikowia agaves)P3-3菌株与酵母属的酿酒酵母(Saccharomyces cerevisiae)D254菌株进行混合发酵酿制菠萝酒,以期为高品质菠萝酒的研发提供参考。
1 材料与方法
1.1材料、菌种、培养基与试剂
浓缩菠萝原汁:巴厘种,由海南南派实业有限公司提供。
梅奇酵母(Metschnikowia agaves)P3-3,分离、鉴定自番木瓜果皮,保存于海南大学食品学院菌种保藏中心;酿酒酵母(Saccharomyces cerevisiae)D254购自上海杰兔工贸有限公司。
WL培养基与LY培养基 青岛日水生物技术有限公司;YEPD培养基:酵母浸粉10 g、蛋白胨20 g、葡萄糖20 g、琼脂20 g、蒸馏水1 000 mL,pH 6.0,115℃湿热灭菌25 min。
果胶酶 烟台曼森商贸有限公司;2-辛醇 阿拉丁试剂有限公司;其他试剂均为国产分析纯。
1.2仪器与设备
HP6890/5973N型气相色谱-质谱(gas chromatography mass spectrometry,GC-MS)联用仪 美国Agilent公司;萃取头(CAR/PDMS,75 μm) 美国Supelco公司;Astree2系统电子舌 法国Alpha M.O.S公司;Biofugestratos高速冷冻离心机 德国Thermo公司。
1.3方法
1.3.1菠萝酒酿造工艺流程
浓缩菠萝原汁→稀释→果胶酶处理→离心→SO2处理→调整糖、酸度→接种酵母菌→主发酵→后发酵→贮存陈酿→分析、鉴评
1.3.2常规理化成分分析
总糖含量测定:3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)比色法[14];可溶性固形物含量测定:手持糖度计法;总酸含量、挥发酸含量、酒精体积分数测定:参照GB/T 15038—2006《葡萄酒、果酒通用分析方法》进行测定。
1.3.3电子舌分析
电子舌系统:法国Alpha M.O.S公司生产的Astree2电子舌系统,此电子舌系统包含7个化学传感器阵列代号分别为ZZ、BB、CA、GA、HA、JB、JE。这7个传感器对5种基本味觉:酸、甜、苦、咸与鲜都有不同的响应。
电子舌实验方法:取样,每种样品量取80 mL,静置15 min。每次采样时间120 s,每秒采样一次,电子舌系统软件每秒钟自动记录一次数据。每个样品重复4次。
样品的统计学分析:利用电子舌自带的Alphasoft 12.3统计分析软件,主成分分析(principal component analysis,PCA)和判别因子分析(discriminatory factor analysis,DFA)进行数据处理,对样品进行定性判别。
1.3.4 GC-MS分析
萃取方法:将固相微萃取(s o l i d-p h a s e microextraction,SPME)萃取头在GC-MS仪的进样口老化,老化温度250℃,老化时间30 min,载气流速1.0 mL/min。准确称取10.000 g样品于15 mL的顶空瓶中,10 ☒L 2-辛醇(250 mL/L)为内标,密封,水浴温度45℃,插入经过老化处理的固相微萃取头,使萃取头处于样品之上2 cm,萃取30 min后取出,迅速插入GC-MS联用仪的进样口,于250℃条件下解吸5 min后进行GC-MS分析。
GC-MS分析条件:色谱条件:毛细管柱为DB-5。氦气为载气,恒定流速1.0 mL/min,进样口温度250℃。程序升温:40℃保持6 min,以3℃/min升至120℃,再以4℃/min升至230℃。
质谱检测条件:电子轰击离子源(EI),电子能量70 eV,质量扫描范围m/z30~450,采集方式为全扫描scan,溶剂延迟3 min。
定性定量分析:分析结果运用计算机谱库(NIST/ WILEY)进行初步检索及资料分析,并结合已有的相关文献进行定性分析。样品定量可根据已知浓度的内标物2-辛醇进行定量分析,各物质的含量采用峰面积法计算出,即半定量的方法。
1.3.5感官评定
对不同处理的菠萝酒,经1个月陈酿后,请8名评审员参照GB/T 15038—2006进行感官鉴评,并测定酒精体积分数。
1.3.6菠萝酒的混合发酵
菌种活化:非酵母属的P3-3:将斜面接入盛有5 mL豆芽汁的试管中,25℃振荡培养10 h,然后转入盛有菠萝汁的三 角瓶中继续扩大培养10 h; 酵母属的D254(活性干酵母):称取1 g加入到含5%葡萄糖的10 mL水溶液中,40℃活化30 min。为便于后续接种时计算菌体浓度,先接入YEPD斜面培养,然后同P3-3一样进行活化培养。
发酵操作:浓缩菠萝原果汁加水稀释至20 °Brix,40 ℃条件下果胶酶处理40 min,10 000×g离心10 min,取上清液以柠檬酸调整pH值为3.5,加200 mg/L偏重亚硫酸钠灭菌6 h备用。然后以不同顺序接种P3-3与D254进行菠萝酒的混合发酵,25 ℃主发酵20 d,15 ℃后发酵1 个月,然后陈酿1 个月。
接种方式:将两种酵母按两种顺序依次接种,并与同时接种进行对照。
将P3-3与D254分别以1×107、1×105CFU/mL同时接入处理过的菠萝汁中,进行混合发酵(同时接种组,co-inoculating,CI),作为对照;先接入浓度为1×107CFU/mL的P3-3培养7 d,以达 到其旺盛生长期,后接入浓度为1×105CFU/mL的D254进行混合发酵(依次接种Ⅰ组,successively-inoculatingⅠ,SI-Ⅰ)。先接入浓度为1×105CFU/mL的D254培养2 d,以达到其旺盛生长期,后接入浓度为1×107CFU/mL的P3-3进行混合发酵(依次接种Ⅱ组,SI-Ⅱ)。
2 结果与分析
2.1不同接种方式的发酵体系中酵母菌细胞浓度的变化
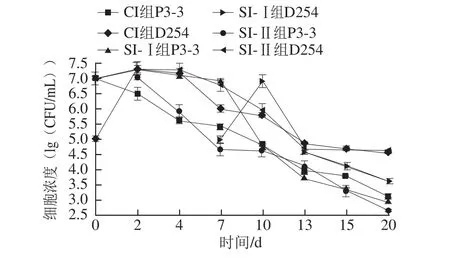
图1 菠萝酒混合发酵中酵母菌细胞浓度的变化Fig.1 Effect of fermentation time on cell concentrations of yeasts in pineapple wine
根据前期单菌株发酵的实验,梅奇酵母P3-3需要达到107~108CFU/mL数量级才启动发酵,以及为防止D254的旺盛繁殖带走过多香气成分,故分别选择了1×107CFU/mL和1×105CFU/mL两种接种浓度。计数结果(图1)可看出,同时接种的CI组与先接种D254的SI-Ⅱ组的P3-3与D254的生长规律相似,二者中D254细胞都在前2 d迅速增殖,而P3-3都呈现活细胞数迅速下降的趋势,这与Soden[15]和Toro[16]等研究结论相似,说明在强发酵力D254的环境中,非酵母属酵母的生长势确实很弱;而先接种P3-3的SI-Ⅰ组中,P3-3能在第2天细胞浓度达到峰值,之后较稳定生长,稍有下降,直到第7天接入D254时P3-3细胞迅速衰亡。这可能与混合发酵体系中营养物质的竞争效应、有毒物质(如乙醇)的形成浓度、以及细胞的群体感应等因素有关,这从生物量的角度说明混合发酵时以非酵母属酵母先接种、培养一段时间后再接入发酵力强的酵母属酵母的方式是非常必要的。
2.2常规理化分析

图2 菠萝酒发酵过程中各常规成分的变化Fig.2 Effect of fermentation time on chemical indicators of pineapple wine
常规理化成分(图2)分析结果显示,SI-Ⅱ组与CI组的变化相似,而SI-Ⅰ组中可溶性固形物、总糖含量下降缓慢,这说明P3-3作为野生酵母,其代谢能力显然低于商业酵母D254;产酸方面,发酵初期,SI-Ⅰ组总酸下降较慢,说明其代谢菠萝果汁中的有机酸能力也较弱,加之一般非酵母属酵母的产醋酸能力较强[17],因此发酵终了时SI-Ⅰ组总酸含量高于CI、SI-Ⅱ组。但值得关注的是,其挥发酸含量在SI-Ⅰ组却最低,这可能与先接种P3-3、使其生长时间有效延长后,能在后期混合发酵和陈酿过程中将部分乙酸转化为具有芳香味的低级醇有关[18]。
2.3电子舌分析
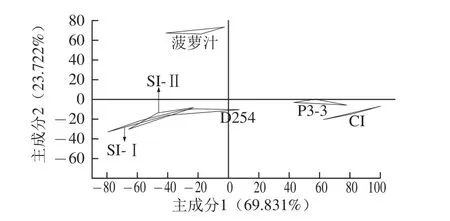
图3 菠萝汁和菠萝酒的主成分分析Fig.3 Principal component analysis of pineapple juice and wine
为了比较不同接种方式的混合发酵的菠萝酒之间的口味差异,进行了电子舌分析(图3),并引入菠萝汁和纯种接种的单一发酵的菠萝酒做对照。同一样品在主成分图上由3个点组成,得到前2个主成分的贡献率分别为69.831%、23.722%,累计贡献率93.553%,说明足以收集特征性信息[19]。菠萝汁、单一接种P3-3组与CI组的酒样都能够很好地落在各自的区域里没有重叠,说明它们存在的差异能给区分开来。而SI-Ⅰ与SI-Ⅱ、SI-Ⅱ与单一接种D254组的响应数据图有交叉,说明两两之间口味差异不大,但结合感官评定情结果,表明电子舌没能很好地区分它们的差异。然而另一方面,SI-Ⅰ组、SI-Ⅱ组与单一接种D254组三者间有一部分重叠,表示D254产生的风味在SI-Ⅰ组、SI-Ⅱ组都有所体现。因此为了将CI组、SI-Ⅰ组、SI-Ⅱ组的口味差异区分出来,需对其进行进一步的判别因子分析。
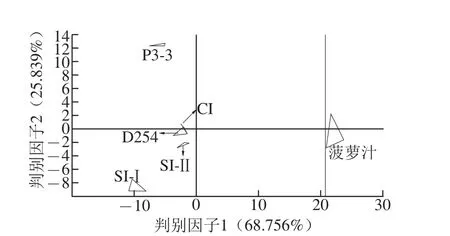
图4 菠萝汁和菠萝酒的判别因子分析Fig.4 Discriminant factor analysis of pineapple juice and wine
将电子舌采集得到的数据进行判别因子分析(图4)可知,判别因子分 析对样品的累积区分指数达到了94.595%,同一样品组内的离散度也比主成分分析(图3)的小,不同样品组间的区分更明显,能够对样品间差异进行区分。而在主成分分析中不能明显区分的SI-Ⅰ组、CI组、SI-Ⅱ组,判别因子分析能将这3种菠萝酒很好地区分出来,说明三者的口味之间有显著差异,此差异可能源自非酵母属酵母P3-3与商业酵母D254的不同接种顺序。
2.4香气成分分析

表1 不同接种顺序发酵的菠萝酒中挥发性化合物的组成及含量Table1 Concentrations of the volatile compounds in pineapple wine fermented with mixed and sequential cultures of M. agaves and S. cerevisiae

续表1
菠萝酒香气成分中有些成分是菠萝汁中本身存在的,有些则在发酵中产生或者后酵中形成的,这与发酵醪中微生物各种酶的活力及其代谢中间物种类等有关[20]。由气质联用检测结果显示,菠萝汁中检测出了20种香气成分,而SI-Ⅰ组、CI组与SI-Ⅱ组则分别检出53、44、41种。由此可知,混合发酵的菠萝酒香气成分的种类增加了[21-22]。而且,SI-Ⅰ组中香气成分种类最多,说明先接种P3-3的SI-Ⅰ组,由于显著延长了其生长时间,对混合发酵酿制菠萝酒的香气成分的复杂多样性产生了有益效应。
酯类物 质往往是果酒中水果味与花香味的重要贡献者。事实上果酒中的酯类一方面来自酿酒所用水果原料,另一方面来自发酵过程中的各种酯化反应。菠萝甲酯、菠萝乙酯、丁内酯等是菠萝特征香气的重要组成部分,经测定,酯类在菠萝汁中的相对含量为0.869%,而在SI-Ⅰ组为1.337%,在CI组为0.844%,SI-Ⅱ组为0.819%,可见,SI-Ⅰ组更能保留菠萝本身的原果香。此外,SI-Ⅰ组中的羧酸酯类相对含量为15.594%,而CI组(13.042%)与SI-Ⅱ组(6.655%)则明显较低。这也表明先接种P3-3组的菠萝酒通过合成重要羧酸酯类尤其是乙酸乙酯(10.480%)、乙酸苯乙酯(3.595%)等增加了酒体中的果香味与其他风味物质的复杂性。羧酸酯类一般来自于乙醇乙酰转移酶催化CoA与醇类反应而生成[23],关于这点,Fukuda等[24]曾证明羧酸酯类含量的变化与菌体细胞内酯酶与乙醇乙酰转移酶的合成和分解间的平衡有关。
酸类也是果酒中重要的组成部分,本次实验检测出的酸类有乙酸、3-甲基丁酸、己酸等。CI组酸类的相对含量为11.270%、SI-Ⅰ组为1.696%、SI-Ⅱ组为14.750%,SI-Ⅰ组中酸类物质含量较少,这可能因为P3-3利用大量的乙酰CoA合成羧酸酯类,导致乙酰CoA减少,而不足以形成乙酸等酸类,还可能是P3-3将部分乙酸转化为具有芳香味的低级醇[18]有关。除酯类和酸类外,醇类也是果酒挥发性成分的重要组成部分。SI-Ⅰ组、CI组、SI-Ⅱ组共有的主要醇类为苯乙醇、3-甲基丁醇、2-甲基丁醇等。SI-Ⅰ组中3-甲基丁醇、苯乙醇相对含量比CI组、SI-Ⅱ组中的高,苯乙醇具有愉快的果香,对菠萝酒有积极影响。其他挥发性物质如醛类、酮类、酚类等,由于在SI-Ⅰ组、CI组、SI-Ⅱ组中总体含量都不高,故其相对含量差异不大,但这些物质与酯类、酸类、醇类相互协同配合,共同赋予菠萝酒清醇香韵、酒香饱满、果香典型圆润的风格。
2.5酒精体积分数和感官评定结果
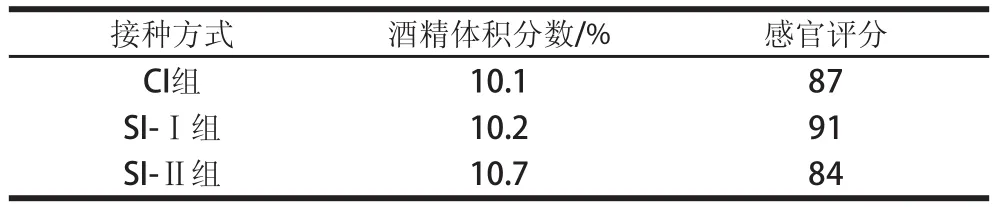
表2 菠萝酒酒精体积分数和感官评分结果Table2 Alcohol concentrations and sensory evaluation of pineapple wines
对不同接种方式混合发酵酿制的菠萝酒进行酒精体积分数测定和感官评价,结果见表2。CI组、SI-Ⅰ组、SI-Ⅱ组酒精体积分数差异不大,但感官综合得分以先接种非酵母属酵母的SI-Ⅰ组最高,其果酒色泽澄清透明、香气圆润、菠萝香气特征更突出、酒体丰满,较好地体现了菠萝酒的独特风格。
3 结 论
本实验研究了非酵母属酵母在与酵母属酵母混合发酵酿制菠萝酒中二者的接种顺序对果酒品质的影响,选择使用了一株本实验室筛选自番木瓜果皮的野生酵母Metschnikowia agavesP3-3与商业安琪酵母D254以不同接种方式进行混合发酵。SPME-GC/MS表明,菠萝汁中检测出20种香气成分,而SI-Ⅰ组、CI组与SI-Ⅱ组则分别为53、44、41种,混合发酵的菠萝酒中的香气成分的种类增加了,且以SI-Ⅰ组中香气成分种类最多;SI-Ⅰ组中乙酸乙酯、乙酸苯乙酯等羧酸酯类相对含量为15.594%,而CI组和SI-Ⅱ组都显著 低于SI-Ⅰ组,分别为13.042%和6.655%,表明P3-3合成羧酸酯类的能力比较强;菠萝特征香气的重要组成成分菠萝甲酯、菠萝乙酯、丁内酯等脂类物质在菠萝汁中相对含量为0.869%,而SI-Ⅰ组为1.337%,CI组为0.844%,SI-Ⅱ组为0.819%,说明SI-Ⅰ组能更好保留菠萝原果香;电子舌分析表明SI-Ⅰ组、CI组、SI-Ⅱ组3种菠萝酒口味之间有显著差异;先接种P3-3发酵7 d后接入D254的SI-Ⅰ组由于有效延长了P3-3培养时间,使其产生了更丰富的代谢产物,结果所酿菠萝酒风味物质多样性最好、感官得分最高。可见,采用先接种非酵母属酵母达到其对数期,再接种发酵力强的酵母进行混合发酵,能有效保留酒中原果香典型特征,丰富菠萝酒香气成分的多样性,改善菠萝酒的品质、风味。本实验将梅奇酵母属的M. agaves作为非酵母属酵母运用于菠萝酒的酿造中,取得良好效果,为高品质菠萝酒的研发提供了有益借鉴。
[1] 庞社霞. 菠萝果酒制作工艺初步探索[J]. 农产品加工∶ 学刊, 2014(8)∶ 43-45.
[2] CRAY J A, BELL A N W, BHAGANNA P, et al. The biology of habitat dominance; can microbes behave as weeds?[J]. Microbial Biotechnology, 2013, 6(5)∶ 453-492.
[3] JOLLY N P, VARELA C, PRETORIUS I S. Not your ordinary yeast∶non-Saccharomyces yeasts in wine production uncovered[J]. FEMS Yeast Research, 2014, 14(2)∶ 215-237.
[4] PRETORIUS I S. Tailoring wine yeast for the new millennium∶ novel approaches to the ancient art of winemaking[J]. Yeast, 2000, 16(8)∶675-729.
[5] GOBBI M, COMITINI F, DOMIZIO P, et al. Lachancea thermotolerans and Saccharomyces cerevisiae in simultaneous and sequential cofermentation∶ a strategy to enhance acidity and improve the overall qualityof wine[J]. Food Microbiology, 2013, 33(2)∶ 271-281.
[6] SUN Shuyang, GONG Hansheng, JIANG Xiaoman, et al. Selected non-Saccharomyces wine yeasts in controlled multistarter fermentations with Saccharomyces cerevisiae on alcoholic fermentation behaviour and wine aroma of cherry wines[J]. Food Microbiology, 2014, 44∶ 15-23.
[7] PANJAI L, ONGTHIP K, CHOMSRI N. Complex fruit wine produced from dual culture fermentation of pineapple juice with Torulaspora delbrueckii and Saccharomyces cerevisiae[J]. Asian Journal of Food and Agro-Industry, 2009, 2(2)∶ 135-139.
[8] MARTINI A. Origin and domestication of wine yeast Saccharomyces cerevisiae[J]. Journal of Wine Research, 1993, 3(3)∶ 165-176.
[9] NISSEN P, ARNEBORG N. Characterization of early deaths of non-Saccharomyces yeasts in mixed cultures with Saccharomyces cerevisiae[J]. Archives of Microbiology, 2003, 180(4)∶ 257-263.
[10] COMITINI F, GOBBI M, DOMIZIO P, et al. Selected non-Saccharomyces wine yeasts in controlled multi starter fermentations with Saccharomyces cerevisiae[J]. Food Microbiology, 2011, 28(5)∶873-882.
[11] LEE P R, CHONG I S M, YU B, et al. Effects of sequentially inoculated Williopsis saturnus and Saccharomyces cerevisiae on volatile profiles of papaya wine[J]. Food Research International, 2012, 45(1)∶ 177-183.
[12] JEMEC K P, CADEZ N, ZAGORC T, et al. Yeast population dynamics in five spontaneous fermentations of Malvasia must[J]. Food Microbiology, 2001, 18(3)∶ 247-259.
[13] ANFANG N, BRAJKOVICH M, GODDARD M R. Co-fermentation with Pichia kluyveri increases varietal thiol concentrations in Savignon Blanc[J]. Australian Journal of Grape and Wine Research, 2009, 15(1)∶1-8.
[14] SUDHEER KUMAR Y, PRAKASAM R S, REDDY O V S. Optimisation of fermentation conditions for mango (Mangifera indica L.) wine production by employing response surface methodology[J]. International Journal of Food Science & Technology, 2009, 44(11)∶2320-2327.
[15] SODEN A, FRANCIS I L, OAKEY H, et al. Effects of cofermentation with Candida stellata and Saccharomyces cerevisiae on the aroma and composition of Chardonnay wine[J]. Australian Journal of Grape and Wine Research, 2000, 6(1)∶ 21-30.
[16] TORO M E, VAZQUEZ F. Fermentation behaviour of controlled mixed and sequential cultures of Candida cantarellii and Saccharomyces cerevisiae wine yeast[J]. World Journal of Microbiology and Biotechnology, 2002, 18(4)∶ 351-358.
[17] 杨雅利, 沈海亮, 阚建全. 紫色甘薯酒香气成分分析和发酵规律[J].食品科学, 2012, 33(12)∶ 242-246.
[18] 吕慧威, 孙玉梅, 卢明春, 等. 自选酵母菌株草莓酒发酵特性比较[J].食品科学, 2010, 31(11)∶ 197-201.
[19] 张航. 电子舌传感器快速检测油茶籽油中掺杂棕榈油[J]. 食品科学, 2013, 34(14)∶ 218-222. doi∶ 10.7506/spkx1002-6630-201314044.
[20] SUMBY K M, GRBIN P R, JIRANEK V. Microbial modulation of aromatic esters in wine∶ current kmowledge and future prospects[J]. South African Journal of Enology and Viticulture, 2010, 21∶ 97-129.
[21] MAURIZIO C, FRANCESCA C, MARIA M I, et al. Controlled mixed culture fermentation∶ a new perspective on the use of non-Saccharomyces yeasts in winemaking[J]. FEMS Yeast Research, 2010, 10(2)∶ 123-133.
[22] LEE P R, CHONG S M. Effect of precursors on volatile compoun ds in papaya wine fermented by mixed yeasts[J]. Food Technology and Biotechnology, 2013, 51(1)∶ 92-100.
[23] SAERENS S M G, DELVAUX F, VERSTREPEN K J, et al. Parameters affecting ethyl ester production by Saccharomyces cerevisiae during fermentation[J]. Applied and Environmental Microbiology, 2008, 74(2)∶ 454-461.
[24] FUKUDA K, YAMAMOTO N, KIYOKAWA Y, et al. Balance of activities of alcohol acetyltransferase and esterase in Saccharomyces cerevisiae is important for production of isoamyl acetate[J]. Applied and Environmental Microbiology, 1998, 64(10)∶4076-4153.
Effects of Successive Inoculation of Non-Saccharomyces Yeast on Aroma Components of Pineapple Wine by Mixed-Culture Fermentation
JIA Yanyan, LIU Sixin, LI Zhuoting, WANG Yanmei, YI Jinhao, DING Junquan, LI Congfa*
(College of Food Science and Technology, Hainan University, Haikou 570228, China)
Pineapple wines fermented with successive inoculation ofMetschnikowia agavesP3-3 andSaccharomyces cerevisiaeD254 were analyzed by gas chromatography-mass spectrometry (GC-MS) combined with head-space solid-phase microextraction (HS-SPME). The results showed that 53, 44, 41 and 20 aroma components were detected from group SI-I (inoculating D254 after 7 days of fermentation withP3-3), group CI (simultaneous inoculation of both P3-3 andD254), group SI-II (inoculating of P3-3 after 2 days of fermentation with D254) and the pineapple juice, respectiv ely. SI-I group dominated by P3-3 produced higher amounts of acetate ester (15.594%) than group CI (13.042%) and SI-II (6.655%). SI-I retained the highest concentration of the characteristic aroma components of pineapple including 3-(methylthio)propanoic acid methyl ester,3-(methylthio)propanoic acid ethyl ester and butyrolactone as compared to group CI (0.844%) and SI-II (0.819%). This study suggested that more characteristic aroma components of pineapple were retained and more ethyl esters were synthesized to increase the complexity of the wine in group SI-I. At last, with the extended survival ofP3-3, the highest sensory score was obtained from group SI-I. The successive inoculation of non-SaccharomycesandSaccharomycesyeasts may be a valuable method to manipulate yeast succession and to modulate the volatile profiles and organoleptic properties of pineapple wine.
non-Saccharomycesyeast;Metschnikowia agaves; mixed-culture fermentation;pineapple wine; aroma-active components
TS262.7
A
10.7506/spkx1002-6630-201517029
2015-05-03
“十一五”国家科技支撑计划项目(200 7BAD76B01-2);海口市热带 农产品深加工重点实验室项目(2013-45)
贾言言(1988—),女,硕士研究生,研究方向为应用微生物技术。E-mail:952262544@qq.co m
*通信作者:李从发(1967—),男,教授,博士,研究方向为食品生物技术。E-mail:congfa@vip.163.com

