泸定百合转录组测序与特性分析
姜福星,杨丽娟,陈其兵,高 顺
(1.四川农业大学 园林研究所,四川 成都611130;2.四川农业大学 风景园林学院,四川 成都611130;3.四川农业大学 生态林业研究所,四川 成都611130)
泸定百合(Lilium sargenttiae),又名通江百合,是百合科百合属(Liliumspp.)多年生草本植物,主要产于云南、贵州、四川和广西等地,不但植株高大、花型优美、花朵洁白芳香,而且对镰刀菌枯萎病等病害和高温干旱的抗性均较强,生态适应性好,作为含有优良基因的宝贵的种质资源,是进行百合育种的理想材料[1-10]。鳞茎作为百合属植物的一种地下变态茎,不但是营养贮藏器官,具有较高的食用和药用价值,而且可以作为繁殖的重要材料;可见百合的鳞茎具有营养和繁殖的双重作用,作为互相转化的“源和库”,对于百合的生长发育起着重要的调节作用,对于科研和生产均具有重要的价值和意义,引起了广泛的关注并成为研究的热点[11-17]。
对于地下变态器官的研究,马铃薯(Solanum tuberosum)的 块 茎 和 莲 藕 (Nelumbo nucifera Gaertn)的根状茎等地下变态器官的分子机理的研究已经取得了重要进展[18-19]。对于百合属植物鳞茎的研究,目前主要停留在鳞茎的发育和活性成分两个方面:第一,在鳞茎的发育方面,对兰州百合(L.davidii var.unicolor)、毛百合(L.dauricum)、铁炮百合(L.longiflorum)等野生种及亚洲百合和东方百合的少数栽培品种中,从发育过程、激素的影响、培养方式、可溶性糖、蛋白质和淀粉酶的变化等方面进行了相关研究[20-23];其次,在药用活性成分方面,对卷丹(L.lancifolium)、宜昌百合(L.leucanthum)和兰州百合等百合科植物的药用活性成分进行了提取和测定等方面的研究[24-29];但是百合属植物鳞茎的分子生物学方面的研究却未见报道,基因信息和功能基因的分析严重缺乏,成为制约后续研究和开发的瓶颈,是未来研究的重要方向[11-13]。对于泸定百合,虽然已经进行了组织培养、生态适应性、细胞遗传、分子标记和抗病机理等方面的研究[4-10],但在鳞茎发育及次生代谢的分子机理等方面更是严重空白,需要分子数据支撑。
新一代转录组测序技术的发展对于分子生物学的研究起到了巨大的推动作用,转录组测序(Transcriptome sequencing)是基因功能及结构研究的基础和出发点,是基于特定的测序平台,研究特定组织或细胞在某个时期转录出来的所有mRNA,获得某一物种特定组织或器官在某一状态下的几乎所有转录本序列信息,进而得到的基因功能注释、蛋白质编码区序列、基因的表达量、代谢途径等大量信息,为进一步研究提供基础数据和重要参考[30]。不仅能够广泛应用于有参考基因组序列的物种研究,如水稻、葡萄等,也能应用于无参考基因组序列的物种,如樟树、丹参、蜡梅、白木香、虎杖、鸟巢蕨、花椒等,应用较为广泛[30-38]。
鉴于此,本研究以泸定百合的鳞茎为材料,进行高通量转录组测序分析,从分子水平上研讨泸定百合鳞茎发育过程中重要基因的表达与作用,以及生理生化及次生代谢的分子机制,为功能基因的挖掘奠定基础,为也为百合属植物基因工程育种提供技术支持和理论依据。
1 材料与方法
1.1 材料
所采用的材料采集于四川省甘孜自治州泸定县泸定镇,经姜福星和祝波等鉴定为泸定百合(Lilium sargenttiae),盆栽于四川农业大学的苗圃内,作为试验材料备用。
1.2 RNA提取
从盆栽的2株2a泸定百合,选取其鳞茎,用自来水冲洗干净,参照文献中的方法[30-38],使用TRIzol试剂(Invitrogen美国)分别提取总RNA,为清除残留的基因组DNA,每个RNA样本中加入10U DNaseI(Takara,日本)37℃孵育30min,测定RNA样本的浓度后,每个样本各取10μg等量混合组成一个RNA池(RNA pool,共20μg)。接着使用Oligotex mRNAMidi Kit(Qiagen,德国)分离纯化样品mRNA。整个RNA的质量和含量通过使用Nanodrop ND-1000(LabTech,美国)检测吸光度260nm/280nm(A260/A280)进行测定,RNA 的完整性通过1.5%(w/v)凝胶电泳进行检测。
1.3 cDNA测序文库的构建及Illumina HiSeq TM2000高通量测序
参照文献中的方法[31-39],使用 SOLiD Whole Transcriptome Analysis Kit(Life technologies,美国),参照其说明书标准流程构建随机片段测序文库。用带有 Oligo(dT)的磁珠富集poly(A)mRNA,加入打断试剂在恒温振荡孵育器中适温将mRNA打断成短片段,以打断后的mRNA为模板反转录合成第一链cDNA;利用DNA polymerase I,dNTPs及RNaseH配制第二链合成反应体系合成第二链cDNA;经过试剂盒纯化回收、黏性末端修复后,在cDNA的3,末端加上碱基“A”并连接接头,然后用琼脂糖凝胶电泳进行片段大小选择,进行PCR扩增得到测序文库,构建好的文库进过质检合格后,使用Illumina HiSeqTM2000进行测序。
1.4 序列拼接与组装
参照文献中的方法[30-38],使用二代测序数据质量统计软件Trimmomatic(v0.30)对测序原始数据去除接头以及低质量序列等,得到后续信息分析的有效数据,采用软件FastQC(v0.10.1)进行分析,评估结果信息;对用短reads组装软件Trinity进行转录组样品数据从头组装,对组装结果通过序列聚类软件cd-hit-est(v4.5.4)做进一步序列拼接和去冗余处理,得到长的非冗余的Unigene序列,采用短reads组装软件trinity(版本号r2013-02-25)进行转录组样品数据从头组装,对组装结果通过序列聚类软件cd-hit-est(v4.5.4)做进一步序列拼接和去冗余处理,得到长的非冗余的Unigene序列
1.5 Unigene功能注释、分类和代谢路径分析
参照文献中的方法[30-38],用Blastx将Unigene序列比对到蛋白质数据库NR(NCBI非冗余蛋白库)、GO(国际标准化的基因功能分类体系,使用blast2GO软件进行基因GO功能分析)、KEGG(系统分析基因产物在细胞中的代谢途径及这些基因产物功能的数据库)和COG(对基因产物进行直系同源分类的数据库)(E值<1e-5),再通过BlastN将Unigene比对到核酸数据库NR(NCBI非冗余核酸数据库)(E值<1e-5),得到给定Unigene具有最高序列相似性的蛋白,从而得到该Unigene的蛋白功能注释信息。采用Blast2GO软件,根据NR注释信息得到GO注释信息;采用WEGO软件对ALLUnigene(按照分子功能、细胞组分、生物学过程)进行GO功能分类统计,从宏观上认识泸定百合鳞茎的基因功能分布特征。将Unigene序列按NR、GO、KEGG和COG的顺序做BlastX比对(E值<1e-5)。取比对结果中Rank最高的蛋白确定该Unigene的编码序列,根据标准密码子表将该编码区序列翻译成氨基酸序列,从而得到该Unigene的核酸序列(序列方向5′→3′)和氨基酸序列。根据NR注释结果,使用blast2G0软件进行基因本体GO功能分析,得到每个基因的GO信息以及GO功能分类,在宏观水平上了解该物种或者样品的基因功能分布特征。根据KEGG注释的基因功能信息,对参与次生代谢的序列(按次生代谢物种类)进行分类。
2 结果与分析
2.1 RNA测序及序列拼接组装
采用Illumina HiSeqTM2000测序平台对2年生泸定百合鳞茎进行转录组测序,测序后得到的原始数据及去除杂质后的有效数据结果列于表1。获得Unigene有43 412个,最长超过2 000bp,(图1)。
2.2 序列功能注释
基于序列相似性搜索数据库中的序列信息对未知功能的序列进行注释。将所有Unigene与核酸和蛋白质数据库(NR,GO,COG,KEGG)进行BLAST程序搜索比对发现,43 412个Unigene中,30 225条Unigene得到56 829个NR功能注释,占69.62%;有21 531条 Unigene得到96 755个 GO注释,占49.60%;14 069条 Unigene得到COG功能注释,占32.41%;10 822条 Unigene参与了KEGG代谢途径,占24.93%;被注释的Unigene中,得到NR功能注释最多,但也有30.38%尚未得到注释,其次是GO功能注释,再次是COG功能注释,KEGG最少,有可能是未知功能的新基因(表1)。基因功能注释的结果表明,现有生物信息学数据库和分子生物学研究对泸定百合及百合属植物的基因或转录组信息是很有限的,有待深入挖掘。
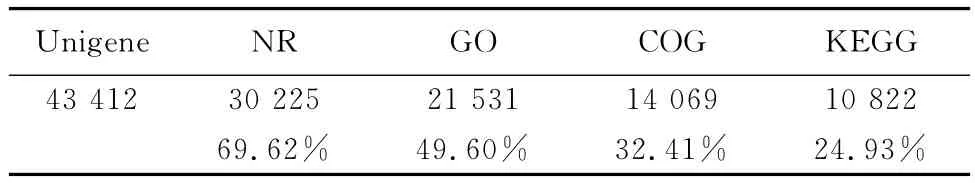
表1 注释结果统计Table 1 Summary of annotation results
2.3 Unigene的GO分类
根据GO注释,在所有转录物中,注释归为细胞组分的有54 070个(40%),归为分子功能的有22 950个 (17%),归为生物过程的有 57 911 个(43%)。上述3大类可被划分为更加详细的52个类别,分别包含17、13和22个功能亚类。在细胞组分功能类型中,主要有细胞和细胞部分等;在分子功能类型中,主要有蛋白结合和催化活性等;在生物学过程类型中,主要的生命过程分别是代谢过程和细胞过程、生长及免疫系统过程等(图2)。并从其分子功能分类中发现有374条Unigene,为能结合到DNA上的转录因子,包括与器官发育密切相关的ARF(生长素响应因子)、PPR 蛋白、BTB/POZ、ERF、MADS-box等转录因子[31-34],可能在泸定百合鳞茎的形成和发育过程中发挥重要作用,有待于深入研究。
2.4 Unigene的COG分类
为进一步评价转录组的完整性和注释的有效性,对Unigene进行了COG分类,共获得14 069个COG功能注释,涉及24个COG功能类别,其中,“一般功能基因”(general function prediction only)的转录物最多,有2 464个,占17.51%;其次为“蛋白质翻译后修饰与转运及分子伴侣相关基因”(posttranslational modification,protein turnover and chaperones),比例为9.48%。在该转录组中,涉及植株生长发育相关的功能定义主要包括:RNA组装修饰、染色体结构变化、能量生产转化、氨基酸运输代谢、核酸运输代谢、糖类运输代谢、辅酶运输代谢、脂类运输代谢、细胞循环控制与细胞分裂及染色体参与、翻译与核糖体结构及合成、信号转导机制、细胞壁、转录等多个生理生化过程(图3,表2)。
2.5 KEGG分析
采用KEGG数据库对泸定百合可能参与的生理生化反应途径进行预测。分析结果表明,10 822个得到注释的基因中有1 279个基因参与新陈代谢的反应,其中的571个基因参加了次生代谢途径(表2)。根据KEGG注释结果,次生代谢物途径主要包括:黄酮和类黄酮(Flavone and flavonol biosynthesis)4个、倍半萜化合物和三萜皂苷(Sesquiterpenoid and triterpenoid biosynthesis)3 个、玉 米 素(Zeatin biosynthesis)5个、二萜类(Diterpenoid biosynthesis)6个、异喹啉类生物碱(Isoquinoline alkaloid biosynthesis)10个、莨菪烷、哌啶和吡啶(Tropane,piperidine and pyridine alkaloid biosynthesis)13个、类胡萝卜素(Carotenoid biosynthesis)18个、类甾醇(Steroid biosynthesis)20个、芪类化合物、二芳基庚和姜辣素(Stilbenoid,diarylheptanoid and gingerol biosynthesis)18个、硒复合物代谢途径(Selenocompound metabolism)14个、甜菜红色素(Betalain)1个(表2);丰富多彩的次生代谢途径实际上就是一个个基因调控网络,KEGG代谢途径中硒元素结合蛋白及其相关的甲酸脱氢酶、催泪因子合酶、查尔酮合酶、锌离子结合蛋白和花姜酮等较高的药用活性物质的重要功能基因,就是构成基因调控网络的关键节点。此外,还包括:牛磺酸与亚牛磺酸代谢途径(Taurine and hypotaurine metabolism)8个,亚油酸(Linoleic acid)7个,赖氨酸(Lysine)13个,叶酸(Folate)17个,不饱和脂肪酸(Biosynthesis of unsaturated fatty acids)17个等营养保健价值很高的生理生化途径(表3)。这为泸定百合的鳞茎具有较高的药用保健价值提供了分子水平的证据,暗示其在营养保健、医药化工等领域有广泛的研究开发前景。
2.6 次生代谢过程的关键酶
倍半萜(烯)化合物和三萜皂苷是泸定百合主要药用成分之一,其生物合成涉及到鲨烯合酶、法呢酰二磷酸酯法呢酰基转移酶、金合欢醇脱氢酶三种关键酶,每一种酶均有1条Unigene参加(表3);芪类化合物、二芳基庚烷和姜辣素也是泸定百合的重要药用活性成分,通过同源性搜索,找到15条Unigene可能编码该代谢途径的4个关键酶,包括肉桂酸-4-羟化酶(CYP73A)5个,咖啡酰CoA甲基转移酶(CCoAOMT)4条,莽草酸酯(HCT)2条,羟基肉桂酸基转移酶(CYP98A3)3条,其他1条Unigene参与了一种功能有待于确定的合成酶的作用(表4)。
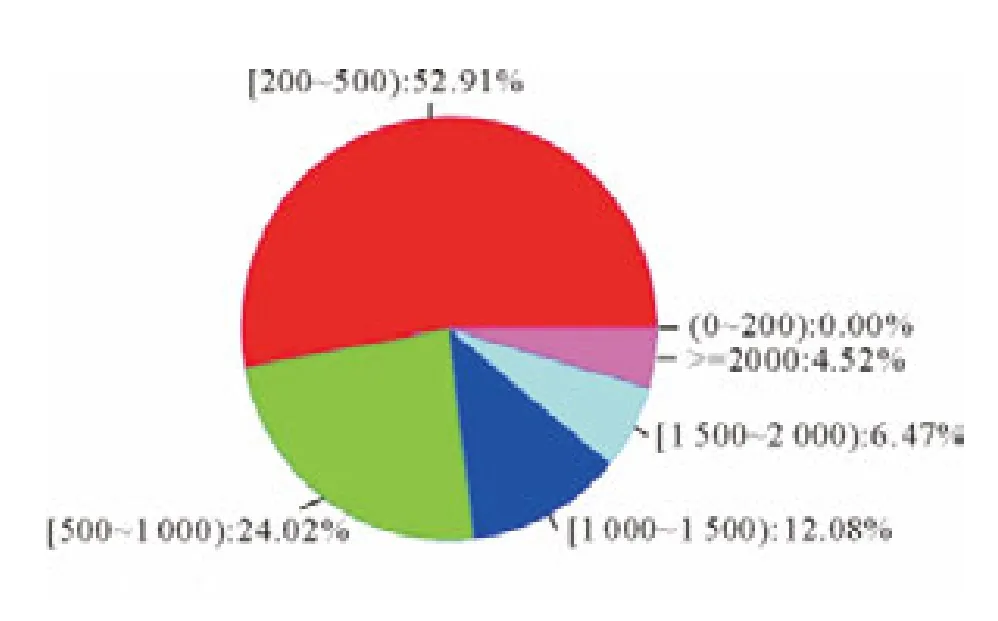
图1 Unigene长度分布Fig.1 Pie chart for different lengths of Unigene
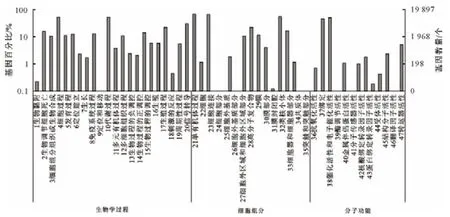
图2 Unigene GO功能分类Fig.2 Unigenes functional classification

图3 Unigene COG功能分类Fig.3 COG function classification of all Unigene

表2 COG功能分类及数量Table 2 COG function classification and their number

表3 主要的KEGG代谢途径Table 3 Important KEGG pathway categories in secondary metabolites

表4 泸定百合KEGG代谢途径中倍半萜和三萜皂苷合成途径中的关键酶Table 4 The annotation results of KEGG pathways for sequiterpenoid and triterpenoid biosynthesis in L.sargentiae

表5 泸定百合的KEGG代谢途径中芪类化合物、二芳基庚酸类和姜辣素的关键酶Table 5 The annotation results of KEGG pathways for stilbenoid,diarylheptanoid and gingerol biosynthesis in L.sargentiae
3 结论与讨论
本研究首次采用高通量测序技术首次对泸定百合鳞茎进行了转录组分析,获得大量与泸定百合鳞茎生长发育相关的分子数据,采用生物信息学软件共拼接得到43 412条Unigene,其中发现有30 225条和21 531条Unigene分别获得NR和GO注释,14 069条Unigene得到COG注释,GO注释中获得374条Unigene可能作为转录因子参与泸定百合鳞茎的形成与发育,包括与器官发育密切相关的ARF(生长素响应因子)、PPR 蛋白、BTB/POZ、ERF、MADS-box等转录因子[39-41],可能在泸定百合鳞茎形成过程中发挥重要作用,为探讨泸定百合鳞茎的形成与发育的分子机制,提供了重要线索,有待于深入展开研究。
同时,也获得了泸定百合鳞茎生理生化及次生代谢相关的有效信息,分析表明,共有10 822条Unigene参与了KEGG代谢途径;1 279条Unigene参与了新陈代谢途径,其中571条Unigene参与了次生代谢途径。药用活性物质代谢途径主要包括:单萜、双萜、倍半萜和三萜皂苷、萜类骨架等萜类合成途径的Unigene 5条,细胞色素P450的Unigene 74条,苯丙烷代谢途径的Unigene 48条,黄酮和黄酮醇Unigene 4条,四环素的Unigene 6条,单萜的Unigene 3条,甜菜素的 Unigene 1条,咖啡因的Unigene 3条,新生霉素的 Unigene 3条,玉米素的Unigene 5条,油菜素甾醇途径的 Unigene 4条等。还发现了一些具有很高营养保健价值和生理活性的生化途径,包括聚酮合酶、赖氨酸合成途径、多聚糖途径、胆甾醇丁酸酯途径、类甾醇途径、叶酸、核黄素、牛磺酸和亚牛磺酸等。上述泸定百合鳞茎的生理生化途径是在百合科植物中首次报道,从分子水平证明了泸定百合含有很多的药用活性物质,在医药化工、营养保健等领域具有很大的开发研究潜力。
本研究对泸定百合鳞茎进行了转录组及其特性分析,提供了大量参与泸定百合鳞茎形成发育相关的基因信息,包括器官发育、抗病抗逆、生理生化、次生代谢等,特别是调控鳞茎发育和次生代谢过程中的重要功能基因,为开展泸定百合鳞茎形成和发育的分子机制、药用活性成分等方面的研究,进而进行百合的分子育种和研究开发,提供了参考和依据。
[1] 龙雅宜,张金政,张兰年.百合—球根花卉之王[M].北京:金盾出版社,1999.
[2] 陈心启,许介眉,梁松筠.中国植物志:14卷[M].北京:科学出版社,1980:127.
[3] 尚迪,叶昌华,孙婷,等.甘孜州野生百合科植物资源调查研究报告[J].现代园艺,2012,12:5.
[4] 何丽萍,李龙根,庞祖云.野生泸定百合种子休眠和萌发习性的研究[J].种子,2010,4(4):46-49.HE L P,LI L G,PANG Z Y.Study on dormancy and germination characters of wild lily(Lilium sargentiae Wilson)seed[J].Seed,2010,4(4):46-49.(in Chinese)
[5] 黄作喜,卿东红.野生泸定百合的快繁技术[J].北方园艺,2005(5):83.
[6] 易欣,周颂东,何兴金.野生通江百合高频率再生植株的研究[J].四川大学学报:自然科学版,2013,50(1):193-198.YI X,ZHOU S D,HE X J.High efficency of plant regeneration from wild lily(Lilium saregentiae Wilson)[J].Journal of SichuanUniversity:Nat.Sci.Edi.,2013,50(1):193-198.(in Chinese)
[7] 智丽,滕中华,李先源,等.通江百合SRAP-PCR体系优化及引物筛选[J].西南大学学报:自然科学版,2013,35(4):1-8.ZHI L,TENG Z H,LI X Y,et al.Optimization of SRAP-PCR system and selection of primers for Lilium sargentiae[J].Journal of Southwest University:Nat.Sci.Edi.,2013,35(4):1-8.(in Chinese)
[8] 虞泓,王红霞,游丹.泸定百合居群染色体形态研究[J].云南大学学报:自然科学版,2000,22(1):60-67.YU H,WANG H X,YOU D.Study on chromosomal morphology in populations of Lilium sargenttiae Wilson[J].Journal of Yunnan University:Nat.Sci.Edi.,2000,22(1):60-67.(in Chinese)
[9] 王瑞波,张燕平,胡世俊,等.两种百合种群空间分布格局对高温干旱气候的响应[J].林业科学研究,2009,22(2):249-255.WANG R B,ZHANG Y P,HU S J,et al.Response of population distribution patterns in two species of Liliumto hot and drought climate[J].Forest Research,2009 22(2):249-255.(in Chinese)
[10] 杨嫦丽,王有国,王祥宁,等.镰刀菌诱导的泸定百合SSH文库构建及抗病相关基因筛选[J].西北植物学报,2014,34(11))2170-2175.YANG C L,WANG Y G,WANG X N.Construction of Lilium sargentiae SSH library induced by Fusarium oxysporumand screening of the resistance related genes[J].Acta Bot.Boreal Occident.Sin.,2014,34(11))2170-2175.(in Chinese)
[11] 夏宜平,黄春辉,郑慧俊,等.百合鳞茎形成与发育生理研究进展[J].园艺学报,2005,32(5):947-953.XIA Y P,HUANG C H,ZHENG H J,et al.Advances in researches on bulb development of Liliumspp and its physiological mechanisms[J].Acta Horticulturae Sinica,2005,32(5):947-953.(in Chinese)
[12] 吕英民,吴沙沙,张启翔.百合鳞茎发育生物学研究进展[J].北京林业大学学报,2009,31(5):145-150.LV Y M,WU S S,ZHANG Q X.Adances in the developmental biology of lily bulb[J].Journal of Beijing Forestry U-niversity,2009,31(5):145-150.(in Chinese)
[13] 吴沙沙,彭东辉,李雯琪,等.东方百合‘索邦'鳞茎源—库转化过程中碳水化合物代谢及相关酶活性变化[J].北京林业大学学报,2013,35(6):97-102.WU S S,PENG D H,LI W Q,et al.Carbohydrate metabolism and activity variation of related enzymes during the exchanging role of bulb sourc and sink of oriental hybrid lily ‘Sorbonne'[J].Journal of Beijing Forestry Universtiy,2013,35(6):97-102.(in Chinese)
[14] 李玲莉,刘华敏,孔立生,等.利用生物反应器进行香水百合培养研究[J].西北林学院学报,2014,29(1):89-94.LI L L,LIU H M,KONG L S,et al.Cultures of perfume Lily in vitro with airlift bio-reactors[J].Journal of Northwest Forestry University,2014,29(1):89-94.(in Chinese)
[15] 郭宇龙,张延龙,司国臣,等.秦巴山区5种野生百合鳞片繁殖特性研究[J].西北林学院学报,2013,28(1):90-93.GUO Y L,ZHANG Y L,SI G C,et al.Reproductive characteristics of five wild lilly occurring in Qin-Ba mountainous areas[J].Journal of Northwest Forestry University,2013,28(1):90-93.(in Chinese)
[16] 郝瑞杰,练从龙.不同处理对兰州百合子球根系生长的影响[J].西北林学院学报,2013,28(2):105-108.HAO R J,LIAN C L.Effects of different treatment on basal root system growth about Lilium davidii var.unicolor bulblets[J].Journal of Northwest Forestry University,2013,28(2):105-108.(in Chinese)
[17] 傅桂明,刘成梅,涂宗财.百合的保健功能和产品开发进展[J].食品研究与开发,2001,22(2),48.
[18] 司怀军,柳俊,谢从华.马铃薯class I patatin基因在试管块茎形成中的功能[J].作物学报,2006,32(9):1406-1409.SI H J,LIU J,XIE C H.Function of class I patatin gene in potato microtuber formation[J].Acta Agronomica Sinica,2006,32(9):1406-1409.(in Chinese)
[19] 程立宝,齐晓花,高学双,等 莲藕根状茎膨大相关基因的挖掘及表达分析[J].园艺学报,2012,39(3):501-508.CHENG L B,QI X H,GAO X S,et al.Isolation and expressing profile analysis of enlarging related genes in lotus root rhizome[J].Acta Horticulture Sinica,2012,39(3):501-508.(in Chinese)
[20] 景艳莉.百合鳞茎膨大发育生理与外源水杨酸影响初探[D].哈尔滨:东北林业大学,2007.
[21] 孙晓杰.东方百合鳞茎发育的激素与蛋白调控[D].杭州:浙江大学,2008.
[22] 赵海涛.东方百合‘Siberia'试管鳞茎发育及休眠研究[D].北京:中国农业科学研究院,2009.
[23] 张艳波.毛百合组织培养与试管鳞茎膨大的研究[D].哈尔滨:东北林业大学,2013.
[24] 李红娟.卷丹百合营养成分、活性物质及栽培特性的研究[D].杨陵:西北农林科技大学,2007.
[25] 李章念.两种食用百合中黄酮类物质研究[D].杨陵:西北农林科技大学,2007.
[26] 靳磊.秦巴山区4种野生百合鳞茎提取物的抑菌性研究[D].杨陵:西北农林科技大学,2008.
[27] 游雪娇.百合非淀粉多糖提取分离及抗氧化研究[D].南京:南京农业大学,2010.
[28] 邵囡囡,杨吉安,刘建军,等.秦岭太白米中黄酮类成分的研究[J].西北林学院学报,2011,26(5):166-169.SHAO N N,YANG J A,LIU J J,et al.Conponent analysis of flavonoids from Notholirion hyacinthinum srom qinling mountains[J].Journal of Northwest Forestry University,2011,26(5):166-169.(in Chinese)
[29] 靳磊,张延龙,王润丰,等.3种生态型宜昌百合鳞茎提取物的抗菌及抗氧化作用[J].中国食品学报,2013,13(2):73-78.JIN L,ZHANG Y L,WANG R F,et al.Study on antimicrobial and anti-oxidation activities of the bulb extract from three ecotypes of Lilium leucanthum (Baker)Baker[J]Journal of Chinese Institute of Food Science and Technology,2013,13(2):73-78.(in Chinese).
[30] 江香梅,伍艳芳,肖复明,等.樟树5种化学类型叶片转录组分析[J].遗传,2014,36(1):58-68.JIANG X M,WU Y F,XIAO F M,et al.Transcriptome analysis for leaves of five chemical types in Cinnamomum camphora[J].Heredias(Beijing),2014,36(1):58-68.(in Chinese)
[31] 李滢,孙超,罗红梅,等.基于高通量测序454GSFLX的丹参转录组学研究[J].药学学报,2010,45(4):524-529.LI Y,SUN C,LUO H M,et al.Transcriptome characterization for Saliva miltiorrhiza using 454GS FLX[J].Acta Pharmaceutica Sinica,2010,45(4):524-529.(in Chinese)
[32] 林萍,曹永庆,姚小华.普通油茶种子4个发育时期的转录组分析[J].分子植物育种,2011,9(4):498-505.LIN P,CAO Y Q,YAO X H,et al.Transcriptome analysis of Camellia oleifera Abel seed in four development stages[J].Molecular Plant Breeding,2011,9(4):498-505.(in Chinese)
[33] 杨楠,赵凯歌,陈龙清.蜡梅花转录组数据分析及次生代谢产物合成途径研究.北京林业大学学报,2012,34(增刊1),104-107.YANG N,ZHAO K G,CHEN L Q.Deep sequencing-based transcriptome profiling analysis of Chimonanthus praecoxreveals insights into secodary metabolites biosynthesis[J].Journal of Beijing Forsetry University,2012 ,34(Suppl.1):104-107.
[34] 郝大程,马培,穆军,等.中药植物虎杖根的高通量转录组测序及转录组特性分析[J].中国科学:生命科学,2012,42(5):398-412.HAO D C,MA P,MU J,et al.De novo characterization of the root transcriptome of a traditional Chinese medicinal plant Polygonum cuspidatum [J].Sci.China:Life Sci.,2012,42(5):398-412.(in Chinese)
[35] 张争,高志晖,魏建和,等.三年生白木香机械伤害转录组学研究[J].药学学,2012,47(8):1106-1110.ZHANG Z,GAO Z H,WEI J H,et al.The mechanical wound transcriptome of three-year-old Aquilaria sinensis[J].Acat Pharmaceutica Sinica,2012,47(8):1106-1110.(in Chinese)
[36] 魏利斌,苗红梅,张海洋.芝麻发育转录组分析[J].中国农业科学,2012,45(7):1246-1256.WEI L B,MIAO H M,ZHANG H Y.Transcriptomic analysis of seaame development[J].Scientic Agricultura Sinica,2012,45(7):1246-1256.(in Chinese)
[37] 贾新平,孙晓波,邓衍明,等.鸟巢蕨转录组高通量测序及分析[J].园艺学报,2014,41(11):2329-2341.JIA X P,SUN X B,DENG Y M,et al.Sequencing and analysis of the transcriptome of Asplenium nidus[J].Acta Horticulturae Sinica,2014,41(11):2329-2341.(in Chinese)
[38] 蒋弘刚,魏安智,杨途煕,等.花椒茎尖节点转录组测序及基因注释[J].西北林学院学报,2014 ,29(6):94-99.JIANG H G,WEI A Z,YANG T Xet al.Transcriptome sequencing of node tissue of stem tip of Zanthoxylum bungeanumand gene annotation[J].Journal of Northwest Forestry University,2014 ,29(6):94-99.(in Chinese)
[39] 陆萍,俞嘉宁.PPR蛋白影响植物生长发育的研究进展[J].植物生理学报,2013,49(10):989-999.LU P,YU J N.The affection of Pentatricopeptide repeat proteins in plant growth and development[J].Plant Physiology Journal,2013,49(10):989-999.(in Chinese)
[40] WEBER H,HELLMANN H.Arabidopsis thaliana BTB/POZ-MATHprotein interact with members of the ERF/AP2 transcription factor famil[J].FEBS Journal,2009,(276):6624-6635.
[41] URBANUS S L,MARTINELLI AP,DINH Q D,et al.Intercellular transport of epidermis-expressed MADSdomain transcription factors and their effect on plant morphology and floral transition[J].The Plant Journal,2010,63:60-72.

