绿色荧光蛋白转基因大鼠骨髓间充质干细胞在急性脊髓损伤大鼠中的迁移和分化
高 瑞,袁 文,王新伟,杨立利,陈华江
·基础研究·
绿色荧光蛋白转基因大鼠骨髓间充质干细胞在急性脊髓损伤大鼠中的迁移和分化
高 瑞,袁 文,王新伟,杨立利,陈华江
目的 观察绿色荧光蛋白转基因大鼠来源的骨髓间充质干细胞(bonemesenchymal stem cells,BMSCs)在急性脊髓损伤大鼠脊髓组织中的迁移和分化情况。方法全骨髓贝壁培养法培养BMSCs,Allen法制作脊髓损伤大鼠模型,共30只大鼠。于造模1周后进行干预,随机选取造模成功的24只大鼠并随机分为脊髓损伤组、假移植组(生理盐水注射)和细胞移植组(BMSCs注射),每组8只。于移植前、移植后7 d、14 d、21 d、28 d、35 d及42 d进行BBB(Basso,Beattie&Bresnahan locomotor rating scale)评分。HE染色、免疫荧光观察脊髓损伤的组织修复和BMSCs的迁移分化情况。结果从第14天始,细胞移植组大鼠的BBB评分较脊髓损伤组和假移植组大鼠高,差异具有统计学意义(P<0.05)。HE染色显示细胞移植组大鼠的脊髓结构相对完整,液化和囊泡区缩小,炎性细胞减少。免疫荧光显示BMSCs聚集于脊髓损伤处,且能分化为神经元、神经胶质细胞和神经前体细胞。结论BMSCs能向脊髓损伤部位迁移和聚集,并分化为相应的神经细胞促进脊髓功能恢复。
大鼠;绿色荧光蛋白质类;骨髓;间质干细胞;脊髓损伤;细胞运动;细胞分化
JSpinal Surg,2015,13(5):299-302
脊髓损伤是目前脊柱外科治疗的难点之一,随着人们对脊髓损伤发生机制研究的不断深入,细胞移植治疗脊髓损伤逐渐成为可能[1]。骨髓间充质干细胞(bone mesenchymal stem cells,BMSCs)具有自我更新和多向分化的特性,因其来源广泛、扩增简单及低免疫原性等优点,已被广泛应用于再生医学领域[2]。但实验中常需预先对BMSCs进行标记,以便对其移植后在体内的迁移和分化进行示踪研究。常规的体外细胞荧光标记稳定性较差,为此,本研究采用绿色荧光蛋白(green fluorescent protein,GFP)转基因大鼠的BMSCs治疗急性脊髓损伤大鼠,观察BMSCs在受损脊髓内的迁移和分化情况。
1 材料与方法
1.1 实验动物及试剂
GFP转基因大鼠5只,体重约150 g,无特定病原体级;SD大鼠30只,体重约300 g,无特定病原体级(第二军医大学实验动物中心)。动物实验经第二军医大学伦理委员会批准,符合实验动物福利的相关要求。
含10%胎牛血清的DMEM/F-12培养液(Gibco公司,美国);1∶500 Tuj-1(微管蛋白β3,Invitrogen公司,美国);1∶400胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP;Invitrogen公司,美国);1∶400巢蛋白(Pharmingen公司,美国);1∶1000 CY3山羊抗小鼠红色荧光二抗(Invitrogen公司,美国);1∶20000 Hoechst荧光染料33258(Sigma公司,美国)。
1.2 BMSCs的分离和培养
采用全骨髓贝壁培养法分离培养BMSCs,GFP转基因大鼠麻醉后无菌条件下分离双侧股骨,剪掉骨髓端,注射器抽取骨髓至髓腔发白。将骨髓细胞制成单细胞悬液,800 r/min离心5 min(离心半径为15 cm),弃上清,加入80 mL含10%胎牛血清的DMEM/F-12培养液常规培养。待细胞生长至90%融合时进行传代,每周传代1次,收获传代培养的第三代细胞。
1.3 脊髓损伤大鼠模型的制作
将体重300 g的无特定病原体级SD大鼠用1%的戊巴比妥钠(40 mg/kg)腹腔注射麻醉后,俯卧位固定。备皮消毒后,背部正中切口,约3 cm,暴露T8~11棘突及两侧椎板。剪刀在T9,10双侧椎板做纵形切口,咬骨钳去除T9,10棘突及椎板,暴露T9,10脊髓。用改良Allen法制作脊髓损伤大鼠模型,采用10 g的重量自25 mm高度自由落下[3]。观察到大鼠双下肢呈迟缓性瘫痪、尾巴痉挛性摆动后,常规缝合。造模后每日2次挤压膀胧排尿,阿莫西林(500 mg/L)喂食1周预防感染。
1.4 实验动物分组及BMSCs移植
30只SD大鼠进行脊髓损伤造模,共28只大鼠造模成功。于造模1周后随机选取其中24只,并随机分为脊髓损伤组、假移植组(生理盐水注射)和细胞移植组(BMSCs注射),每组8只。BMSCs移植和生理盐水注射于造模1周后实施,实施前对所有的大鼠进行BBB(Basso,Beattie&Bresnahan locomotor rating scale)评分[4]。1%的戊巴比妥钠(40 mg/kg)腹腔注射麻醉后,暴露T9,10脊髓,将5μL PBS缓冲液加入5×105的BMSCs进行稀释,分别用微量注射器在损伤区头尾两端各2 mm处进行注射,注射的剂量各为2.5μL,注射的速度为1μL/min。然后用1μL PBS将针头中剩余的细胞继续推注完毕,注射完毕后针头在脊髓组织里停留2 min,以防止细胞从注射点渗出。假移植组采用相同剂量的生理盐水于脊髓损伤处头尾两端2 mm处进行注射。上述过程操作完毕后,缝合伤口,每日2次膀胧挤压排尿,阿莫西林(500 mg/L)喂食1周预防感染。
1.4 BBB评分及病理检测
于移植前、移植后7 d,14 d,21 d,28 d,35 d及42 d将大鼠放入空旷可以自由活动的场所,BBB评分进行观察,由2名操作者独立进行实施,计算均值。
移植后42 d处死大鼠,取出脊髓病理,取材自损伤中心向头尾两端各延长1 cm(≥2 cm脊髓组织)。4%多聚甲醛固定,石蜡包埋后,连续横断面50μm切片,每只大鼠切片3~5张。取部分切片HE染色,另取部分切片行免疫荧光检测。一抗包括1∶500的Tuj-1,1∶400的GFAP和1∶400的巢蛋白。二抗为1∶1 000的CY3山羊抗小鼠红色荧光二抗。再用1∶20 000的Hoechst荧光染料33258染色30 min标记细胞核。
1.5 统计学处理
采用SPSS 16.0软件对数据进行处理,所得数据用¯x±s进行表示。3组间比较采用方差分析,两组间比较采用t检验。P<0.05为差异具有统计学意义。
2 结 果
2.1 BBB评分
实验过程中无大鼠死亡,移植前3组大鼠的BBB评分差异无统计学意义(P>0.05),在实施干预后7 d,各组的评分差异仍无统计学意义(P>0.05)。从第14天始,细胞移植组BBB评分明显较脊髓损伤组和假移植组高,差异具有统计学意义(P<0.05)。而各时间点脊髓损伤组和假手术组的BBB评分差异无统计学意义(P>0.05)。3组大鼠各时间点BBB评分详见表1。
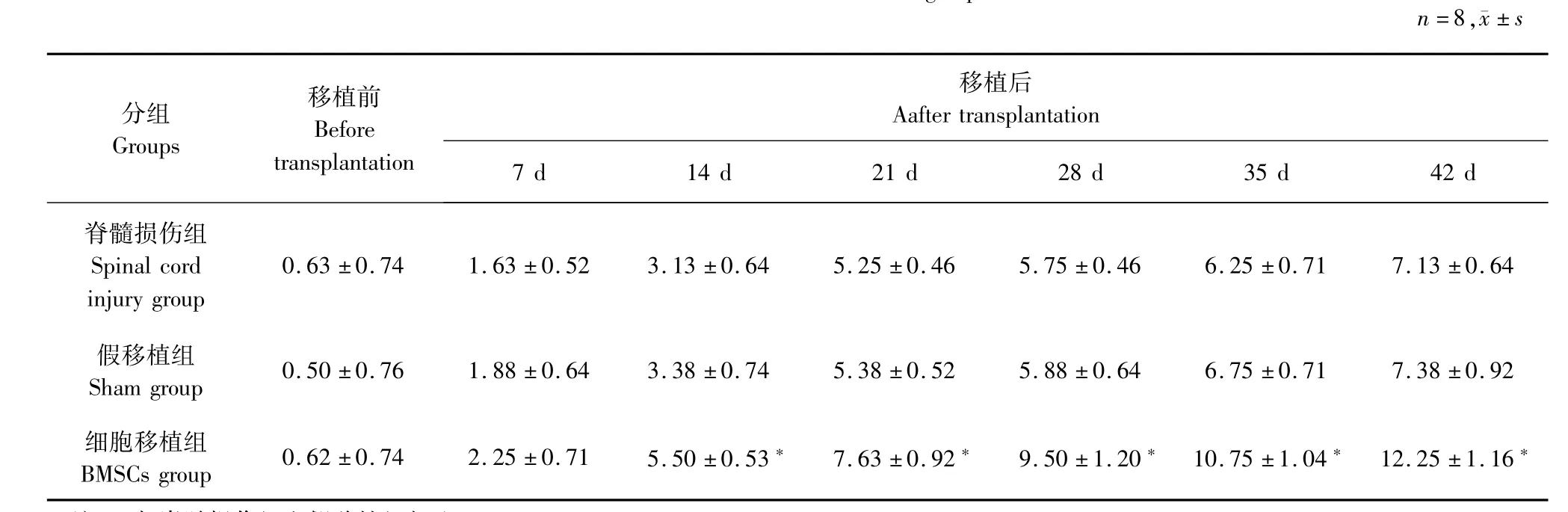
表1 3组大鼠BBB评分的比较Tab.1 BBB scale results of 3 groups
2.2 HE染色
病理切片HE染色显示,脊髓损伤组及假手术组镜下表现类似,大鼠的脊髓损伤部位可见组织结构受到破坏、液化和囊泡区形成、炎性细胞浸润(见图1a)。而细胞移植组大鼠脊髓损伤部位可见细胞排列相对紧密,脊髓结构相对完整,液化和囊泡区缩小,炎性细胞减少(见图1b)。
2.3 免疫荧光染色
免疫荧光显示,GFP标记的BMSCs聚集于脊髓损伤处,且沿损伤区分布,证实移植的BMSCs能向损伤区募集和迁移(见图2a)。当和红色荧光标记的Tuj-1共定位后显示GFP标记的BMSCs在体内能向神经元分化(见图2b)。当和红色荧光标记的GFAP共定位后显示GFP标记的BMSCs在体内能向神经胶质细胞分化(见图2c)。同样,和红色荧光标记的巢蛋白共定位后显示GFP标记的BMSCs在体内能向神经前体细胞分化(见图2d)。
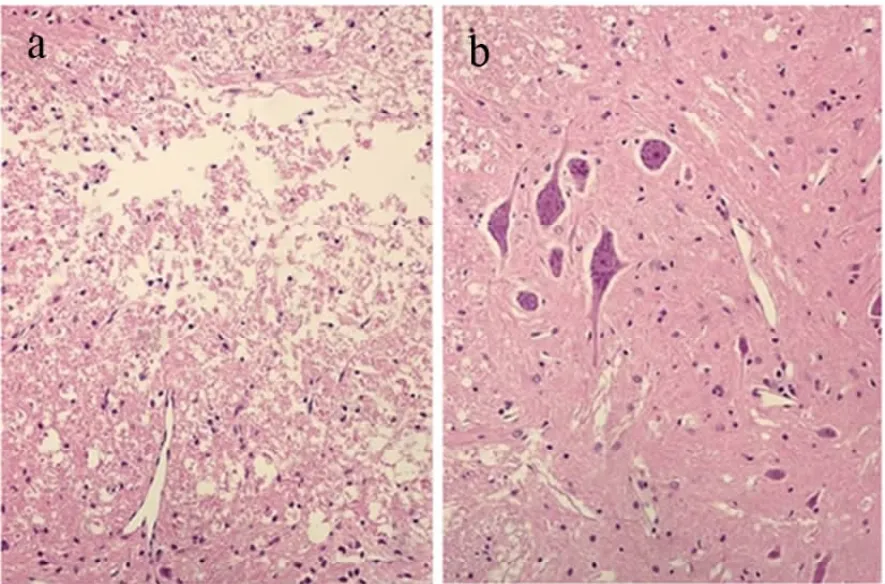
图1 大鼠脊髓病理HE染色Fig.1 HE-stained sections

图2 免疫荧光染色Fig.2 Immunofluorescent staining
3 讨 论
脊髓损伤后急性期脊髓出现水肿、缺血、出血,产生氧自由基、脂质过氧化反应、细胞毒性反应、炎症反应、脱髓鞘和神经细胞坏死等。亚急性期会出现巨噬细胞浸润、神经胶质细胞激活,瘫痕形成和神经血管化。慢性期会出现神经元变性、凋亡,瘫痕形成和空泡形成[5]。了解上述脊髓损伤后病理变化对其治疗至关重要,为了达到更好的治疗效果,移植的细胞必须能抑制损伤区的炎症反应、阻止神经细胞的坏死。更重要的是能促进神经元的再生和轴突的延伸[6]。目前BMSCs促进神经功能恢复可能通过以下几方面起作用:分泌神经营养因子增强神经细胞的再生能力,提供支架或底物引导轴突再生,分化为神经细胞替换坏死的细胞[7]。有学者认为移植的BMSCs发挥的脊髓保护功能主要是通过分泌神经营养因子这种间接的途径来实现的,因为很难对移植BMSCs进行在体跟踪和功能评价[8]。
由于缺乏特异性的免疫组化标记,干细胞移植治疗脊髓损伤的免疫组化共定位难以实施。目前较多的是通过免疫荧光共定位来在体跟踪移植的干细胞[9]。体外最有代表性的标记方法是5-溴脱氧尿嘧陡核苷(5-bromo-2-deoxyuridine,BrdU),但其缺点是随着时间的延长会出现标记强度减弱或标记丢失,出现灵敏度下降。而当采用基因转染细胞时,存在操作复杂和无法保证高转染率的问题[10]。所以,本研究采用来源于GFP大鼠的干细胞,其优点是能永久性稳定的表达GFP,且不产生GFP进入其他组织细胞,更有利于长期观察干细胞在体内的迁移和分化。
本研究发现,BMSCs移植治疗可以阻止脊髓损伤加重,HE染色发现存活的神经细胞增多,坏死和囊泡区缩小。低倍镜下免疫荧光检测发现移植的干细胞能较好地迁移和聚集于脊髓损伤部位。在移植2周以后,细胞移植组大鼠的BBB评分优于脊髓损伤组和假移植组,提示干细胞移植能有效促进脊髓神经功能的恢复。免疫荧光共定位证实移植的BMSCs能在损伤区分化为神经元、神经胶质细胞和神经前体细胞。本研究中还观察到分化为神经元和神经胶质细胞的比例要明显高于神经前体细胞,这可能是因为神经前体细胞是一种中间状态的细胞。通过免疫荧光还发现,囊泡区并无BMSCs的聚集和填充,表明BMSCs在囊泡区无法有效存活,证实脊髓损伤后损伤区的微环境对移植细胞的存活有很大影响。
国内外也有相类似的研究。Ozdemir等[11]用BMSCs治疗脊髓损伤的小鼠,采用GFP联合荧光素酶对移植的BMSCs进行体内追踪,发现脊髓组织中GFP联合荧光素酶的细胞可以表达巢蛋白及微管相关蛋白,提示移植的BMSCs参与了脊髓损伤后的神经细胞再生。Yin等[12]采用BMSCs治疗大鼠脊髓损伤,发现BMSCs移植后其轴突再生的标记物GAP-43 和MAP-2显著上调,同时细胞自噬的标记物MAP1-LC3B和Beclin 1则显著下调,提示BMSCs移植能有效阻止脊髓的缺血再灌注损伤及促进神经细胞再生。
本实验利用GFP转基因大鼠的BMSCs,进行体内示踪和免疫荧光共定位,揭示了外源性的BMSCs能有效聚集于脊髓损伤部位并分化为相应的神经细胞,为BMSCs治疗脊髓损伤提供了形态学证据。但还需进一步研究确定BMSCs向各种神经细胞分化的比例以及如何更有效的帮助BMSCs穿越脊髓损伤区和正常神经元形成有效的突触联接。
[1]Dasari VR,Veeravalli KK,Dinh DH.Mesenchymal stem cells in the treatment of spinal cord injuries:A review[J].World JStem Cells,2014,6(2):120-133.
[2]蒋涛,任先军,阴洪,等.大鼠骨髓间充质干细胞分离培养及多向分化研究的体外实验[J].脊柱外科杂志,2013,11(5):303-307.
[3]Hackney DB,Ford JC,Markowitz RS,etal.Experimental spinal cord injury:MR correlation to intensity of injury[J].JComput Assist Tomogr,1994,18(3):357-362.
[4]贺晓玉.大鼠胸段脊髓打击损伤程度与脊髓功能变化的关系[J].山东医药,2013,53(17):23-25.
[5]Deumens R,Koopmans GC,Honig WM,et al.Chronically injured corticospinal axons do not cross large spinal lesion gaps after a multifactorial transplantation strategy using olfactory ensheathing cell/olfactory nerve fibroblast-biomatrix bridges[J].J Neurosci Res,2006,83(5):811-820.
[6]Su H,Wu Y,Yuan Q,et al.Optimal time point for neuronal generation of transplanted neural progenitor cells in injured spinal cord following rootavulsion[J].Cell Transplant,2011,20(2):167-176.
[7]Pearse DD,Bunge MB.Designing cell-and gene-based regeneration strategies to repair the injured spinal cord[J].J Neurotrauma,2006,23(3-4):438-452.
[8]李洪秋,王哲,阿良.骨髓间充质干细胞移植对大鼠脊髓损伤后氧化应激的影响[J].脊柱外科杂志,2010,8(3):157-161.
[9]Shukla S,Chaturvedi RK,Seth K,et al.Enhanced survival and function of neural stem cells-derived dopaminergic neurons under influence of olfactory ensheathing cells in parkinsonian rats[J].J Neurochem,2009,109(2):436-451.
[10]刘勇,冯东福,陈二涛,等.绿色荧光蛋白转基因胚胎大鼠神经干细胞生物学特性研究[J].实用医学杂志,2008,24(5):709-712.
[11]Ozdemir M,Attar A,Kuzu I,et al.Stem cell therapy in spinal cord injury:in vivo and postmortem tracking of bone marrow mononuclear or mesenchymal stem cells[J].Stem Cell Rev,2012,8(3):953-962.
[12]Yin F,Meng C,Lu R,et al.Bone marrow mesenchymal stem cells repair spinal cord ischemia/reperfusion injury by promoting axonal growth and anti-autophagy[J].Neural Regen Res,2014,9(18):1665-1671.
M igration and differentiation of bone mesenchymal stem cells from green fluorescent protein transgenic rats w ith spinal cord injury
GAO Rui,YUAN Wen,WANG Xin-wei,YANG Li-li,CHEN Hua-jiang.Department of spine surgery,Changzheng Hospital,Second Military Medical University,Shanghai200003,China
Objective To investigatemigration and differentiation of bone mesenchymal stem cells(BMSCs)from green fluorescent protein(GFP)transgenic rats with spinal cord injury.MethodsBMSCs were harvested by whole bone marrow adherent culturemethod,and spinal cord injury model was established by Allen'smethod in 30 rats.One week after model building,24 rats were randomly divided into 3 groups:the spinal cord injury group,sham group and BMSCs group.Basso,Beattie&Bresnahan locomotor rating scale(BBB)scalewas evaluated before intervention,7 d,14 d,21 d,28 d,35 d,and 42 d after intervention.The injured spinal cords were obtained at 42 d for pathology test.ResultsBBB scale in BMSCs group was higher than spinal cord injury group and sham group from 14 d after the intervention.HE stain also showed smaller liquify area and less vesicles.Immunofluorescence showed the transplanted BMSCs can migrate to the injury area,and can differentiate into neuron,glia cells and neural progenitor cells.ConclusionBMSCs can migrate to the injury area in spinal cord injury,and differentiate into nerve cells to promote spinal cord repairing.
Rats;Green fluorescent proteins;Bone marrow;Mesenchymal stem cells;Spinal cord injuries;Cell movement;Cell differentiation
R329.28
A
1672-2957(2015)05-0299-04
】
10.3969/j.issn.1672-2957.2015.05.010
2014-06-06)
(本文编辑 张建芬)
上海市自然科学基金项目(12ZR1454500)
高瑞(1984—),博士,主治医师
200003上海,第二军医大学附属长征医院骨科
袁文 yuanwenspine@163.com