骸骨脊索瘤的临床特点及预后因素分析
周 磊,孟 通,杨兴海,魏海峰,严望军,刘铁龙,宋滇文,肖建如
骸骨脊索瘤的临床特点及预后因素分析
周 磊,孟 通,杨兴海,魏海峰,严望军,刘铁龙,宋滇文,肖建如
目的 探讨骸骨脊索瘤的临床特点和影响手术预后的相关因素,从而判定影响骸骨脊索瘤的局部复发和总体生存的因素。方法回顾性分析1991年1月~2012年12月在本院行手术治疗的骸骨脊索瘤患者资料95例。应用单因素生存分析和多因素Cox比例风险模型判定独立危险因素。生存率通过Kaplan-Meier曲线计算,通过对数秩检验判定统计学差异。选择P≤0.1的影响因素进入多因素Cox比例风险模型,判定独立危险因素。结果本组病例平均随访29个月,其中33例患者术后局部复发,局部复发率为34.7%(33/95);20例患者在本研究随访终止前死亡,总体生存率78.9%(75/95),术后生存时间(78.8±4.7)个月。在各临床因素中,术前Frankel分级、Enneking分期及手术方式与局部复发密切相关;年龄、性别、术前Frankel分级、术前选择性肿瘤动脉栓塞术与患者死亡密切相关。结论外科手术可提高骸骨脊索瘤患者的生存质量,延长患者生存期。30~70岁的男性患者总体生存率较高,术前较好的Frankel分级、EnnekingⅠ期、全脊椎en-bloc切除术可明显降低骸骨脊索瘤复发率;Frankel分级可作为术后总体生存率的独立预后因素。
骸骨;脊索瘤;肿瘤复发,局部;存活率分析;预后
JSpinal Surg,2015,13(5):280-284
脊索瘤是一种罕见的低度恶性骨肿瘤,发生率为8/10000000,占所有原发骨肿瘤的1%~4%[1]。脊索瘤常起源于脊索的胚胎残留物[2],主要分布于中轴骨,以骸尾部脊索瘤居多,占所有原发骸骨肿瘤的40%[3-4]。虽然组织病理学提示骸骨脊索瘤(sacral chordoma,SC)为低度恶性肿瘤、生长相对缓慢,但是其对化疗呈高度抵抗,对放疗效果也较差,同时由于骸尾部空间较大,造成SC体积较大,加之毗邻重要脏器、神经血管,完成整块切除难度较大,因此SC局部复发率高,在疾病的晚期易发生远处转移,给脊柱肿瘤医生的临床治疗造成很大的难度[5]。本研究通过对大样本病例的临床分析了解SC的疾病特点和预后因素,利于判断SC的预后。
1 资料与方法
1.1 临床资料
回顾性分析1991年1月~2012年12月在本院行手术治疗SC患者的临床资料95例,其中男67例,女28例;年龄28~79岁,平均56.4岁。术前神经功能经Frankel分级[6]。病理结果进一步分为3个亚型:经典型、软骨型、未分化型。软骨型判断标准:同时存在软骨样及脊索样肿瘤性组织,苏木素及伊红染色下组织切片中可见典型的豁液样细胞,肿瘤组织中豁液样细胞表达弹性蛋白、细胞角蛋白、上皮膜抗原及S-100蛋白,软骨样组织表达弹性蛋白及S-100蛋白。所有病例均根据Tomita分型[7]、Enneking分期[8]及WBB分期[9]制定手术方案。手术入路包括后路、前路及前后联合入路。
随访过程中通过临床表现、影像学资料或者二次手术后病理报告等证据判断是否复发。终点事件时间定义为出现复发或者死亡的日期与手术日期的时间间隔及存活病例手术日期与时间截点(2014年7月)间的时间间隔,从而获得局部无复发(local relapse-free,LRF)率及总体生存(overall survival,OS)率。所有出院病例均按照术后3个月、6个月、12个月、1.5年、2年及之后每年1次进行随访。通过电话随访获取死亡情况以及死亡时间。
1.2 统计学分析
将各种临床因素通过单因素及多因素分析以确定可预测预后的自变量。其中,患者相关因素包括年龄、性别、Karnofsky功能状态量表(Karnofsky performance status scale,KPS)评分[10]、治疗史、大小便功能及术前Frankel分级。肿瘤相关因素包括肿瘤部位及大小、术前是否存在远处转移、Enneking分期、Tomita分型以及病理亚型。治疗相关因素包括术前选择性肿瘤动脉栓塞术(preoperative selective arterial embolism,PSAE)、手术入路、切除方式、术中局部化疗、术中出血量、双磷酸盐治疗、辅助放疗及术后并发症。局部复发以及远处转移考虑为影响OS率的影响因素。采用log-rank检验进行各分组自变量的分析,进一步将P≤0.10的自变量行Cox比例风险回归模型检验,P≤0.05认为差异具有统计学意义。统计分析软件为PASW 19.0。
2 结 果
本组95例原发性SC患者,术后病理证实均为脊索瘤。肿瘤病灶位于S3以下51例,累及S2及以上44例。术前存在远处转移7例;术前存在大小便功能障碍57例;术前Frankel分级A~C级15例,D~E级80例;EnnekingⅠ期74例,Ⅱ~Ⅲ期21例;TomitaⅠ-Ⅲ型25例,Ⅳ-Ⅶ型70例;肿瘤大小直径≤9 cm 58例,>9 cm 37例。
所有患者均采取手术治疗。全脊椎en-bloc切除术42例,全脊椎分块切除术45例,病灶切除术8例;PSAE 56例;后路手术89例,前后联合入路6例;术中出血量100~4 300 mL,平均907 mL;术中应用铂类化疗药物局部冲洗术区者69例;病理亚型,经典型77例,软骨型3例,未分化型15例;术后出现切口不愈合等并发症5例,经积极处理后均痊愈后出院;术后应用双磷酸盐辅助治疗15例;术后辅助放疗7例;
随访1~180个月,平均29个月。随访期间复发33例,死亡20例;术后复发时间4~132个月,平均48.9个月。术后生存时间78.8±4.7个月。随访死亡时间为术后1~117个月,平均61.6个月。术后随访期间出现颅脑或肺部转移3例,骨与软组织转移10例。95例病例的相关资料见表1。
2.1 影响LRF率的预后因素
95例病例的LRF率65.3%(62/95),LRF生存时间为1~180个月,中位时间为56个月。单因素分析显示年龄、性别、术前Frankel分级、Enneking分期、Tomita分型、肿瘤大小、病理分型以及手术切除方式影响LRF率。其他因素与LRF率无相关性。
将单因素分析结果的潜在性预后影响因素进一步行多因素Cox比例风险模型分析。术前Frankel分级、Enneking分期及手术切除方式为独立预后影响因素。年龄、性别、Tomita分型、病理亚型不是影响LRF率的独立预后影响因素(见表2)。
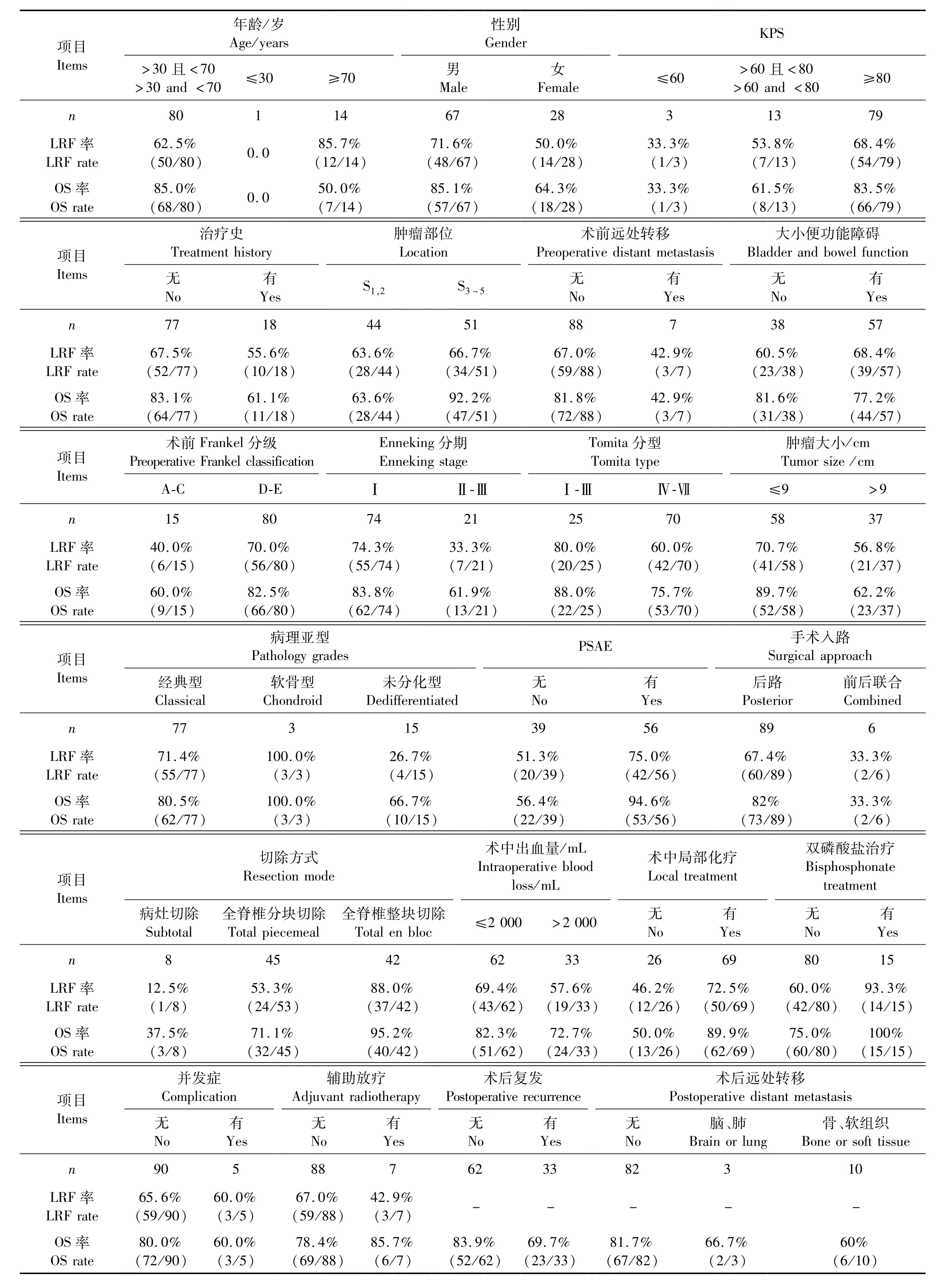
表1 影响肿瘤LRF率及OS率的单因素分析结果Tab.1 Univariate analysis of prognostic factors affecting LRF rate and OS rate
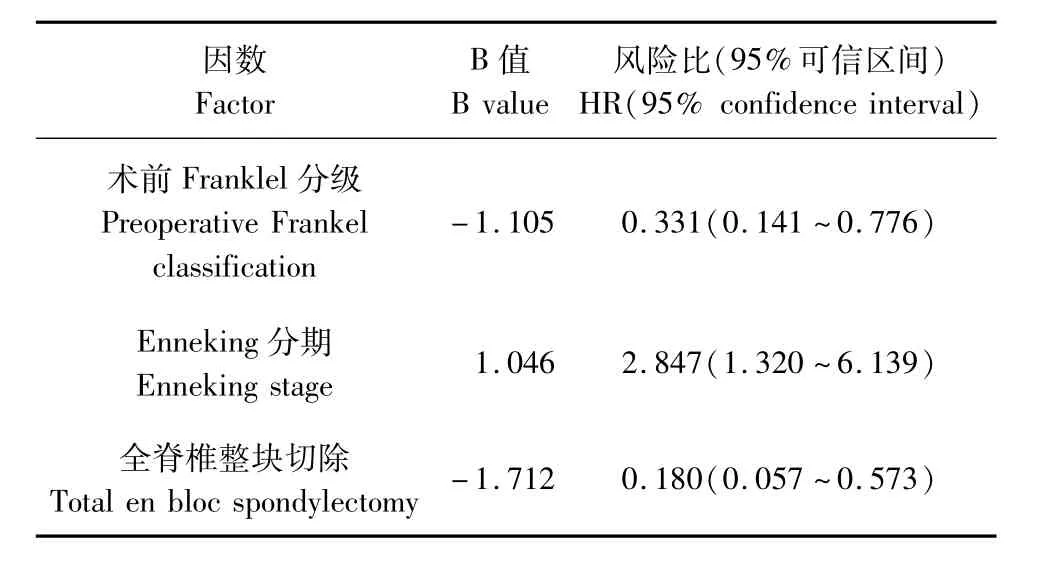
表2 影响LRF率的多因素分析Tab.2 Multivariate analysis of prognostic factors affecting LRF rate
2.2 影响OS率的预后因素
20例患者直接或者间接因脊索瘤导致死亡。总体OS率为78.9%,中位OS时间69个月。通过Kaplan-Meier法发现年龄、性别、KPS评分、治疗史、肿瘤部位、术前Frankel分级、Enneking分期、肿瘤大小、PSAE、手术切除方式、术中局部化疗与OS率相关;将这些因素进一步行多因素分析。多因素分析显示年龄≤30岁、年龄≥70岁、性别、术前Frankel分级、PSAE是显著的独立预后因素(见表3)。
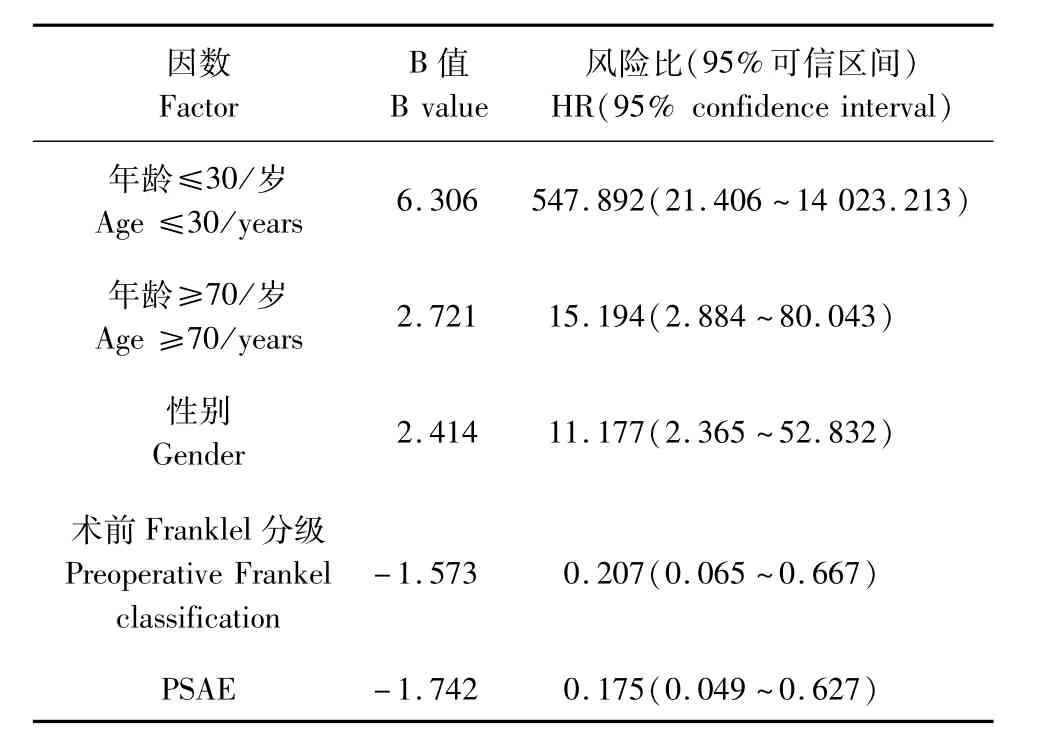
表3 影响OS率的多因素分析Tab.3 Multivariate analysis of prognostic factors affecting OS rate
3 讨 论
脊索瘤是一种相对罕见的低度恶性骨肿瘤,但在原发性骸骨肿瘤中占很高的比例[4]。通过分析于本组行手术治疗的95例 SC患者,发现术前Frankel分级可作为影响LRF率及OS率的独立因素;EnnekingⅠ期和全脊椎en-bloc切除术可明显减低局部复发率;30~70岁男性患者具有较高的OS率,PSAE可改善SC的OS率。
本组患者平均年龄56.4岁,大多数患者年龄为30~70岁,男性患者比例较高,与文献报道基本相符[11-12]。在本组病例中,KPS评分、治疗史、肿瘤部位、术前是否存在转移、大小便功能、Tomita分型、肿瘤大小、病理亚型、手术入路、术中出血量、术中局部化疗、双磷酸盐辅助治疗及辅助放疗均不能作为影响LRF率及OS率的预后因素;术后并发症、术后复发及术后远处转移均不是影响OS率的独立因素。
KPS评分是一种临床中常用的用以判定恶性肿瘤患者全身情况的指标之一[13-14]。本研究中 KPS评分不是影响LRF率及OS率的独立预后因素。Frankel分级用来判定脊髓损伤的严重程度,在本组病例中Frankel分级A~C级15例,D~E级80例,前者LRF率40.0%、OS率60.0%,后者LRF率70.0%、OS率82.5%。经多因素分析显示前后两者的LRF率及OS率存在差异,考虑主要原因在于术前Frankel分级较差者肿瘤明显压迫脊髓,神经功能差,肿瘤对硬膜囊的包裹导致难以完整切除肿瘤,最终导致局部复发率增加。且A~C级患者双下肢及大小便功能障碍,生活质量差,并发症发生率高,如坠积性肺炎、深静脉血栓、泌尿系统感染等,可危及生命。Enneking分期是骨骼肌肉系统肿瘤最常用的分期方法之一,对预测局部复发等具有显著意义。本研究显示Enneking分期同样适用于预测SC的局部复发率。
手术切除为SC的主要治疗方法[9],手术目的在于完整切除肿瘤,保护并改善患者神经功能,减轻疼痛,控制局部复发率及改善预后[11,15-16]。文献报道根治性切除比部分切除具有更好的预后[17]。手术方式包括病灶切除、全脊椎分块切除、全脊椎enbloc切除[9]。多因素分析结果表明,全脊椎en-bloc切除术可明显改善术后LRF率,但对于OS率未体现出明显改善作用,分析原因可能为早期全脊椎en-bloc切除术不成熟,多采用分块切除术,造成局部复发率升高。随着手术技术的成熟,全脊椎en-bloc切除术广泛应用于原发、复发SC中,而本研究只探讨初始手术方式对SC的影响,造成多因素分析中手术方式并未明显影响术后OS率。
PSAE可以明显减少术中出血、提高肿瘤切除率及手术安全性[18-19]。本研究发现PSAE可明显改善术后OS率,可能与PSAE减少出血后提高手术安全性及促进肿瘤完整切除有关。既往文献报道放疗对于脊索瘤无明显效果[20],本研究经多因素分析发现放疗不改善SC的预后。虽然近年来新的放疗技术已明显改善放射生物学效果[21-22],但对于SC的治疗效果仍需进一步的研究。双嶙酸盐是控制骨肿瘤尤其是转移性肿瘤导致的溶骨性破坏的辅助治疗方案[23-24]。曾有个案报道双嶙酸盐可改善SC局部骨质破坏引起的症状[25]。在本组病例中,通过单因素分析显示双嶙酸盐对于预防局部复发及提高生存率无明显作用,但本组病例受样本量及随访时间的限制,可能未能完全体现双嶙酸盐与SC的预后关系,后期仍需进一步的研究。
脊索瘤在疾病晚期可出现远处转移。本组13例患者(13.7%)在研究随访终止前出现了远处转移(脑/肺部3例、骨/软组织10例),发生率低于文献报道的>20%[26-27]。脊索瘤术后较易复发,本组病例中有33例出现复发(34.7%),本研究显示复发或转移未明显影响OS率,原因可能在于复发或转移后再手术改善了此类患者的预后。
综上所述,EnnekingⅠ期及全脊椎en-bloc切除术可明显降低患者的复发率;30~70岁的男性患者具有更高的OS率,PSAE可明显改善SC的OS率;Frankel分级可作为独立的预后因素。
[1]McMaster ML,Goldstein AM,Bromley CM,et al.Chordoma:incidence and survival patterns in the United States,1973-1995 [J].Cancer Causes Control,2001,12(1):1-11.
[2]Casali PG,Stacchiotti S,Sangalli C,et al.Chordoma[J].Curr Opin Oncol,2007,19(4):367-370.
[3]Meng T,Yin H,Li B,et al.Clinical features and prognostic factors of patients with chordoma in the spine:a retrospective analysis of 153 patients in a single center[J].Neuro Oncol,2015,17(5):725-732.
[4]Stacchiotti S,Casali PG,Lo Vullo S,et al.Chordoma of the mobile spine and sacrum:a retrospective analysis of a series of patients surgically treated at two referral centers[J].Ann Surg Oncol,2010,17(1):211-219.
[5]Varga PP,Bors I,Lazary A.Sacral tumors andmanagement[J].Orthop Clin North Am,2009,40(1):105-123.
[6]Frankel HL,Hancock DO,Hyslop G,etal.The value of postural reduction in the initialmanagement of closed injuries of the spine with paraplegia and tetraplegia.I[J].Paraplegia,1969,7(3):179-192.
[7]Tomita K,Kawahara N,Murakami H,et al.Total en bloc spondylectomy for spinal tumors:improvement of the technique and its associated basic background[J].JOrthop Sci,2006,11(1):3-12.
[8]Enneking WF,Springfield DS.Osteosarcoma[J].Orthop Clin North Am,1977,8(4):785-803.
[9]Boriani S,Weinstein JN,Biagini R.Primary bone tumors of the spine.Terminology and surgical staging[J].Spine(Phila Pa 1976),1997,22(9):1036-1044.
[10]Karnofsky DA,Burchenal JH.The Clinical Evaluation of Chemotherapeutic Agents in Cancer[M].MacLeod CM.Evaluation of Chemotherapeutic Agents.Columbia:Univ Press,1949:196.
[11]Ferraresi V,Nuzzo C,Zoccali C,et al.Chordoma:clinical characteristics,management and prognosis of a case series of 25 patients[J].BMC cancer,2010,10:22.
[12]Walcott BP,Nahed BV,Mohyeldin A,et al.Chordoma:current concepts,management,and future directions[J].LancetOncol,2012,13(2):e69-76.
[13]Crnalic S,Hildingsson C,Wikström P,et al.Outcome after surgery formetastatic spinal cord compression in 54 patientswith prostate cancer[J].Acta Orthop,2012,83(1):80-86.
[14]Ju DG,Zadnik P L,Groves M L,et al.Factors associated with improved outcomes following decompressive surgery for prostate cancermetastatic to the spine[J].Neurosurgery,2013,73(4):657-666.
[15]Osaka S,Osaka E,Kojima T,et al.Long-term outcome following surgical treatment of sacral chordoma[J].J Surg Oncol,2014,109(3):184-188.
[16]Wang Y,Xiao J,Wu Z,etal.Primary chordomas of the cervical spine:a consecutive series of14 surgicallymanaged cases[J].J Neurosurg Spine,2012,17(4):292-299.
[17]Kayani B,Hanna SA,SewellMD,etal.A review of the surgical management of sacral chordoma[J].Eur JSurg Oncol,2014,40(11):1412-1420.
[18]Ozkan E,Gupta S.Embolization of spinal tumors:vascular anatomy,indications,and technique[J].Tech Vasc Interv Radiol,2011,14(3):129-140.
[19]Yin H,Zhou W,Meng J,et al.Prognostic factors of patients with spinal chondrosarcoma:a retrospective analysis of 98 consecutive patients in a single center[J].Ann Surg Oncol,2014,21(11):3572-3578.
[20]Boriani S,Chevalley F,Weinstein JN,et al.Chordoma of the spine above the sacrum.Treatmentand outcome in 21 cases[J].Spine Int JRadiat Oncol Biol Phys.(Phila Pa 1976),1996,21(13):1569-1577.
[21]Austin-Seymour M,Munzenrider J,Linggood R,et al.Fractionated proton radiation therapy of cranial and intracranial tumors[J].Am JClin Oncol,1990,13(4):327-330.
[22]Nishida Y,Kamada T,Imai R,et al.Clinical outcome of sacral chordoma with carbon ion radiotherapy compared with surgery [J].Int JRadiat Oncol Biol Phys,2011,79(1):110-116.
[23]Luftner D,Henschke P,Possinger K.Clinical value of bisphosphonates in cancer therapy[J].Anticancer Res,2007,27(4A):1759-1768.
[24]Lipton A.Treatment of bone metastases and bone pain with bisphosphonates[J].Support Cancer Ther.,2007,4(2):92-100.
[25]Montella L,Addeo R,Faiola V,et al.Zoledronic acid in metastatic chondrosarcoma and advanced sacrum chordoma:two case reports[J].JExp Clin Cancer Res,2009,28:7.
[26]McPherson CM,Suki D,McCutcheon IE,et al.Metastatic disease from spinal chordoma:a 10-year experience[J].J Neurosurg Spine,2006,5(4):277-280.
[27]Baratti D,Gronchi A,Pennacchioli E,et al.Chordoma:natural history and results in 28 patients treated at a single institution [J].Ann Surg Oncol,2003,10(3):291-296.
Clinical features and prognostic factors analysis of sacral chordoma
ZHOU Lei,MENG Tong,YANG Xing-hai,WEI Hai-feng,YANWang-jun,LIU Tie-long,SONGDian-wen,XIAO Jian-ru.Department of Bone Tumor,Changzheng Hospital,Secondary Military Medical University,Shanghai200003,China
ObjectiveTo investigate the clinical characteristics of sacral chordoma(SC)and the prognostic factors of operation,so as to identify the factors affecting the local relapse and overall survival(OS)of SC.M ethods A retrospective analysis of patients with SC treated surgically between January 1991 and December 2012 was performed.The univariate survival analysis and multivariate Cox proportional hazards analysiswere carried out to identify independent prognostic factors.OS rate was estimated by the Kaplan-Meier method,and differences were analyzed by the log-rank test.Factors with P≤0.1 were subjected to multivariate analysis by Cox regression analysis.P≤0.05 were considered statistically significant.ResultsA total of 95 patientswith SCwere included in the study.Themean follow-up period was 29 months.Local relapse was detected in 33 patients after initial surgery with the local relapse rate 34.7%(33/95),while death occurred in 20 cases with the OS rate 78.9%(75/95).In addition,the time of OSwas 78.8±4.7 months.The statistical analysis suggested that preoperative Frankel classification,Enneking staging and resectionmodewere independent prognostic factors for local relapse.In addition,age,gender,preoperative Frankel classification and preoperative selective arterial embolism(PSAE)was related to the death of the patients.ConclusionSurgery is the ideal treatment for SC.It can notonly improve the quality of lives of patients,but also prolong survival.Preoperative Frankel classification(D-E)、Enneking stageⅠand total en-bloc spondylectomy can significantly degrade local relapse rate.In addition,male patients between 30 and 70 years old have a favorable OS rate,and preoperative Frankel classification is also an independent prognostic factor for OS rate.
Sacrum;Chordoma;Neoplasm recurrence,local;Survival analysis;Prognosis
R 738.1
A
1672-2957(2015)05-0280-05
】
10.3969/j.issn.1672-2957.2015.05.006
2015-02-11)
(本文编辑 于 倩)
上海市科委引导类科技项目(14411963700)
周磊(1983—),硕士,医师
200003 上海,第二军医大学附属长征医院骨肿瘤科
宋滇文 songdw@sh163.net