人脐带血间充质干细胞对人胃癌MGC80-3 细胞增殖的影响
张 娜
邢台医学高等专科学校诊断教研室,河北 邢台054000
间充质干细胞(mesenchymal stem cells,MSCs)存在于机体多种组织中,可在体外进行培养扩增[1],并参与肿瘤的发生、发展。目前多数研究主要针对MSCs对肿瘤的影响,人脐带血间充质干细胞(human umbilical cord blood mesenchymal stem cells,hUCB-MSCs)在胃癌中的研究却少有报道。本文通过分析hUCB-MSC在体外对胃癌细胞增殖的影响,以期对胃癌的治疗提供新的依据。
1 材料与方法
1.1 细胞株 hUCB-MSCs,天津昂赛公司提供;人胃癌细胞株MGC80-3,河北医科大学第四医院科研中心提供,且在含有10%胎牛血清的RPMI-1640 培养基中生长,并在37 ℃,5% CO2和饱和湿度条件下培养。
1.2 主要试剂 RPMI-1640、α-DMEM 细胞培养基,美国GIBCO 公司生产;四甲基偶氮唑蓝(MTT),美国SIGMA 公司生产。
1.3 hUCB-MSCs 原代培养、纯化及表型鉴定 在含10%胎牛血清,青霉素、链霉素各100 μl/ml 的α-DMEM 培养基在37 ℃,5% CO2和饱和湿度条件下培养hUCB-MSCs。以5 000/cm2接种,达90%融合时胰酶消化传代。hUCB-MSCs 培养至第4 代,采用流式细胞仪对其进行表型鉴定。
1.4 MGC80-3 细胞培养 将含10%胎牛血清,青霉素、链霉素各100 U/ml 的RPMI-1640 培养基在37 ℃,5% CO2和饱和湿度条件下培养人胃癌MGC80-3 细胞。以10 000/cm2接种,达50%融合时更换培养基,达90%融合时胰酶消化传代。待细胞生长状态佳,呈对数生长期时收集细胞用于实验。收集细胞后用PBS液洗涤2 次,备用。
1.5 MTT 法测定细胞增殖反应 取对数期人胃癌MGC80-3 细胞,以每孔1 ×104个细胞接种于96 孔板中,补足培养液至200 μl,将96 孔板放入CO2恒温培养箱,24 h 细胞贴壁后吸出培养液。实验组换用含不同浓度的MSC-CM,每个浓度做5 个复孔,置于CO2恒温培养箱分别培养24 h、48 h、72 h,培养结束前4 h,加入0.5% MTT 20 μl,37 ℃继续孵育4 h,终止培养。小心弃去孔内上清。每孔加入浓度为10%的DMSO 150 μl,振荡10 min。在酶联免疫检测仪上测定各孔光吸光度值(OD),检测波长492 nm,参考波长620 nm。按公式计算细胞抑制率。上述实验重复3 次。抑制率(%)= (1 - 实验组OD 值/对照组OD 值)×100%。
1.6 倒置相差显微镜观察hMSC-CMs 对MGC80-3细胞形态的影响 取对数生长期的MGC80-3 细胞,调整其浓度为5 ×105个/ml,在6 孔培养板的每孔中加入细胞悬液2 ml,待细胞贴壁良好后,向实验孔中加入浓度为75%的hMSC-CMs,继续培养72 h,于倒置相差显微镜下观察结果。
1.7 流式细胞仪测定人胃癌MGC80-3 细胞凋亡用Rnase 酶消化已固定的人胃癌MGC80-3 细胞。在4 ℃条件下加入溴化丙啶(PI)1 ml 染色30 min,以500 目铜网过滤,制备待检测的单细胞悬液。调整仪器的变异参数(CV)在2%以内,激发光源为15 mW 氩离子激光器,激发波长为488 mm。计算细胞凋亡百分率。
1.8 统计学分析 运用SPSS 13.0 统计学软件对实验数据进行处理,计量资料以x ±s 的形式表示。多组间均数差异性的比较采用单因素方差分析(one-way ANOVA)。P <0.05 为差异有统计学意义。
2 结果
2.1 hUCB-MSCs 的表型鉴定 采用流式细胞仪表型分析获得的第4 代hUCB-MSCs 细胞表达情况为:高表达PE-CD73(97. 69%)、PE-CD90(100%)、PE-CD105(96. 59%);低表达FITC-CD19(0. 50%)、FITC-CD34(0.23%)、PE-CD11b(0.20%)、PE-CD45 (0.11%);对组织相容性表型分析显示:低表达HLA-DR(0.07%)、PE-IgG(1.00%)、FITC-IgG(0.17%)。上述结果说明细胞均质性好,符合本实验要求(见图1)。
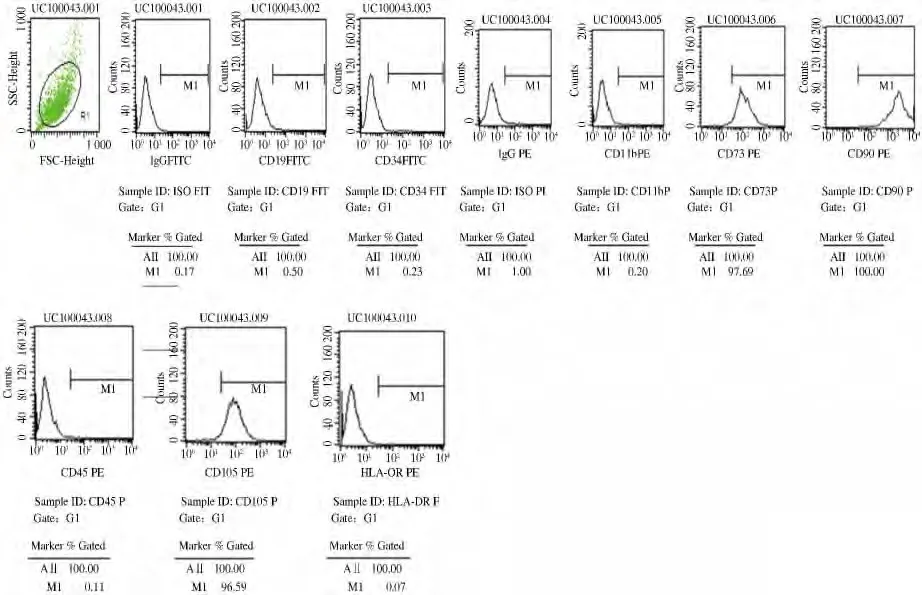
图1 流式细胞仪检测细胞表型结果Fig 1 Phenotype of MSCs by flow cytometry
2.2 MTT 比色法分析结果 MTT 比色法分析浓度分别为25%、50%、75%、100%的MSC-CM 对MGC80-3 细胞增殖的作用,以不含MSC-CM 组作为空白对照组。结果显示:MSC-CM 在25% ~100%浓度范围内对MGC80-3 细胞增殖具有较明显的抑制作用,存在剂量-效应和时间-效应关系。不同浓度的MSC-CM 作用MGC80-3 细胞24 h、48 h、72 h 后,各实验组抑制率均有不同程度升高,与空白对照组相比,差异均有统计学意义(P <0.05)。抑制率以100%MSC-CM 作用72 h最高,达到(67.695 ±14.444)% (见图2、表1)。
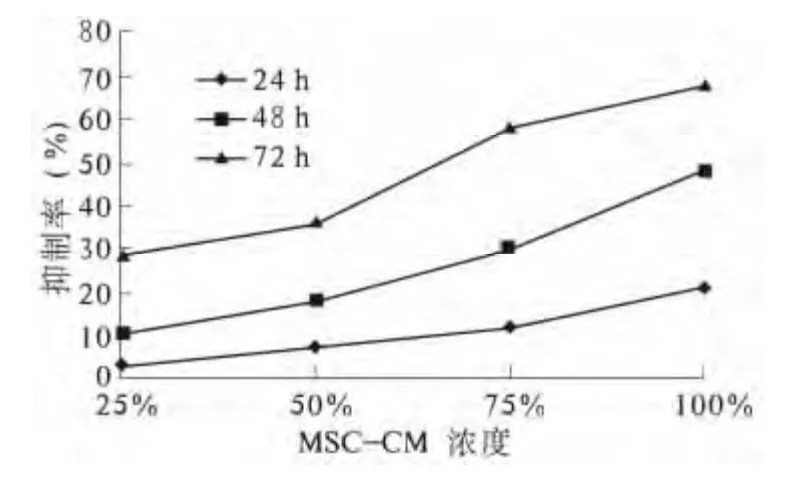
图2 细胞抑制率的组间比较Fig 2 Comparison of inhibitory rates among groups
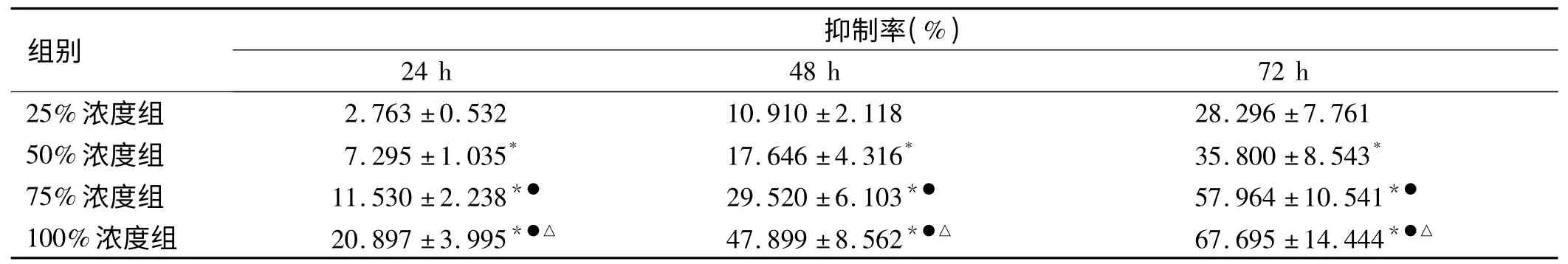
表1 MSC-CM 对MGC80-3 细胞增殖的影响(x±s)Tab 1 Effect of MSC-CM on the proliferation of MGC80-3 cells (x±s)
2.3 流式细胞仪测定细胞凋亡情况 MGC80-3 细胞与浓度依次为0、25%、50%、75%MSC-CM 共培养72 h后,流式细胞仪可测得典型的亚二倍体凋亡峰,说明MSC-CM 能诱导MGC80-3 细胞发生凋亡,细胞凋亡率随着MSC-CM 浓度的升高而升高。各实验组与空白对照组比较及各实验组之间比较,差异均有统计学意义(P <0.05,见图3 ~4、表2)。
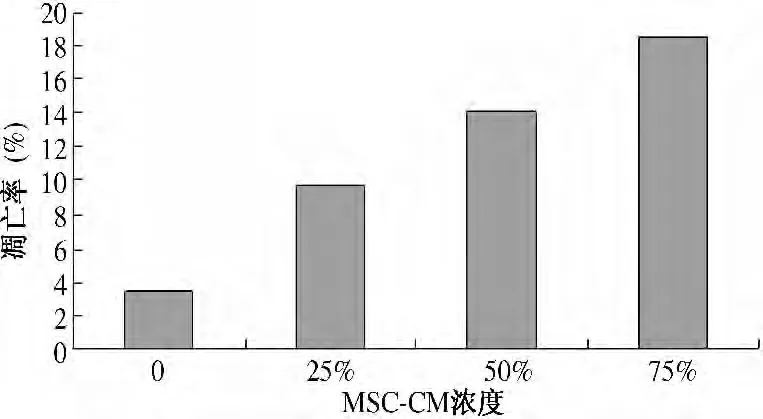
图3 细胞凋亡百分率的组间比较Fig 3 Comparison of apoptotic rate among groups
2.4 倒置相差显微镜观察结果 对照组细胞生长良好,贴壁紧密,细胞呈片状融合,呈梭形,形态饱满;而75%浓度的MSC-CM 作用72 h 后的细胞出现贴壁不良,细胞密度降低,细胞固缩为圆形或卵圆形(见图5)。
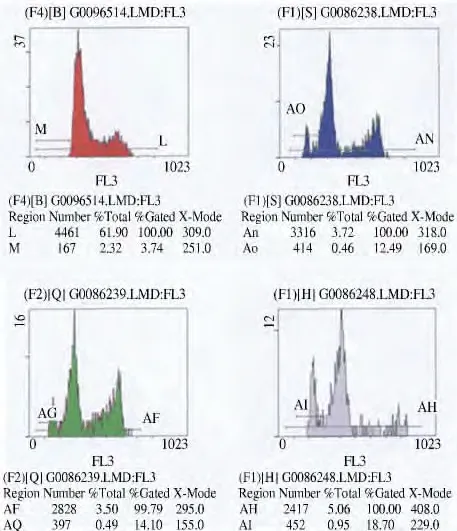
图4 不同浓度的MSC-CM 对MGC80-3 细胞作用72 h 后测得的凋亡峰 A:对照组;B:25%浓度组;C:50%浓度组;D:75%浓度组Fig 4 Apoptotic rates of MGC80-3 cells treated by MSC-CM for 72 h with different concentration A. control group;B.25% concentration group;C. 50% concentration group;D.75%concentration group
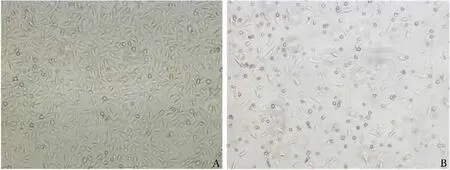
图5 作用72 h 后MGC80-3 细胞在倒置相差显微镜下的表现(100 ×) A:对照组;B:75%浓度组Fig 5 Expression of MGC80-3 cells untreated with MSC-CM for 72 hours by inverted phase contrast microscopy (100 ×) A:control group;B:75% concentrotion group
3 讨论
目前多数研究主要针对骨髓来源MSCs,但骨髓取材困难,供者难以接受,来源受到限制。相比较而言,hUCB-MSC 不仅保持了MSCs 的生物学特性,而且还具备如下优点:hUCB-MSC 更原始,增殖分化能力更强;免疫原性低,一般不引起免疫反应;分离培养操作简便,易于工业化生产;冷冻后可多次使用,且冷冻造成的细胞损伤小;潜伏性病毒和病原微生物的感染及传播几率比较低;取材方便,对产妇、新生儿无任何损伤及危害;易于保存、运输;无道德、伦理学的限制。本研究应用流式细胞术对所使用的hUCB-MSC 进行免疫表型和基因表型鉴定,证实hUCB-MSC 与其他来源的MSC 类似,高表达CD10、CD13、CD29、CD44、CD51、CD73、CD90、CD105 等;低表达或不表达CD14、CD33、CD34、CD45、CD56、HLA-G、HLA-DP、HLA-DQ、HLADR 等[2]。结果表明所使用的4 ~8 代hUCB-MSC 具备MSC 各项特征,符合实验要求。
本实验通过MTT 比色法研究脐带血来源间充质干细胞-条件培养基(the condition medium of MSCs,MSC-CM)在不同浓度范围内对人胃癌MGC80-3 细胞增殖的作用,结果发现:不同浓度MSC-CM 作用于MGC80-3 细胞24 h、48 h、72 h 后,各实验组抑制率均有不同程度升高,与空白对照组相比,差异均有统计学意义(P <0.05),且有剂量-效应和时间-效应关系。随着MSC-CM 浓度的提高、作用时间的延长,其对MGC80-3 细胞增殖的抑制率逐渐升高。通过诱导肿瘤细胞凋亡可起到抑制肿瘤细胞生长的作用,而肿瘤细胞的形态学变化是评价诱导凋亡作用最简便、最直观的指标。本实验通过倒置相差显微镜观察发现对照组细胞生长良好,贴壁紧密,细胞呈片状融合,呈梭形,形态饱满;而75%MSC-CM 作用72 h 后的细胞出现贴壁不良,细胞密度降低,细胞固缩为圆形或卵圆形。进一步通过流式细胞技术进行凋亡率检测发现MGC80-3 细胞与浓度依次为0、25%、50%、75%MSC-CM 共培养72 h 后,流式细胞仪可测得典型的亚二倍体凋亡峰,说明MSC-CM 能诱导MGC80-3 细胞发生凋亡,且随MSC-CM 浓度的增大而逐渐增高,MSC-CM 通过诱导MGC80-3 细胞凋亡进而发挥抑制MGC80-3 细胞生长的作用。
Lu 等[3]通过体外实验得出MSCs 可促进淋巴瘤细胞(YAC-1、EL-4)、肝癌细胞H22 等凋亡,抑制上述肿瘤细胞生长。Cho 等[4]发现MSCs 通过影响血管生成因子、趋化因子配体8、胰岛素样生长因子结合等的表达水平,使卵巢癌SK-OV-3 细胞核发生固缩,进而抑制肿瘤细胞的生长。在Ohlsson 等[5]进行的一项动物实验研究中,将结肠癌细胞和MSCs 的混合物与基质共同接种到大鼠皮下,MSCs 和结肠癌细胞数相等时,结肠癌细胞的生长完全被抑制。本研究结果显示,hUCB-MSC 能明显抑制人胃癌细胞株MGC80-3 细胞的体外增殖与转移,且作用效果具有剂量和时间依赖性。
已有研究表明MSCs 抑制肿瘤细胞生长的机制可能与以下因素有关:(1)MSCs 通过降低Akt 信号通路中丝氨酸苏氨酸激酶活性、促进肿瘤细胞产生p21、诱导肿瘤细胞产生凋亡促进因子caspase-3 等机制直接抑制肿瘤细胞生长[3,6-7]。(2)通过分泌血管生成素-1(Ang-1)抑制肿瘤血管的渗漏和体内肿瘤生长[8],释放Wnt 通路抑制因子DKK-1[9]等旁分泌机制发挥抑制作用。(3)作为抗原提呈细胞产生CD8+T 淋巴细胞依赖的抗肿瘤免疫反应[10]。
基于目前多项实验研究所得,结合本实验研究结果,认为hUCB-MSC 对胃癌细胞的增殖起抑制作用,深入研究其作用机制有可能对胃癌的临床治疗提供一定的依据。
[1] Zhang Y,Huang PP. Biological properties and application prospects in human umbilical cord mesenchymal stem cells[J]. International Journal of Transplantation and Hemopurification,2007,5(4):39-42.张彦,黄平平.人脐带间充质干细胞的生物学特性及应用前景[J].国际移植与血液净化杂志,2007,5(4):39-42.
[2] Studeny M,Marini FC,Dembinski JL,et al. Mesenchymal stem cells:potential precursors for tumor stroma and targeted-delivery vehicles for anticancer agents [J]. J Natl Cancer Inst,2004,96 (21):1593-1603.
[3] Lu YR,Yuan Y,Wang XJ,et al. The growth inhibitory effect of mesenchymal stenl cells on tumor cells in vitro and in vivo[J]. Cancer Biol Ther,2008,7(2):245-251.
[4] Cho JA,Park H,Kim HK,et al. Hyperthermia-treated mesenchymal stem cells exert antitumor effects on human carcinoma cell line[J].Cancer,2009,115(2):311-323.
[5] Ohlsson LB,Varas L,Kjellman C,et al. Mesenchymal progenitor cell-mediated inhibition of tumor growth in vivo and in vitro in gelatin matrix[J].Exp Mol Pathol,2003,75(3):248-255.
[6] Khakoo AY,Pati S,Anderson SA,et al. Human mesenchymal stenl cells expert potent antitumorigenic effects in a model of Kaposi's sarcoma[J]. J Exp Med,2006,203(5):1235-1247.
[7] Sun B,Roh KH,Park JR,et al.Therapeutic potential of mesenchymal stromal cells in a mouse breast cancer metastasis mode[J].Cytotherapy,2009,11(3):289-298.
[8] Nakamura K,Ito Y,Kawano Y,et a1. Antitumor effect of genetically engineered mesenchymal stem cells in a rat glioma model[J]. Gene Ther,2004,11(14):1155-1164.
[9] Etheridge SL,Spencer GJ,Heath DJ,et al. Expression profiling and functional analysis of wnt signaling mechanisma in mesenehymal stem cells[J].Stem Cells ,2004,22(5):849-860.
[10] Ma B,Ren J,Jang HF,et al. Antitumor activities against hepatocellular carcinoma induced by bone marrow mesenchymal stem cells pulsed with tumor-derived exosomes[J]. Journal of Peking University(Health Sciences),2008,40(5):494-499.马博,任军,姜晗防,等. 肿瘤源性外切体负载的间充质干细胞抗肿瘤活性的实验研究[J]. 北京大学学报(医学版),2008,40(5):494-499.

