木麻黄内含物含量与对星天牛抗性关系的研究
林秀琴,黄金水,蔡守平,柯玉铸,曾丽琼,何学友,陈顺立,吴惠忠,李秀明
(1.福建农林大学,福建 福州 350002;2.福建省林业科学研究院,福建 福州 350012;3.惠安赤湖国有林场,福建 泉州 362100)
木麻黄内含物含量与对星天牛抗性关系的研究
林秀琴1,2,黄金水2,蔡守平2,柯玉铸2,曾丽琼2,何学友2,陈顺立1,吴惠忠3,李秀明3
(1.福建农林大学,福建 福州 350002;2.福建省林业科学研究院,福建 福州 350012;3.惠安赤湖国有林场,福建 泉州 362100)
星天牛是东南沿海防护林树种木麻黄的主要蛀干害虫,属全国林业危险性有害生物。为探寻木麻黄内含物含量的高低与星天牛幼虫蛀害程度存在的联系,以及抗性机理和抗性主导因子,在2010~2012年对惠安赤湖国有防护林场48个木麻黄品系进行的抗虫性调查的基础上,选择具有代表性的抗性品系惠83、惠76、惠13,中抗品系广东A8-2、惠1、平潭2,感虫品系莆田20、惠88、惠58,测定该9个品系边材的内含物含量,进行多重比较和灰色关联度分析。结果表明,抗虫能力越强的木麻黄品系,可溶性糖含量越低,总酚、单宁、黄酮含量越高;蛋白质、多糖则无明显规律性;可溶性糖与抗虫性关联度最大,其次是总酚、单宁和黄酮。
木麻黄;内含物;抗虫性;星天牛
木麻黄Casuarinaspp.原产于澳大利亚、太平洋诸岛及东南亚,属阔叶树种,其叶片退化为细小鳞叶,代行叶片功能的绿色小枝酷似松类针叶。木麻黄[1]耐盐碱,且速生,现种人工林植面积已达30多万hm2,主要分布在福建、浙江、广东、广西、海南、台湾等省区,目前已成为这些省(区)滨海前沿沙质地带无可替代的造林树种。星天牛Anoplophora chinensis(Forster)[2]是东南沿海防护林的主要蛀干害虫,广泛分布与危害木麻黄,被国家林业局在2013年第4号公告中列为全国林业危险性有害生物。1966年黄炳勋等[3]在惠安赤湖国有林场首次发现其为害木麻黄,且为害率达33.4%;吴逸波[4]2012年在平潭的研究发现木麻黄受星天牛的为害率达45%。沿海风大,受害木麻黄因树干被蛀空,极易折断。鉴于星天牛蛀干危害,防治难度大,筛选抗虫品系是从源头解决该问题的举措。黄金水[5]、吴逸波[4]等人分别在惠安和平潭对木麻黄受星天牛为害情况进行研究,发现不同品系受害程度不同;黄金水[6]于1999年在惠安的研究认为不同受害程度的木麻黄部分化学物质含量存在差异,并且呈现一定的规律性。
为探寻木麻黄内含物含量的高低是否与对星天牛的抗性能力存在联系,本研究在2010~2012年对惠安赤湖国有防护林场48个木麻黄品系进行的抗虫性调查基础上,选择了具有代表性的、在我国东南沿海种植面积较大的9个木麻黄品系,测定其总酚、单宁、黄酮、蛋白质、可溶性糖、多糖6种内含物含量,分析其与木麻黄抗虫能力的的关系,以期明确星天牛侵害与木麻黄内含物含量的关系,为不断选育出在沿海防护林体系建设中具有推广应用价值的优良的抗星天牛木麻黄种质材料提供参考。
1 材料与方法
1.1 样地概况
木麻黄不同品系抗虫性林间调查的样地设置在惠安赤湖国有防护林场木麻黄优良种质材料收集实验区。样地所在区域位于118°90′E ,24°90′N,属南亚热带海洋性季风气候;年均温20℃左右,最高温出现在8月可达30℃,最低温出现在1~2月份,9~10℃;无霜期达306 d;年降水量达1 101 mm。林场土壤为滨海盐碱性沙土,主要种植木麻黄,林下植被稀疏且种类较少,最多见为马樱丹。实验林占地5 hm2,为7年生同龄林,共种植有48个木麻黄品系,各品系80~90株,行状种植;品系间随机分布。由于各种原因,部分品系存在不同程度的缺株现象。
1.2 林间木麻黄抗虫性划分标准
木麻黄对星天牛抗性分级标准的划分,参照国家森林病虫害防治总站发布的光肩星天牛、黄斑星天牛为害程度的分级标准[7],结合木麻黄林星天牛在林间为害的实际情况,设立抗性分级标准(见表1)。
1.3 测试材料来源
在2010~2012年对福建省林科院营建在惠安赤湖国有防护林场的优良木麻黄种质资源基因库内48个品系进行的抗虫性调查基础上,选择在我国东南沿海种植面积较大、并具有代表性的抗虫品系惠76、惠83、惠13,中抗品系广东A8-2、惠1、平潭2,感虫品系惠88、惠58、莆田20,3种类型9个木麻黄品系,作为室内测定其总酚、单宁、黄酮、蛋白质、可溶性糖、多糖6种内含物含量的材料。

表1 木麻黄对星天牛抗性分级标准Table 1Grading standard for resistance of Casuarina spp.to Anoplophora chinensis
1.4 取样与样品处理
星天牛主要以幼虫蛀食木木麻黄边材,为害处大多分布在距地面0.5 m以内的树干上。取样时,各品系分别选择未受害植株5株作为样株,按品系采集样株树干基部0.5 m以内的边材,方位随机,同一品系装入同一自封袋中并标记。样品采集完毕后迅速带回实验室进行预处理。预处理时将样品分别装入做好标记的牛皮纸袋中,将牛皮纸袋放入DHG-9123A型电热恒温鼓风干燥箱内以105℃处理10min,再以60℃恒温连续烘干48 h。将烘干后的样品用XFB-500型粉碎机粉碎后过40目筛,装入自封袋中,存于干燥器内备用。
1.5 样品测定
将样品充分混匀,以“四分法”根据实验需要称取适量样品进行内含物含量测定,平行实验3次。采用Folin-酚法测总酚,钨酸钠-磷钼酸比色法测单宁[8],亚硝酸钠-硝酸铝比色法测黄酮,考马斯亮蓝法测蛋白质,蒽酮比色法测可溶性糖、多糖[8-11]。所有测定均利用上海普析T6新世纪紫外可见分光光度计实现。
1.6 数据处理
采用Excel进行数据录入和初步处理,采用DPS v6.85进行数据处理和统计分析。
2 结果与分析
2.1 木麻黄不同品系受星天牛的危害情况
本研究从2010~2012年连续3年对实验林内的48个木麻黄品系受星天牛为害的情况进行逐月调查和记录,统计结果显示不同品系木麻黄不同年际的受害情况略有不同,但品系之间的差异却基本稳定,整体呈现为偏态分布,有虫株率10%~35%、平均虫口密度0.2~0.6头/株的占绝大多数;其幼虫虫口密度在10月份进入稳定状态(相关研究将另文报道)。本研究以2011年10月份的调查结果作为有关统计分析的基础,从中选取抗性品系、中抗品系和感虫品系各3个作为测试对象。
9个木麻黄品系2011年10月受星天牛幼虫为害情况的调查结果(见表2):惠83、惠76、惠13有虫株率均在10%以内,其中惠76仅2.9%的植株受害;平均虫口密度仍以惠76最低,仅为0.04头/株;总体受害程度轻,抗虫性为Ⅰ级,属于抗虫品系。广东A8-2、惠1、平潭2有虫株率分别为22.22%、35%、29.09%,平均虫口密度分别为0.28、0.45、0.33头/株,受害程度中等,抗虫性为Ⅱ级,为中抗品系。莆田20、惠88、惠58有虫株率均高于60%,以惠58的76.92%最高;平均虫口密度均高于1头/株,以惠58的1.74头/株最高,总体受害程度重,抗虫等级为Ⅲ级,即感虫。
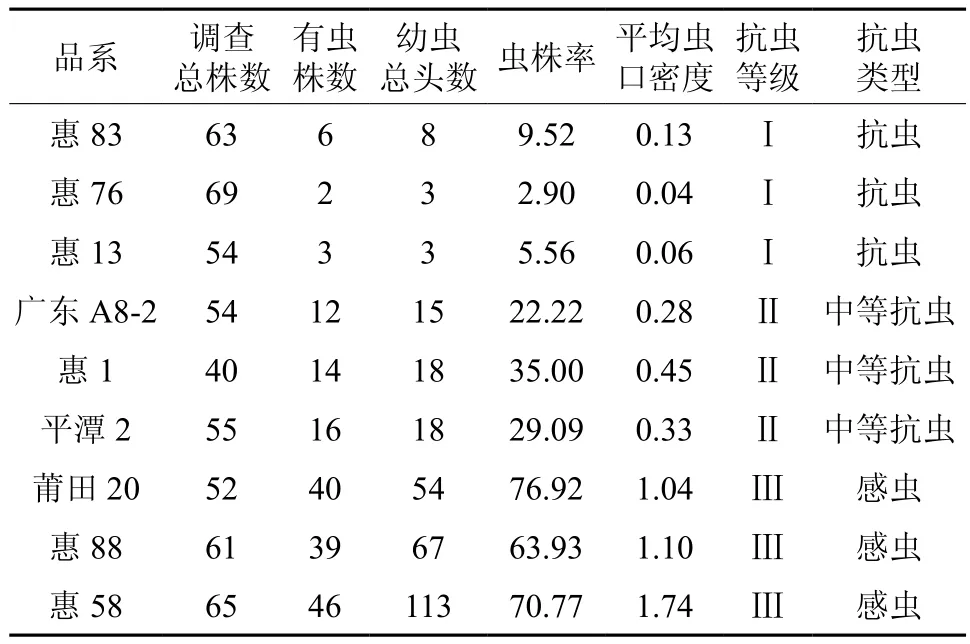
表2 木麻黄不同品系受星天牛幼虫蛀害情况Table 2Damaged degrees of different strains of Casuarina spp. by A. chinensis
2.2 各抗虫等级木麻黄品系内含物含量
采用Duncan’s新复极差法对各品系木麻黄内含物含量进行多重比较,结果见表3。总体上抗虫等级高的品系,总酚、单宁、黄酮含量较高,抗虫等级低的品系较低。
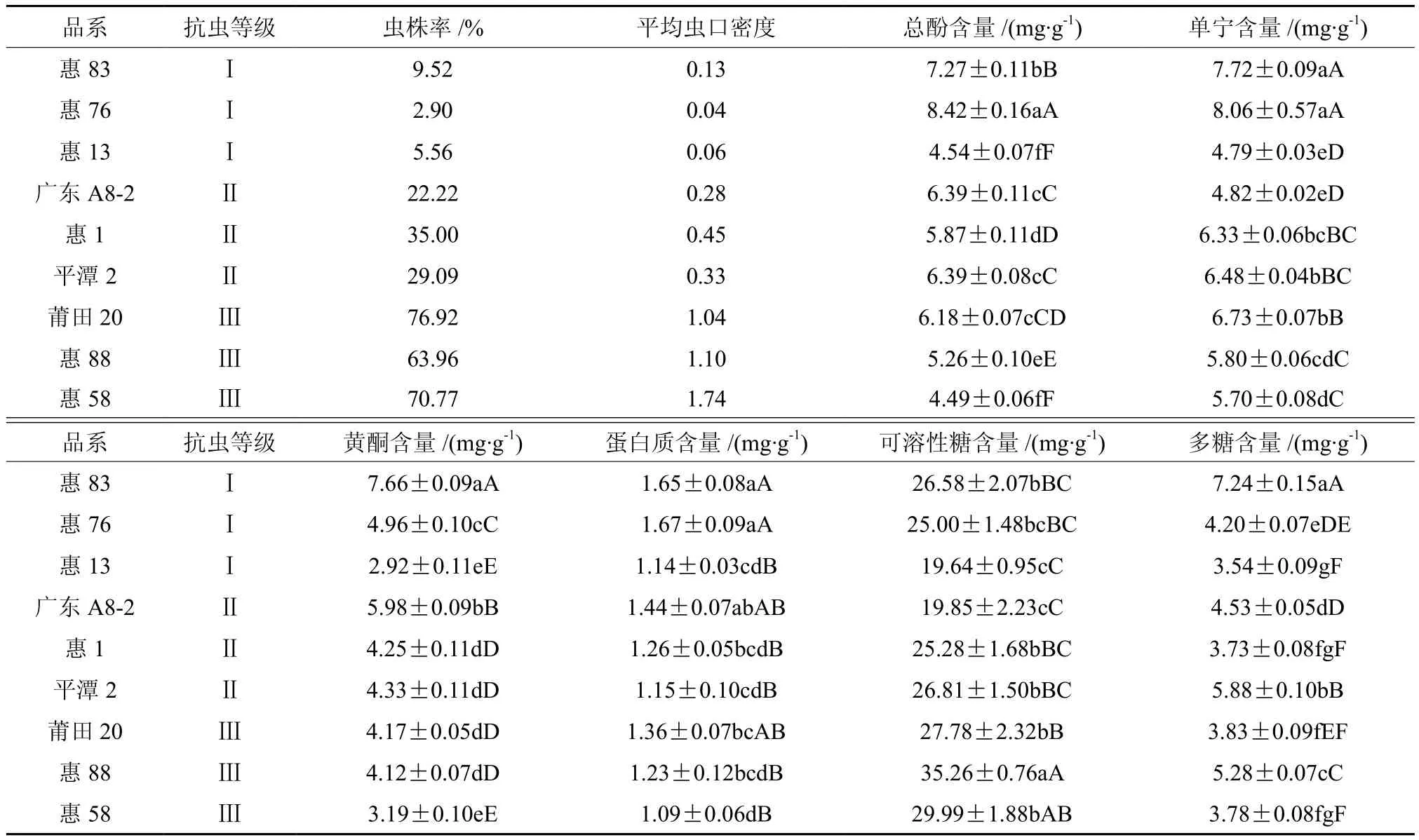
表3 不同抗虫等级木麻黄内含物含量†Table 3Different resistance degrees of Casuarina spp. inclusions contents
从总酚含量上看,抗性品系惠83、惠76与中抗品系存在极显著差异,中抗品系与感虫品系惠88、惠58亦存在极显著差异;而抗虫品系中的惠13总酚含量较低,与惠58差异不显著。从单宁含量上看趋势类似,同时惠13极显著低于惠88和惠58。从黄酮含量上看亦同有此趋势,同时惠13与惠58差异不显著,显著低于惠88;中抗品系中的广东A8-2的黄酮含量较高,介于惠83和惠76之间,且与该两种差异极显著。在营养物质水平上,蛋白质含量以惠76最高,惠83次之,品系间无明显规律性,若将9品系按蛋白质含量高低排序,相邻品系间无显著差异。可溶性糖以感虫品系中的惠88最高,抗虫品系中的惠13最低,基本呈现随抗虫等级降低而递增的趋势;但若按含量高低将9个品系排序,相邻两者间差异不显著。多糖含量以惠83最高,惠13最低,无明显规律性。
2.3 各种类内含物与木麻黄抗虫等级和受害程度的灰色关联度分析
为方便各内含物因子之间的比较和对各内含物因子与抗虫性、受害程度进行关联度分析,本研究采用z-score标准化法,对数据进行无量纲为方便数据标准化处理,分别以阿拉伯数字1、2、3替代罗马数字Ⅰ、Ⅱ、Ⅲ,标准化结果见表4。在数据标准化的基础上进行各种类内含物与木麻黄抗虫等级和受害程度的灰色关联度分析,其参照数列,ρ∈(0,1)为分辨系数。分辨系数[12]的选值对关联度数值的大小有一定的影响。本研究采用ρ=0.1的分辨系数,关联矩阵见表5。抗虫等级X1与各内含物因子的关联性从大到小依次为:可溶性糖X8、总酚X4、单宁X5、黄酮X6、多糖X9、蛋白质X7;虫株率X2与各内含物因子的关联性从大到小依次为:可溶性糖X8、黄酮X6、单宁X5、多糖X9、总酚X4、蛋白质X7;与平均虫口密度X3关联性依次为:可溶性糖X8、蛋白质X7、多糖X9、黄酮X6、总酚X4、单宁X5。
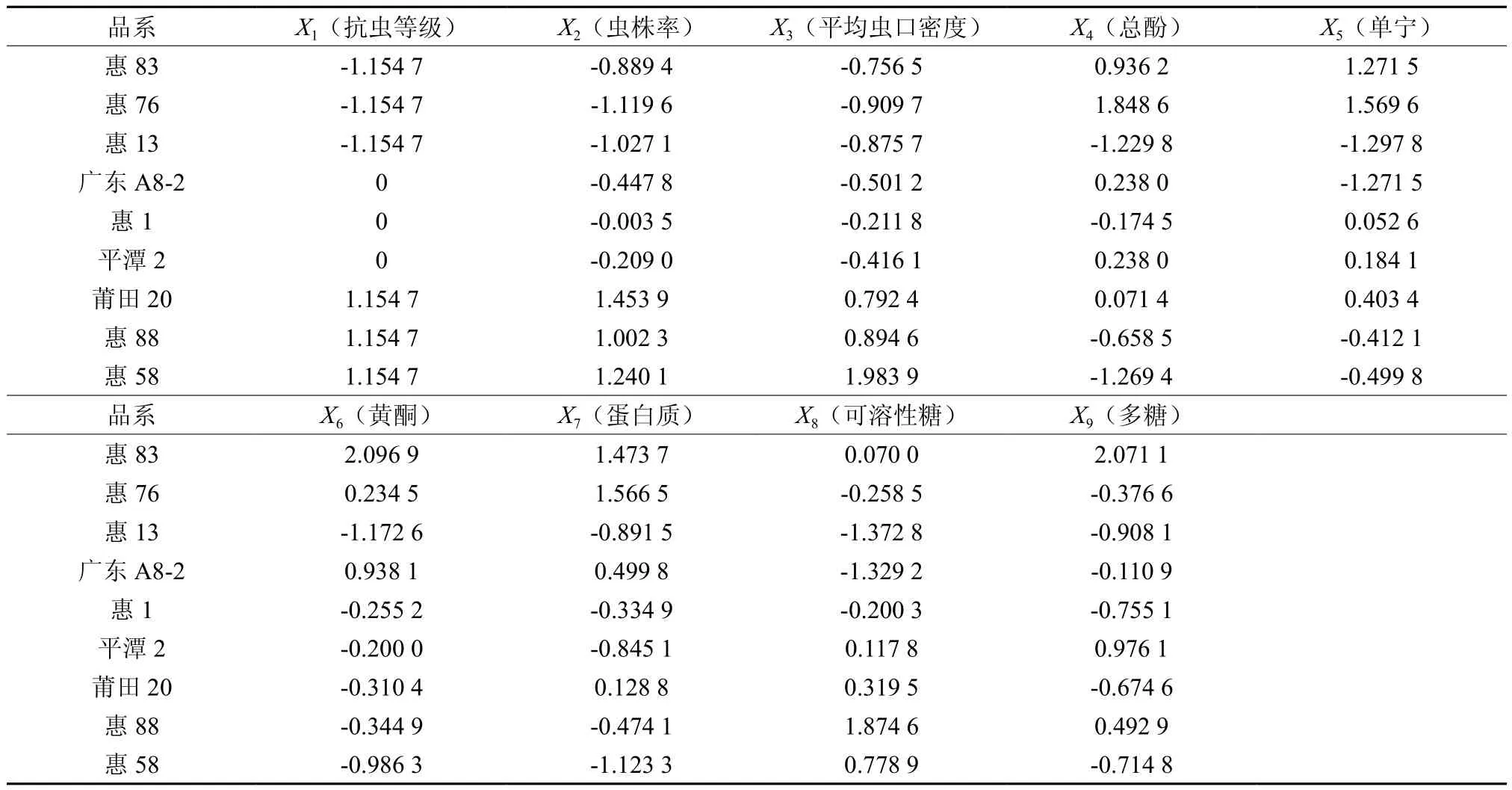
表4 数据标准化Table 4Results of data standardization of nine stains
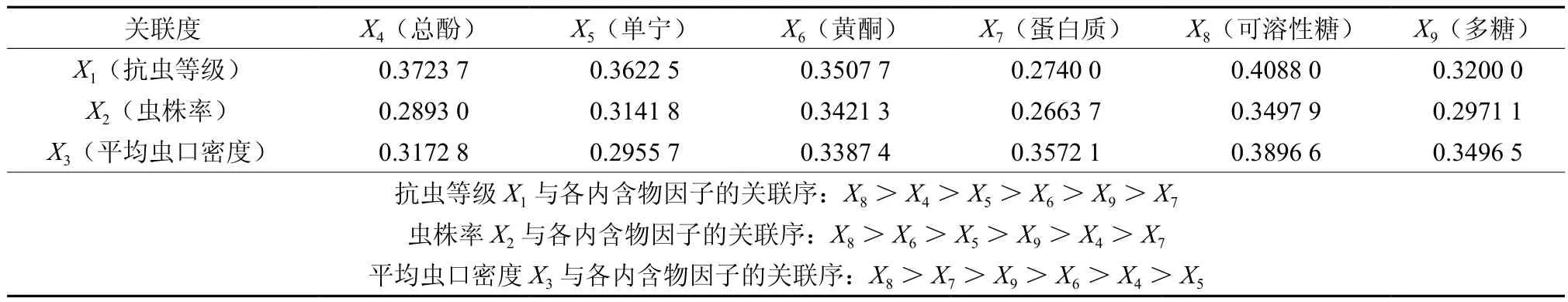
表5 各种类内含物与木麻黄抗虫等级和受害程度的关联矩阵Table 5Associataed matrix of inclusions contents and resistance or damage degree of Casuarina spp.
3 结论
林间木麻黄星天牛为害情况调查表明,惠83、惠76、惠13、有虫株率均低于10%,平均虫口密度低于0.2头/株,依据分级标准列为抗性品系;广东A8-2、惠1、平潭2有虫株率在11%~35%之间,平均虫口密度在0.2~0.6头/株之间,为中抗品系或称为中感品系;莆田20、惠88、惠58有虫株率和平均虫口密度分别大于35%和0.6头/株,为感虫品系。
对9个木麻黄品系的内含物含量进行多重比较,结果表明,各品系的不同内含物均存在明显的差异,具体表现为:抗虫等级较低、有虫株率和平均虫口密较高的品系,其总酚、单宁、黄酮等次生物质含量大多较低。这是由于次生物质如总酚、单宁、黄酮对植物的抗虫性有重要作用,可影响昆虫消化和代谢,推迟发育进度,甚至造成死亡,雒瑶瑜[13-15]等的研究得出类似的结论;同时次生物质在一定程度上降低适口性,导致昆虫的不选择,赵惠燕等[16]对小麦蚜虫的研究也表明这一点。蛋白质和总糖在11个品系间无明显规律性。蛋白质作为植物代谢的桥梁,其作用机制是复杂的[17],难以从总蛋白的含量上看出品系间的差异。值得注意的是可溶性糖含量随抗虫等级的降低呈升高趋势,与次生物质相反。这是由于糖分是重要的营养来源,具有强烈的激食作用,与感虫性有一定关系。
灰色关联度分析表明抗虫等级与可溶性糖的关联度最大,总酚、单宁、黄酮次之,再次是多糖和蛋白质。可见可溶性糖与木麻黄抗星天牛能力有较强的负相关性,总酚、单宁、黄酮与之有较强的正相关系。黄酮、单宁以及其他的酚类物质间存在一定的互变性[18-19],因此酚类物质整体可视为木麻黄对星天牛一个化学防御系统。
[1]黄金水,何学友.中国木麻黄病虫害[M].北京:中国林业出版社,2012.
[2]萧刚柔.中国森林昆虫(第2版) [M].北京:中国林业出版社,1992.
[3]黄炳勋,陈清机,吕飞平.木麻黄害虫星天牛(Anoplophoro chinensis (Forster))的习性及防治经验[J].林业科学,1966,(2):64-65.
[4]吴逸波.广东省木麻黄无性系引种生长于抗星天牛危害效果探析[J].林业勘察设计,2012(2):77-80.
[5]黄金水,丁 珌,黄衍庆,等.木麻黄种源对星天牛抗性的研究与推广应用[J].福建林业科学研究院, 2000:58-63.
[6]黄金水,丁 珌,黄衍庆,等.木麻黄化学和形态因素与星天牛危害的关系[J].林业科学,1999,35(2):57-64.
[7]国家森林病虫害防治总站.杨树星天牛监测、预测预报办法[EB/OL]:中国森防信息网,2011,6,28.
[8]贾之慎,刘志坤,付一穷.竹类中单宁类化合物总量的研究[J].竹子研究汇刊,1995,14(2):39-45.
[9]严国光,王福钧.农业仪器分析法[M].北京:农业出版社,1982.
[10]郝建军,康宗利,于 洋.植物生理学实验技术科技[M].北京:化学工业出版社,2007,141-142.
[11]李合生.植物生理生化实验原理与技术[M].北京:高等教育出版社,2001,184-185.
[12]东亚斌,段志善.灰色关联度分辨系数的一种新的确定方法[J].西安建筑科技大学学报,2008,40(4):589-592.
[13]雒瑶瑜,崔金杰,王春义,等.棉花叶片中棉酚和单宁含量与绿盲蝽抗性的关系[J].棉花学报,2012.24(3):279-283.
[14]刘 伟,薛超彬,张静静,等.单宁酸对甜菜夜蛾幼虫生长发育及酚氧化酶活性的抑制作用[J].植物资源与环境学报, 2010,(1): 32-37.
[15]王庆忠,王东方.侧柏叶总黄酮对槐蚜的杀虫活性研究[J].北方园艺,2013(2):101-103.
[16]赵惠燕,李东鸿,张改生,等.XZ系列杂种小麦对麦长管蚜抗性机制的研究[J].西北农林科技大学学报,2002.30(1):73-75.
[17]马晓乾,滑 莎,宋小双,等.模拟昆虫取食对红皮云杉幼苗根部酶活性的影响——根部中保护性酶和防御酶活性的变化情况[J]. 中南林业科技大学学报,2012,32(9):37-40.
[18]孙旺达.植物单宁化学[M].北京:中国林业出版社,1992.
[19]李 密,邹佳慧,何 振,等.湖南油茶林害虫群落组成及其物种多样性[J].中南林业科技大学学报,2013,33(5):11-15.
Correlation of inclusions contents of different Casuarina spp. strains and resistibility to Anoplophora chinensis
LIN Xiu-qin1,2, HUANG Jin-shui2, CAI Shou-ping2, KE Yu-zhu2, ZENG Li-qiong2, HE Xue-you2,CHEN Shun-li1, WU Hui-zhong3, LI Xiu-ming3
(1. Fujian Agriculture and Forestry University, Fuzhou 350002, Fujian, China; 2. Fujian Academy of Forestry, Fuzhou 350012, Fujian,China; 3.Chihu State-owned Forest Farm, Quanzhou 362100, Fujian, China)
Anoplophora chinensis(Forster) is main dangerous trunk borer to the coastal shelter-forest system ofCasuarinaspp.. For studying the relationship between the inclusions contents ofCasuarinaand damage caused byAnoplophora chinensis(Forster) and the insect resistance mechanism ofCasuarinaspp, seeking the most important resistance factor, the experiments were carried out in Chihu communal forests in Huian county. The representative resistance strains (Hui83, Hui76 and Hui13), the medium resistance strains(GuangdongA8-2, Hui 1 and Pingtan2), the susceptible strains (Putian20, Hui88 and Hui58) were chosen to measure their sapwood’s inclusions contents, and the multiple comparisons and grey correlation degree analysis were performed based on the contents of inclusions and the damages surveys of 48 strains in 2010~2012. The results show that on the whole, the higher resistance strains had the higher contents of total phenols, tannins and fl avones, and lower contents of soluble sugar; the gross protein’s and total sugar’s were random; the soluble sugar had the highest correlation with resistance, followed by total phenols, fl avones and tannins.
Casuarinaspp.; inclusions; insect resistance;Anoplophora chinensis(Forster)
S763.38
A
1673-923X(2014)05-0037-05
2013-05-31
国家科技支撑计划课题资助项目(2009BADB2B02);国家林业局南方山地用材林培育、福建省森林培育与林产品加工重点实验室资助项目
林秀琴(1986-),女,福建宁德人,硕士研究生,研究方向:林业有害生物综合控制技术研究
黄金水(1955-),男,福建莆田人,教授级高级工程师,硕士生导师,研究方向:林业有害生物综合控制技术研究与推广;
E-mail:hjs0591@126.com
[本文编校:吴毅]

