128层螺旋CT动态容积扫描对肝门部胆管癌的诊断价值
甘肃省金昌市中心医院影像科(甘肃 金昌 737100)
曹德生 王正芳 李兴胜赵 毓 吴玉辉
肝门部胆管癌指发生在胆囊管开口与左、右二级肝管起始部之间的恶性肿瘤,主要侵犯肝总管及其分叉部以上左、右肝管的胆管癌,在各类胆管癌中最常见、预后最差、处理最困难。Klatskin于1965年首次全面总结了该病的临床、病理特点,故又称Klatskin瘤[1,9]。肝门部解剖结构复杂,胆管、肝动脉、门静脉紧密毗邻,肝门部胆管癌具有沿淋巴管、神经、血管转移的生物学特性,故肝动脉、门静脉易受肿瘤侵犯,胆管及血管侵犯情况是决定肝门部胆管癌能否切除的最主要因素[2]。
1 材料与方法
1.1 一般资料 收集我院2011年1月至2013年2月经手术病理及临床综合诊断确诊的肝门部胆管癌12例,其中男7例,女5例。年龄42~78岁,平均62.4岁。12例患者经手术病理确诊4例,经临床综合诊断确诊8例。临床表现有:无痛性进行性黄疸、陶土色大便、皮肤瘙痒、腹胀、纳差、乏力、尿黄、进行性消瘦等。实验室检查全部12例患者均有血清总胆红素(TBIL)和直接胆红素(D-BIL)显著升高、碱性磷酸酶(ALP)升高,尿胆红素实验阳性。
1.2 检查方法 检查采用PHILIPS Brilliance 64排128层螺旋CT,扫描范围自膈顶至肾下极。造影剂用非离子型造影剂碘普罗胺注射液370(优维显,100ml∶76.89g),使用双筒注射器,首先用3.5ml/s注射速度注射生理盐水20ml,随后用3.0ml/s速度注入造影剂,总量75~100ml,随后用20ml生理盐水3.0ml/s速度冲洗,肘前静脉团注。动脉期应用对比剂跟踪法(bolustracking)获得,在腹主动脉层面选择感兴趣区监测,当感兴趣区内CT值达到180HU时,自动触发扫描,门静脉期(60s~70s),延时期(5min)。扫描参数:120KV,自动mAs,准直宽度5mm,床速5mm、螺距1.0连续扫描,重建层厚5mm、1mm,层距5mm、1mm。所有病例图像经薄层重建后传送至PHILIPS Extended Brilliance Workspace V 4.5.3.40140(EBW工作站)工作站进行实时多平面重建(MPR)、多平面容积重建(MPVR)及经过左右肝总管及病变中心线曲面重建(CPR)。
1.3 影像分析参考指标 根据肝门部胆管癌的生长方式及形态学特征,将肝门部胆管癌分为:(1)管壁浸润型,沿胆管走行方向浸润性生长的软组织影;(2)结节肿块型,肝门区不规则或类圆形结节状软组织肿块;(3)乳头状型:肝门区胆管腔的乳头状、息肉样结节。依据Bismuth提出的解剖定位分类法将肝门部胆管癌分为4型,Ⅰ型:肿瘤位于肝总管近段,未侵犯左右肝管汇合部;Ⅱ型:肿瘤侵犯肝总管及左右肝管汇合部;Ⅲ型分为两个亚型,ⅢA:肿瘤侵犯肝总管、左右肝管汇合部及右肝管;ⅢB型:肿瘤侵犯肝总管、左右肝管汇合部和左肝管;Ⅳ型:肿瘤同时侵犯肝总管、左右肝管汇合部及左右肝管[3]。美国纽约Memorial Sloan Kettering癌症中心提出的根据癌肿部位、范围及对门静脉是否受累、有无肝叶萎缩的T分期法,将肝门部胆管癌分为3期:T1为肿瘤侵及肝管汇合部和(或)单侧扩展至二级胆管;T2为肿瘤侵及肝管汇合部和(或)单侧扩展至二级胆管,同时合并同侧门静脉受累和(或)同侧肝叶萎缩;T3为肿瘤侵及肝管汇合部且双侧均扩展至二级胆管;或肿瘤单侧扩展至二级胆管,同时合并对侧门静脉受累;或肿瘤单侧扩展至二级胆管同时合并对侧肝叶萎缩;或肿瘤累及门静脉主干或双侧门静脉均受累[4]。
2 结 果
2.1 CT表现 本组12例患者均行128层CT容积平扫及动态容积增强扫描。12例患者均有不同程度肝内胆管树枝状扩张;6例(35.99%)表现为管壁浸润型:肝门部胆管壁环形增厚,管腔狭窄或中断,增强扫描动脉期轻度强化,门脉期及延时期增厚的胆管壁强化渐趋明显,其中1例(图1)表现为胆管腔明显狭窄,但胆管腔的延续性尚可分辨(图一黑箭),右肝管部分管壁受侵增厚并见强化(图一白箭),本例符合Bismuth-Corlette分型中ⅢA型表现,本例门静脉及肝动脉未见明确受侵征象,同时符合美国纽约Memorial Sloan Kettering癌症中心T分期法中的T1期表现,本例行外科手术,术中所见与MDCT(多层螺旋CT)表现基本相符;4例(33.33%)表现为结节肿块型:表现为肝门区不规则或类圆形结节状软组织肿块。本组中1例老年女性患者MDCT表现有肝门区不规则软组织肿块,左、右肝管均受累,后患者行ERCP造影后植入鼻胆管引流,我们尝试行鼻胆管造影下MDCT检查,随后运用PHILIPS的EBW工作站行3D表面遮盖法(SSD)重建及最大密度投影(MIP)重建技术,完整显示了扩张的胆管树及左、右肝管受侵狭窄情况(图2);另一例结节肿块型,MDCT表现有肝门区软组织肿块,胆囊管及胆囊颈部受侵,肝动脉右支局部管壁不规则,管腔狭窄,提示右肝动脉受侵(图3);另外一例肝门部肿块型,行多平面重组观察左、右肝管起始部有受侵表现,但行ERCP见病变只侵犯肝总管及汇合部,左、右肝管起始部连续光整,未见受侵征象,本例MDCT表现符合Bismuth-Corlette分型Ⅳ型,但ERCP符合Ⅱ型,虽然MDCT显示病变过度,但MDCT提示本例有门静脉右支受累及。此两例MDCT均提示有肝门区血管受侵表现,对于临床治疗方法选择上提供了重要参考。本组2例(16.67%)乳头状型:表现为肝门区胆管腔的乳头状、息肉样结节。行多层螺旋CT多平面重组后显示腔内结节更加直观、清晰。其中一例在工作站3D重建后清楚显示病变临近血管情况,运用多平台容积重建技术全面显示肝内胆管扩张情况(图4)。
2.2 病变临近结构的影像评估 多层螺旋CT(MDCT)除可清楚显示病变本身情况外,对于显示肝门部病变临近结构有更大优势,CT血管成像(CTA)可立体直观地显示肝动脉、门静脉及各分支有无肿瘤侵犯以及受侵血管的长度、范围,为评估肿瘤与临近管道的关系提供更精确的信息[2]。从而为临床治疗方式、方法的选择上提供重要的参考价值。
2.3 多层螺旋CT(MDCT)的优势 多层螺旋CT(MDCT)快速薄层扫描技术采集的数据可保证使用多平面重组(multiplanar reformation,MPR)、最大密度投影(maximum intensity projection,MIP)、曲面重组(curve planar reformation,C P R)及容积再现(v o l u m e rendering,VR)等后处理技术获得清晰的影像,精确显示细微解剖结构。经过VR处理,可容积再现胆道的三维影像,以最合适的角度多方位显示3~4级胆道树的的细微结构以及受累胆管的部位和管壁情况,也可很好地显示梗阻近侧扩张胆管的细节。结合不同扫描时相(动脉期、门脉期、延迟期)并利用MPR等后处理技术可同时评价胆道周围组织器官的结构,对胆道病变做出准确定位的较准确定性判断。除可显示胆管的扩张程度及具体的梗阻部位外,还可显示肝门区肿块的大小、形态及累及的范围。通过工作站的3D后处理,可直观地显示病变与临近结构的关系。PHILIPS64排128层螺旋CT机配备的EBW工作站的Inject涂色技术,利用扩张胆管与肝实质的密度差,也可直观显示扩张胆管的3D重组图像。MDCT的原始数据可反复用于不同重建算法、不同层厚的图像,也可利用原始数据重建出感兴趣区的薄层图像,而不必再次扫描,既减少了总的图像数量,又不至于漏掉微小病变,大大提高了病灶的显示功能。
3 讨 论
胆管癌占所有肝脏和胆道癌症的15%~25%,胆管癌的尸检发生率为0.01%~0.5%,约占所有癌症的3%。Klatskin于1965年首次全面总结了该病的临床、病理特点,故又称Klatskin瘤[5]。美国每年新增原发性肝胆管癌患者7500余例,其中2000~3000例是胆管癌,肝门部胆管癌约占2/3,男性略多于女性。英格兰和威尔士每年新发现的胆管癌中50%~60%是肝癌部胆管癌。目前我国尚无确切约计数字,但按人口比例及东方人胆道疾病比西方人发病率高的差异,我国肝门部胆管癌的年病例数肯定远远超过美国。由于肝门的解剖特殊性,肝门部胆管癌临床表现有其特殊之处,早期诊断较为困难。但近年来对其诊断在研究有了较大的进展[1]。
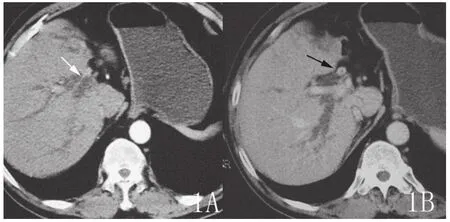
图1 右肝管部分管壁受侵增厚并见强化(白箭),肝门部胆管壁环形增厚并强化,管腔狭窄(黑箭)。
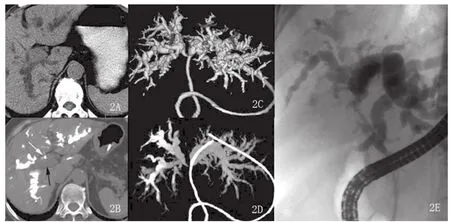
图2 A-E 女,77岁,结节肿块型。A.肝门部不规则软组织肿块影。B.鼻胆管造影下MDCT检查轴位图显示肝门部软组织肿块及肝内胆管扩张充盈造影剂。C-D.运用PHILIPS的EBW工作站行表面遮盖法(SSD)及最大密度投影(MIP)重建技术,完整显示了扩张的胆管树及左、右肝管受侵狭窄情况。E.同一患者的ERCP。
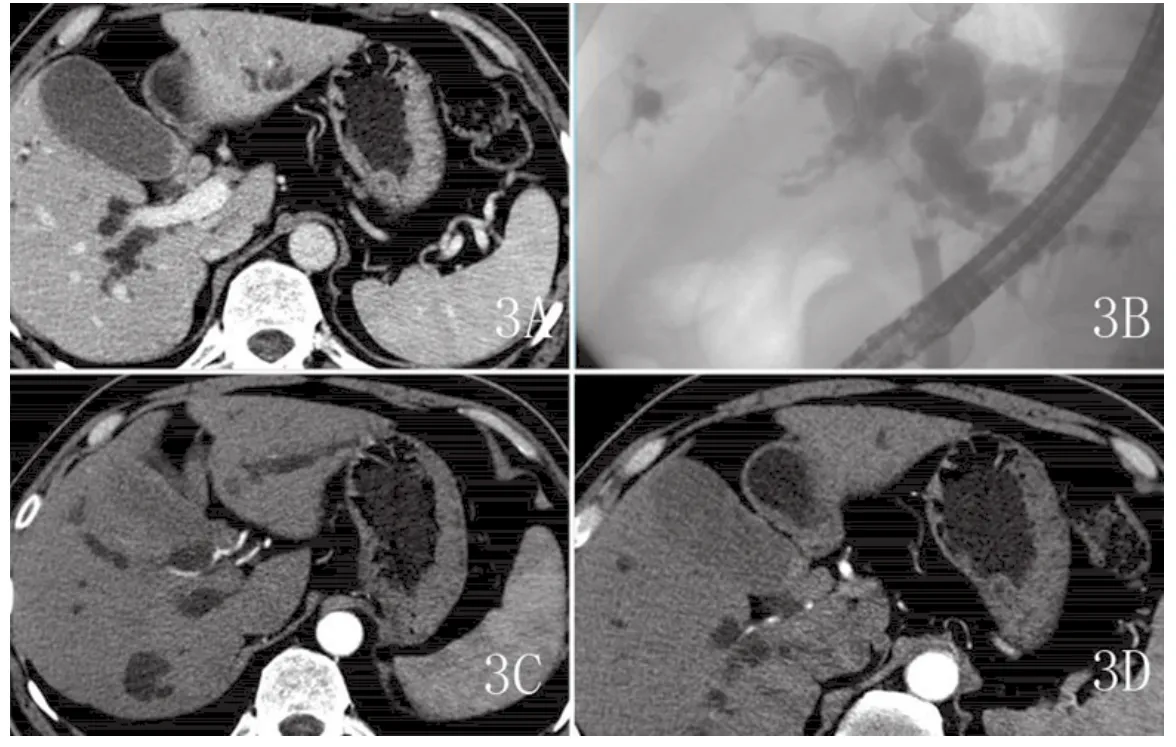
图3 A-D 男,61岁,结节肿块型。A.肝门部结节状软组织肿块影,胆囊颈部受侵,腔壁增厚,门静脉右支边缘光整,未见累及。B.ERCP显示的病变范围。C.肝动脉右支局部管壁不规则,管腔狭窄,提示右肝动脉受侵。D.连续层面观察进一步证实此例有胆囊颈部受侵。
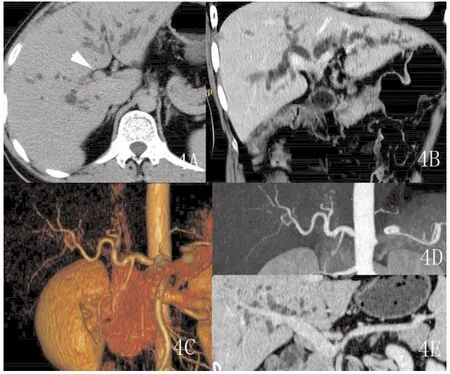
图4 A-E 男,42岁,A.肝门区胆管腔的息肉样结节(白箭头).B.多平面重组(MPR)斜冠状位重建,增加层厚至10mm,完整显示了肝内扩张胆管全貌及左、右肝管起始部狭窄。C-D.表面遮盖法(SSD)及最大密度投影(MIP)显示肝门部肝动脉完整未累及。E.经过肝门静脉及脾静脉中心线的曲面重组(CPR)显示门脉系统未见累及。
多层螺旋CT(MDCT)快速薄层扫描技术采集的数据可保证使用多平面重组(MPR)、最大密度投影(MIP)、曲面重组(CPR)及容积再现(VR)等后处理技术获得清晰的影像,精确显示细微解剖结构。经过VR处理,可容积再现胆道的三维影像,以最合适的角度多方位显示3~4级胆道树的的细微结构以及受累胆管的部位和管壁情况,也可很好地显示梗阻近侧扩张胆管的细节。结合不同扫描时相(动脉期、门脉期、延迟期)并利用MPR等后处理技术可同时评价胆道周围组织器官的结构,对胆道病变做出准确定位的较准确定性判断。早期胆管癌CT表现为管壁不规则增厚,同时伴有胆内外胆管不同程度的扩张;晚期主要表现为增强扫描后显示边缘不规则、密度增高的占位性病变,1~1.5mm的薄层扫描可获得类似解剖一样的细节,也可进行图像的三维重建,薄层CT扫描下的胆管造影可代替ERCP,是诊断小于1cm的胆门部胆管癌和评价胆、胰肿瘤可否切除的有用的检查手段[5]。以往文献报道,胆管细胞癌在CT增强扫描上常以延迟强化为其特征,被解释为对比剂从血管渗透入肿瘤间质所致。Uchida的研究也认为胆管癌肿块在增强早期(动脉期)呈低密度,门静脉期肿块密度逐渐增高即延迟强化是由于肝门部胆管癌多为乏血管肿瘤,而包绕腺腔的致密纤维基质潴留造影剂的时间较长,故在CT增强时动脉期往往呈现低密度或等密度,而在门静脉期或平衡期相对高密度,是肝门部胆管癌延迟强化的病理基础[6]。MDCT检查对于显示肝门部胆管癌肿块的部位、大小、密度、局部扩散、血管有无受侵犯、淋巴结及邻近器官是否受累,有无远处转移、胆管扩张程度及有无腹水等方面有着独到的优势。
术前常规分期研究发现大约有65%的肿瘤是可切除的。Aloia[7]的研究表现对照手术和病理结果,MDCT术前评估肝门部胆管癌可切除的敏感度为94%,不可切除的敏感度为79%,阳性和阴性预测值分别为92%和85%。原发肿瘤的完整切除为治愈胆管癌提供了惟一的希望,而且这也是该病患者长期生存的主要决定因素。肝门部发生的高位肿瘤手术切除比较困难,但生存的主要预测因素是肿瘤的组织学分期,而非其生长部位,肝切除技术上的进步使接受手术切除的病人比例有所提高。若想获得无瘤边界,常需要积极的外科治疗,包括全肝切除[5]。有研究报道指出肝门部胆管癌总的手术切除为10.1~25.0%。依据Bismuth-Corlette分型,四型胆管癌中的前三型均有手术切除的机会,而不能手术切除的原因主要有:(1)癌肿浸润性生长侵犯肝动脉和(或)门静脉,手术难于显露肝门部胆管;(2)肿瘤侵犯肝总管或在其管腔内生长,或伴有淋巴结肿大压迫肝总管,同时伴有他处转移者;(3)两侧肝管受累和多部位受累者;(4)患者年龄较大,全身一般情况较差者[8]。而MDCT对于肝门部胆管癌全面的影像学观察与分型,对估计预后及临床治疗方法、方式的选择具有重要的指导意义。
1.何小东.肝门部胆管癌的诊断现状[C].上海,2007胰胆疾病诊治论坛论文汇编,2007,50.
2.高文军.多层螺旋CT血管成像在肝门胆管癌可切除性评估中的应用[J].中国现代医生,2012,50:99.
3.Bismuth H , Nakache R,Diamond T.Management strategies in resection for hilary cholangiocarcinoma [J].Ann Surg,1992,215(1):31-38.
4.Van Gulik TM,Gouma DJ.Changing perspectives in assessment of respectability of hilar cholangiocarcinoma[J].Ann Surg Oncol,2007,14:1969-1971.
5.黄志强,主译.希夫肝脏病学[M].北京:化学工业出版社,2006.646-649.
6.Uchida M ,Ishibashi M,Arikawa S,etal.Highreso lutioncomputed tomographic angiography/compu tedtomogra phiccholangio graphyimge fusion of the hepatobiliary system [J].J Comput Assist Tomogr,2006,30(6):913-916.
7.Aloia TA ,Charnsangavej C,Faria S ,et al.High-resolution computed tomography accurately predicts resectability in hilar cholangiocarcinoma[J].Am J Surg,2007,193:702-706.
8.程红岩,贾雨辰,周岱云,等.肝门部胆管癌的影像分型及其与治疗的关系[J].中华放射学杂志,1996,30(4):235.
9.吴耀初,周伟文,陈俏倩,等.肝内周围型胆管细胞癌的CT动态增强扫描与病理基础[J].中国CT和MRI杂志,2013,11(03):8-10.
10.黄振健,徐建良,蔡庆,等.肝门部恶性胆道梗阻的MRI,MRCP诊断价值[J].中国CT和MRI杂志,2012,10(6):73-75.
11.范正军,吴阳.73例肝门部胆管癌诊疗体会[J].中国医刊,2000,12(3):26-27.
12.潘明,戴少登,万卷芳.探讨胆道双支架治疗肝门部胆管癌的临床疗效[J].中国中西医结合影像学杂志,2010,6(6):537-539.
13.左玉江,王丽伟,王冀锋.磁共振成像对肝门部胆管癌的诊断价值—附51例报告[J].罕少疾病杂志,2009,16(5):19-21.

