肛肠水囊填塞MR成像在肛瘘诊断中的价值
1.南京中医药大学附属南通中医院放射科
2.南通大学附属医院放射科
3.江苏省南通市中医院肛肠科(江苏 南京 226000)
刘灵灵1 陆锦贵1 陈 军1 顾红梅2 周玉杰3 袁旭钰3 赵爱明3
肛瘘又称“肛门直肠瘘”,是指肛门周围的肉芽肿性管道,其基本组成部分包括内口、瘘管以及外口,大部分由直肠肛管周围脓肿引起,克罗恩病、溃疡性结肠炎、盆腔炎、盆腔恶性肿瘤、放疗、外伤等也可引起。一般需通过手术治疗,而对内口、瘘管、外口及脓肿做出正确判断是手术成功的关键,对瘘管与肛门括约肌之间关系的正确评估是维护肛门正常控便功能的基础。本研究的目的在于评价自制肛肠水囊在肛瘘MRI诊断及分型中的价值,从而为治疗方案和术式选择提供必要的依据。
1 资料与方法
1.1 临床资料 对2013年9月~2014年3月期间在南通市中医院肛肠外科住院准备接受手术治疗的疑似肛瘘患者22例行磁共振检查,其中男性20例,女性2例,年龄15~67岁,平均35岁。22例患者均表现为肛旁肿痛伴流脓,部分患者伴有肛门坠胀,其中6例有肛瘘手术史,1例为臀部脂肪瘤术后。所有患者均无MRI检查禁忌症,检查前让患者及其家属充分了解检查过程,并签署知情同意书。所有患者于MRI检查后行肛瘘手术治疗。
1.2 检查方法 采用GE Signa HDxt 1.5T磁共振扫描仪,相控阵线圈,扫描序列包括横断位FSE T1WI和FRFSE T2WI,横断位、冠状位及矢状位脂肪抑制FRFSE T2WI。扫描参数为:T1WI TR 883ms,TE 7.2ms,层厚4mm,间隔0.5mm;T2WI TR 4350ms,TE 132ms,层厚4mm,间隔0.5mm;脂肪抑制T2WI TR 4916ms,TE 134ms,层厚4mm,间隔0.5mm。采集时间共需约40分钟。
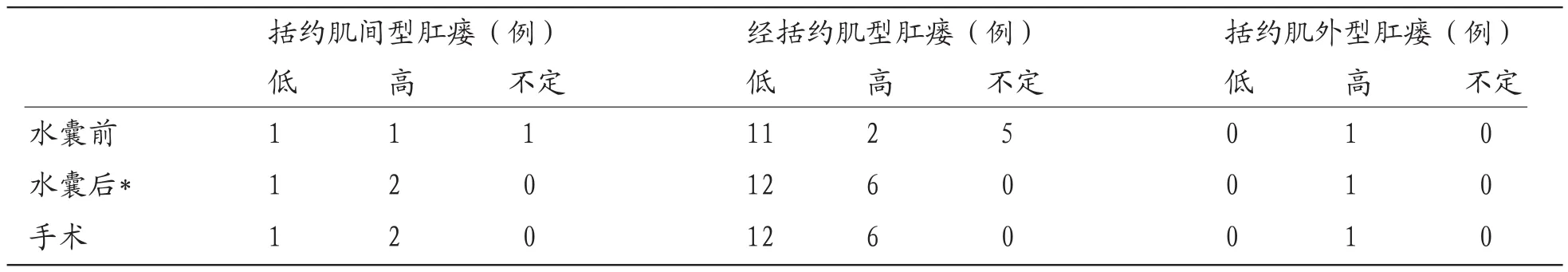
表1 放置水囊前后的Parks分类结果与手术对照
扫描前准备:①肠道无需特别准备。②制作可调节水囊(图1)。材料包括塑料管、乳胶套、0.9%生理盐水、绳子等。将塑料管置于乳胶套顶部,自顶部向下数厘米处用绳子结扎,注入0.9%生理盐水约60~70ml后水囊扩开呈圆柱型,然后夹闭塑料管末端,观察有无生理盐水漏出,如无漏出,则排出水囊内液体备用。注意绳子必须扎紧,以防止水从乳胶套与塑料肛管间流出。③患者检查体位为俯卧位。准备完毕后,先用上述序列和参数对未放置肛肠水囊的患者行MR扫描;扫描完毕后,经肛门轻轻插入水囊,其内注入60~70ml生理盐水制成肛管直肠塑形水囊,并根据患者情况适当调整注水量(±10ml),接着使用相同的序列和参数进行重复扫描。
内口位置参照截石位定位法,12点位于前方会阴部,6点位于肛管后正中处,3点位于肛管左侧,9位于肛管右侧。
本研究以Parks分型为主要依据,并结合瘘管末端位置分为高位、低位肛瘘,按瘘口和瘘管多少分为单纯性、复杂性肛瘘。单纯性肛瘘只有一个瘘管;复杂性肛瘘有多个瘘口和瘘管。本研究将内、外口间跨度范围最长的瘘管定为主瘘管,从主瘘管发出的短小分支为支管。支管可以为1条或几条,与内口或外口相连,或者不相连。
2 结 果
2.1 肛瘘MR表现 瘘管在T1WI上均表现为低信号,T2WI及脂肪抑制T2WI像上为高信号,部分患者的瘘管周围出现低信号纤维组织。MRI显示内口20个,其中14个位于齿状线6点及附近(包括5点及7点方向);2个位于9点方向,2个位于12点方向,1点及3点方向各1个。以发生于齿状线6点及附近者最多。T1WI上内口呈稍高信号、低信号、及等信号伴边缘低信号环,脂肪抑制T2WI上内口表现为点状高信号影与瘘管相连。外口表现为瘘管延续至皮肤表面的异常信号,与瘘管信号相似,本组中1例肛瘘患者最多出现3个外口(图4)。肛周脓肿及感染均表现为T1WI低信号、T2WI及及脂肪抑制T2WI高信号影,脓肿较局限呈卵圆形、条状及马蹄形,而肛周感染呈片状。
2.2 水囊放置前后MRI对肛瘘显示情况比较
2.2.1 对主瘘管、支管及内外口显示的比较:本组22例患者共有26个内口,22条主瘘管,16条支管,23个外口,8例伴肛周脓肿或感染。放置水囊前MR显示内口20个,主瘘管22条,支管16条,外口21个;放置水囊后,显示内口18个,所显示的主瘘管、支管及外口数与放置水囊前相同。与手术对照,放置水囊前后MRI上内口的显示率分别为76.9%(20/26),69.2%(18/26),两者之间差异无统计学意义(χ2=0.74,P>0.05);主瘘管、支管及外口数与放置水囊前相同,分别为100%(22/22),100%(16/16),91.3%(21/23)。
2.2.2 对瘘管末端位置判断的比较:本组38条瘘管(包括主瘘管及支管)中,17条位于环上,21条位于环下。在使用水囊前,MR显示10个位于环上,20个位于环下,8个无法辨别瘘管末端位置;放置水囊后MR正确判断17条环上瘘管、21条环下瘘管。χ2检验显示使用水囊前后MR对瘘管末端位置的判断差异具有统计学意义(χ2=6.85,P<0.05)。
2.2.3 水囊使用前后对瘘管分类的比较
2.2.3.1 对单纯性或复杂性肛瘘判断的比较:本组22例肛瘘病变,单纯性肛瘘11例(图5-8),复杂性肛瘘11例(图2-4、9、10)。在使用水囊前,无法确定瘘管末端位置的6例患者中5例为复杂性肛瘘,仅1例为单纯性肛瘘。放置水囊后,这6例均能明确诊断。水囊放置后复杂性肛瘘瘘管末端位置的显示率明显提高。
2.2.3.2 对Parks分类的比较:22例患者中,18例为经括约肌型,占81.8%(图2-4、9、10),3例为括约肌间型,占13.6%(图5-8),1例为括约肌外型,占4.6%。
使用水囊前,MR显示2例括约肌间型肛瘘(低位和高位各1例),13例经括约肌型肛瘘(低位11例、高位2例),1例括约肌外型肛瘘,6例无法确定。放置水囊后,显示2例高位括约肌间型肛瘘,18例经括约肌型肛瘘(低位12例,高位6例),括约肌外型肛瘘仍为1例。对照手术结果,使用水囊前后MRI对肛瘘分类的正确率分别为72.7%(16/22)和100%(22/22),两者间差异具有统计学意义(χ2=4.82,P<0.05)(表1)。
3 讨 论
3.1 肛瘘病因及特征 肛瘘是一种常见的肛肠科疾病,每年患病率约10/10万[1,2],且好发于男性,这可能与男性肛腺发达有关。
肛瘘根据病因分为原发性肛瘘及继发性肛瘘。原发性肛瘘约占70~80%,多起源于隐窝腺化脓感染,其反复发作并向周围扩散可形成肛管或直肠周围脓肿,进而引起坐骨直肠窝或坐骨肛门窝脓肿,脓肿切开或自行溃破后长期不愈而形成瘘管。瘘管中的脓性分泌物由外口流出,较大的高位肛瘘可有粪便及气体排出,当外口闭合则肿痛明显,继而破溃流脓,反复发作。通过传统的手术治疗其复发率在25%以上[3]。而对内口、主瘘管、支管、外口及脓肿做出正确判断是手术成功的关键,对瘘管与肛门括约肌之间关系的正确评估是维护肛门正常控便功能的基础。所以,术前除了内口、主瘘管、支管、外口及脓肿等情况进行准确评估外,对肛瘘进行准确分型也同样重要。
MRI软组织分辨率高,可以获得轴位、冠状位及矢状位图像,清楚显示瘘管与括约肌复合体之间的关系,并能准确分辨活动性瘘管与瘢痕。因此,MRI已经成为肛瘘术前检查的金标准[4-6]。
3.2 肛瘘MR表现及分类结果肛瘘由瘘管、内口及外口组成,内口是肛瘘感染的门户,肛瘘内口未正确处理易导致术后复发,确定肛瘘内口对临床而言十分重要[7]。临床上,内口大多数发生在肛门截石位6点处,本研究与临床结果一致,内口多发生于齿状线6点及其附近。根据这一发病规律,MRI图像上寻找内口时应把重点放在肛门后方6点位及附近肛隐窝处。内口在T1WI呈稍高信号、低信号或等信号伴边缘低信号环,当内口表现为中等信号时,与周围等信号的括约肌、提肛肌等无法区分;T2WI及抑脂像表现为肛管壁内高信号影与瘘管相连,以T2WI抑脂像最佳。通常肛管括约肌上型肛瘘内口位于肛管,而括约肌外型肛瘘内口位于直肠。放置水囊后内口的显示略差,分析其原因可能与扩张的水囊压迫临近的内口而未能显示有关。
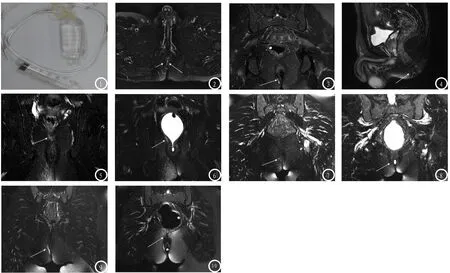
图1 为注水后照片,水囊充盈呈圆柱状。图2-4 男,38岁,肛旁肿痛伴流脓1个月,低位 复杂型 经括约肌肛瘘,内口2个,外口3个。图7为横断面T2WI抑脂像内口2个,分别位于截石位6点、7点,6点处内口与主瘘管相连(长箭),7点处内口与支管相连(短箭)。图8冠状面T2WI抑脂像,放置球囊后显示瘘管呈高信号,瘘管末端位于肛管直肠环以下,瘘管壁呈低信号。图9矢状面T2WI抑脂像显示外口3个,位于皮下。图5、6 男,24岁,右侧肛周肿痛、间断排出脓性分泌物,高位 单纯型 括约肌间型肛瘘。图1、2冠状面T2WI抑脂像,图1显示瘘管末端位于肛管直肠环附近,图2放置球囊后显示瘘管末端位于肛管直肠环以上,右侧肛周感染呈片状高信号。图7、8 男,55岁,肛周坠痛伴便血1周,低位 单纯性 括约肌间型肛瘘。图3、图4冠状面T2WI抑脂像,内口呈点状高信号,瘘管末端(内口)位于肛管直肠环以下。图9、10 女,34岁,女,肛旁肿痛伴流脓,高位 复杂型 经括约肌型肛瘘。图5冠状面T2WI抑脂像显示主瘘管呈高信号,但不能确定瘘管末端位置。图6冠状面T2WI抑脂像,放置球囊后显示瘘管末端位于肛管直肠环以上。
肛瘘的内外口之间为主管,从主管上发出的细小分支为支管,支管可以是1条或多条,可以与内口或外口相连,或不相连而形成盲端。活动性的瘘管内含有脓液及肉芽组织,在T1WI表现为低信号,T2WI及T2WI抑脂像上为高信号,以抑脂像为佳。肛瘘反复发作,瘘管壁增厚,因含纤维成分于各个序列上均为低信号。对于肛瘘再手术者,MRI可对瘢痕与活动性瘘道进行鉴别,瘢痕组织及术后纤维化在T1WI和T2WI抑脂像上均呈低信号;活动性病变在T1WI表现为低信号,T2WI抑脂像上呈高信号[8]。外口为主瘘管或支管延续至皮肤表面,信号与瘘管信号一致。
本研究依据瘘管的走向与括约肌的位置关系分类(即Parks分型[9]),将肛瘘分为4型:①肛管括约肌间型,瘘管位于肛门内、外括约肌之间,约占60%~70%。②经肛管括约肌型:瘘管穿过肛门外括约肌、坐骨直肠间隙开口于肛门周围皮肤上,约占20%~30%。③肛管括约肌上型:瘘管在括约肌间上行,越过耻骨直肠肌后下行经坐骨直肠间隙穿透肛周皮肤约,占4%。④肛管括约肌外型:瘘管自会阴部皮肤向上经坐骨直肠间隙和肛提肌,然后穿入盆腔或直肠,仅占1%。若瘘管完全局限于外括约肌内侧,则为括约肌间型;若瘘管出现在坐骨直肠窝中,则为非括约肌间型肛瘘。本组22例患者中,以经括约肌型肛瘘最多,约占81.8%,括约肌间型较少,约占13.6%,括约肌外型仅占4.6%,括约肌上型未发现。
因临床医师通常根据瘘管与肛管直肠环的关系采用不同的治疗方案,因此本研究同时按照瘘管的末端位置对Parks分型进行补充分级。这一补充突出了肛管直肠环的重要性,肛管直肠环是由肛门外括约肌的浅部和深部、直肠下份的纵行肌、肛门内括约肌以及肛提肌等共同构成的围绕肛管的强大肌环。此环对肛管起着极为重要的扩约作用,术中如不慎将肛管直肠环结构损伤,则会引起患者部分或完全的大便失禁[10]。本次研究以肛管直肠环为标准将肛瘘高位及低位分级。为了间接显示肛管直肠环,笔者向水囊内注入60~70ml生理盐水来撑开直肠及肛管,肛管直肠环上方肠管被水囊扩开呈囊状,环及环下的肛管由于括约肌的作用而呈管状。因此放置该水囊后行MR检查,可以明确环上及环下的瘘管末端位置。瘘管末端位于肛管直肠以下者为低位肛瘘,位于肛管直肠环以上者为高位肛瘘。将Parks分型中的①、②型分为高位或低位肛瘘;由于③型和④型瘘管分别越过耻骨直肠肌及肛提肌,瘘管末端位于环上,故为高位肛瘘。本研究发现在使用水囊前有6例患者不能确定瘘管末端位置,主要因为这些末端在肛管直肠环附近。使用水囊后,上述6例中,5例位于环上,1例位于环下,诊断符合率达到100%。
Sangwan等[11]发现单纯性肛瘘患者术后的复发率为6.5%,而复杂性肛瘘术后复发率更高。因此,影像诊断中区分单纯性及复杂性肛瘘同样重要。本组22例肛瘘病变,其中单纯性及复杂性肛瘘各11例。在使用水囊前,无法确定瘘管末端位置的6例患者中5例为复杂性肛瘘,仅1例为单纯性肛瘘。放置水囊后,这6例均能明确诊断。因此,水囊的放置使肛瘘、特别是复杂性肛瘘瘘管末端位置的显示率明显提高。
一些国内外的肛瘘MRI研究[12,13]依据Parks分型对肛瘘病变进行了准确分型,然而此类研究没有对瘘管末端位置做进一步研究,不能区分高位以及低位肛瘘。Mahgoubi等[14]进行的MRI研究虽然对经括约肌型肛瘘进行了高位及低位分型,但其分型是以齿状线为标准,而齿状线在MRI上不能直接或者间接观察到。
本研究不但使用了Parks分型、瘘管复杂程度分型,还补充了以肛管直肠环为标准的高位及低位分级,我们认为水囊的放置使肛瘘分型更为准确。
本次研究存在的不足:首先,由于本研究为回顾性研究,所以受试者均经过临床筛选,作为研究样本会出现选择偏倚。其次,本次入组的样本量较少。
综上所述,本研究认为,MRI具有很高的软组织分辨率,平扫检查能较准确的显示肛瘘病变,结合水囊成像能更好的显示瘘管的末端位置,使肛瘘分级更准确,从而指导临床拟定合理的治疗方案。
1.Morris J,Spencer JA.Ambrose NS.MR imaging classification of perianal fistulas and its implications for patient management[J].Radiographics,2000,20 (3)623-637.
2.Schwartz DA,Pembert on JH,Sandborn?WJ.Diagnosis and treatment of perianal fistulas in Crohn’s disease[J].Ann Intern Med,2001,135(10):906-918.
3.Quah HM, Tang CL, Eu KW, et al.Meta-analysis of randomized clinical trials comparing drainage alone vs primary sphincter-cutting procedures for anorectal abscess fistula[J].Int J Colorectal Dis.2006,21(6):602-609.
4.Lunniss PJ.Magnedic resonance imagine of fistula-in-ano.Dis colon Rectum,1994,37:708.
5.Steve Halligan.Imaging offistulain Ano.Radiology.2006,239:18-33.
6.蔡香然,孟悛非,张中伟等.肛瘘的高分辨MRI表现[J].2007,41(7):712-715.
7.卓仕旺,郑泽龄.MRI在肛瘘中的临床应用[J].中国中西医结合影像学杂志,2011,9(4):361-363.
8.Al-Khawari HA, Gupta R,Sinan TS, et al.Role of magnetic resonance imaging in the assessment of perianal fistulas[J].Med Princ Pract,2005,14(1),46-52.
9.Parks AG,Gordon PH,Hardcastle JD.Aclassification of fistuloin-ano.Br J Surg 1976,63:1-12.
10.Halligan S, Stoker J.Imaging offistulainano[J].Radiology,2006,239:18-33.
11.Sangwan YP,Rosen L,Riether RD.Is simple fistula-inano simple?[J].Dis Colon Rectum.1994,37:885-888.
12.Khera PS,Badawi HA,Afifi AH.MRI in perianal fistulae.[J].Indian J Radiol Imaging.2010,20(1):53-57.
13.许亚晔,陈学发,李秀娟,等.肛瘘的MRI诊断70例分析[J].中国医药指南,2011,9(33):242-244.
14.Mahgoubi B,Kharazi HH,Mirzaei R,et al.Diagnostic accuracy of body coil MRI in describing the characteristics of perianal fistulas[J].Corectal Dis,2006,8:202-207.
15.张旭升,何锡华,郑晓林,等.磁共振成像对肛瘘及其分型的诊断价值[J].中国CT和MRI杂志,2013,11(3):33-35.
16.卓仕旺,郑泽铃.MRI在肛瘘中的临床应用[J].中国中西医结合影像学杂志,2011,9(4):361-363.

