P-糖蛋白1对宫颈癌化疗耐药的影响及机制
,(.南华大学附属第一医院妇产科,湖南 衡阳 400;.南华大学生命科学研究中心)
P-糖蛋白1对宫颈癌化疗耐药的影响及机制
童文娟1,孙少卫2
(1.南华大学附属第一医院妇产科,湖南 衡阳 421001;2.南华大学生命科学研究中心)
目的探讨P-糖蛋白1(P-gP)在宫颈癌细胞对依托泊苷耐药中的作用机制。方法观察不同分期宫颈癌组织和慢性宫颈炎组织中P-gP的表达差异。取Hela细胞分别用azithromycin和cyclosporine A处理6 h后,再与依托泊苷孵育不同时间,高效液相色谱(HPLC)检测细胞内依托泊苷含量。将Hela细胞培养于培养皿或transwell小室中,用依托泊苷处理30 min,再分别与azithromycin和cyclosporine共孵育,检测transwell下室培养液中依托泊苷含量,同时检测各组细胞凋亡情况及凋亡相关因子Bcl-2和Bax的表达水平。结果P-gP在宫颈癌组织中表达显著高于宫颈炎组织。azithromycin可增强依托泊苷对Hela细胞的损伤作用,并呈浓度依赖性地上调Bax表达,降低Bcl-2水平,而cyclosporine A则对Hela细胞有保护作用。Transwell培养实验发现,azithromycin增加Hela细胞层对依托泊苷的通透性,而cyclosporine A则降低其通透性。结论P-gP促使Hela细胞泵出依托泊苷,减轻细胞损伤,因此介导了宫颈癌对依托泊苷的耐药性。
P-糖蛋白1; 宫颈癌; 依托泊苷; Hela细胞
宫颈癌是女性常见的肿瘤之一,其死亡率居中国恶性肿瘤死亡率第4位,女性癌症病死率第2位,女性生殖器肿瘤病死率的第1位[1]。近年来,随着宫颈癌普查普治的开展,其病死率有所下降,但预后仍不尽人意,多药耐药是化疗失败的主要原因。依托泊苷(etoposide)为细胞周期特异性抗肿瘤药物,作用于DNA拓扑异构酶Ⅱ(Type II topoisomerase),形成药物-酶-DNA稳定的可逆性复合物,阻碍DNA修复,导致DNA链断裂[2]。由于肿瘤细胞分裂比正常细胞快,对DNA拓扑异构酶Ⅱ的依赖性更大,因此可促进肿瘤细胞凋亡。依托泊苷常作为抗肿瘤药用于肺癌、睾丸癌、淋巴瘤,淋巴细胞白血病等的治疗[3],但是单用于宫颈癌的化疗效果并不明显,具体机制还不清楚。P-糖蛋白1(P-glycoprotein 1,P-gP),又名ATP结合盒蛋白B亚家族成员11(ATP-binding cassette,sub-family B 1,ABCB1),是一种分子量170 kDa的跨膜糖蛋白,它具有能量依赖性“药泵”功能。P-gP既能与药物结合,又能与ATP结合,利用ATP供能将细胞内药物泵出细胞外,减低了细胞内的药物浓度使细胞产生耐药性,它介导了多种肿瘤细胞的化疗耐药性。本文探讨P-gP是否参与了宫颈癌细胞对依托泊苷的耐受性及其耐药机制。
1 材料与方法
1.1 材料
所用到的组织样本来自南华大学附属第一医院妇产科,选择2011年1月~2013年8月收住院行手术治疗的宫颈癌患者,术前均无化疗、放疗及其他治疗史,所有患者不合并其他炎症性疾病,患者首次入院后按国际妇产科联盟2009年的标准确定宫颈癌的临床分期。根据病理检查结果将研究对象分三组,分别为宫颈癌II级(中分化鳞癌,非角化性大细胞型)、宫颈癌III级(低分化鳞癌,小细胞型)和子宫肌瘤合并慢性宫颈炎。选取宫颈癌II级和宫颈癌III级患者各40例,患者中位年龄52岁(31~69岁)。选择同期因子宫肌瘤合并慢性宫颈炎行全子宫切除术的患者40例作为对照,年龄40~66岁,中位数年龄52岁,均经病理检查确诊。所有患者均为中国汉族人,无亲缘关系,并签署知情同意书。收集上述患者术后宫颈病变组织,-70 ℃保存。人宫颈癌Hela细胞购自中国科学院上海细胞库。兔抗Bax一抗和兔抗Bcl-2一抗及羊抗兔二抗购自美国Santa Cruz公司。
1.2 免疫组织化学染色
采用免疫组化链菌素亲生物素——过氧化酶连接法(Streptavidin-Peroxidase assay,S-P assay),S-P即用型试剂盒及即用型抗P-gP单克隆抗体均购自福州迈新公司。将保存的癌组织和慢性宫颈炎组织自然解冻,所有标本均经体积分数10%的中性福尔马林溶液固定,石蜡包埋,4 μm连续切片,常规脱蜡、水化后,进行高温高压抗原修复,其它步骤按说明书进行。以PBS代替一抗作为阴性对照。DAB显色,苏木素复染,中性树胶封片。
1.3 细胞培养
人宫颈癌Hela细胞培养环境为37 ℃、5% CO2,Hela细胞培养于含体积分数为10%胎牛血清、100 U/mL青霉素和100 U/mL链霉素的DMEM完全培养基中。Transwell系统细胞培养将Hela细胞以2×105/孔的密度种植到transwell内培养套皿上(胶原包被的孔径为0.4 μm的可渗透膜),培养4天后可形成紧密细胞层用于实验[4]。
1.4 高效液相色谱(High-performance liquid chromatography,HPLC)检测细胞内和培养基中依托泊苷含量
利用MTT(3-[4,5-dimethylthiazol-2-yl]-2,5 diphenyl tetrazolium bromide,MTT)实验确定依托泊苷处理后细胞存活率能达到80%时的最低浓度,以此浓度用于后续实验。观察azithromycin(5 mg/L) 或cyclosporine A (0.05 μmol/L) 处理后对Hela细胞内依托泊苷含量的影响。实验3组:对照组直接用10 μmol/L依托泊苷处理;azithromycin组先用azithromycin处理细胞6 h后,换10 μmol/L依托泊苷继续孵育;cyclosporine A组先用cyclosporine A处理细胞6 h后,换10 μmol/L依托泊苷继续孵育,分别于0、30 min、1 h、3 h、6 h根据陆基宗等[5]文献中方法测定依托泊苷含量。待细胞处理结束后,弃去培养基,PBS洗3遍,加入0.1 mol/L NaOH 500 μL,反复冻融3次裂解细胞,8 000×g离心10 min,留上清进行细胞内依托泊苷含量检测,BCA试剂定量蛋白后,以200 μL最低浓度组的蛋白量为各组蛋白量标准,其他各组补齐体积至200 μL,7.2%三氯乙酸沉淀蛋白,以苯妥英钠为内标并作标准曲线测定细胞内依托泊苷含量。
将Hela细胞培养于transwell套皿中并形成紧密细胞层,根据处理因素不同将实验分为四组,分别为空白组、对照组、azithromycin组和cyclosporine A组。空白组未作任何处理,在对照组、azithromycin组和cyclosporine A组加入终浓度为10 μmol/L的依托泊苷使细胞摄取依托泊苷,孵育30 min后分别在azithromycin组和cyclosporine A组上层套皿中加入azithromycin或cyclosporine A,继续孵育12 h,取套皿下层培养基检测依托泊苷含量。直接从transwell培养体系中取200 μL培养基用于细胞外依托泊苷含量检测。在200 μL待测液中加入苯妥英钠至终浓度40 μg/mL,加1 mol/L HCL 0.1 mL混匀,再加氯仿(内含8%异丙醇)2.5 mL,振荡3 min,8 000 rpm离心10 min,取出下层,于45 ℃水浴中用氮气流吹干,加200 μL流动相复溶,进样。
1.5 MTT法测定细胞活性
向96孔板分别加入100 μL 新鲜的DMEM 培养基,加入依托泊苷使终浓度分别为5、10、20、40、80 μmol/L,对照组加入等体积的DMEM培养基。药物作用24 h 后,加入MTT 储存液( 5 mg/ mL) 10 μL/ 孔。37 ℃、5% CO2培养箱中孵育4 h。弃掉各孔内培养液,加入二甲基亚砜 100 μL/ 孔,振荡器振荡5 min 至细胞内和周围的颗粒充分溶解,室温放置数分钟,用全自动酶标仪测定每孔吸光度值(490 nm) 。取3孔平均值计算细胞存活率。
1.6 Western blot
将Hela细胞分为四组,分别为空白组、对照组、azithromycin组和cyclosporine A组。在对照组、azithromycin组和cyclosporine A组Hela细胞中加入10 μmol/L依托泊苷处理30 min后,将azithromycin组和cyclosporine A组Hela细胞分别用azithromycin或cyclosporine A继续孵育24 h,检测各组细胞凋亡情况及凋亡相关因子Bcl-2和Bax的表达水平。在处理后的细胞中加入三去污剂裂解缓冲液进行细胞裂解,于4 ℃离心10 min,弃除沉淀。BCA法进行蛋白质定量,取70 μg蛋白质用于聚丙烯酰胺凝胶电泳,转PDVF膜,封闭液封闭2 h,按1∶1 000加入一抗,4 ℃孵育过夜,TBST洗3次,按1∶1000的稀释倍数加入辣根过氧化物酶标记二抗,室温孵育1 h,TBST洗3次,暗室显影,结果用凝胶成像分析系统分析,以目的蛋白带与β-actin灰度值的比值进行比较和半定量分析。
1.7 统计学处理
2 结 果
2.1 P-gP在宫颈癌和宫颈炎组织中的表达差异
80例宫颈癌组织中,P-gP染色阳性18例,阳性率为22.5 %,40例宫颈炎组织中,P-gP染色阳性3例,阳性率为7.5 %(图1),P-gP在宫颈癌中阳性比例明显高于宫颈炎(P<0.05),并且P-gP在晚期肿瘤组织中比早期肿瘤表达量更多。

图1 免疫组化检测宫颈癌和宫颈炎组织中P-gP的表达(SP×20) A:宫颈癌(II级)组织;B:宫颈癌(III级)组织;C:子宫肌瘤合并慢性宫颈炎组织
2.2 P-gP对Hela细胞内依托泊苷含量的影响
经MTT实验观察到依托泊苷浓度为10 μmol/L时,细胞存活率仍可达到80%,因此使用此浓度用于后续实验。先用azithromycin (5 mg/L) 或cyclosporine A (0.05 μmol/L) 处理细胞6 h,加入终浓度为10 μmol/L的依托泊苷继续培养,分别于0、30 min、1 h、3 h、6 h检测细胞内依托泊苷含量。发现30 min、1 h时细胞内依托泊苷含量没有明显差异,随着时间延长,azithromycin组和对照组细胞内依托泊苷含量逐渐下降(图2),cyclosporine A组细胞内依托泊苷含量变化较小(P<0.05)。P-gP对Hela细胞摄取依托泊苷的过程影响较小,后期细胞内依托泊苷含量的减少可能是由于细胞排出依托泊苷所致。
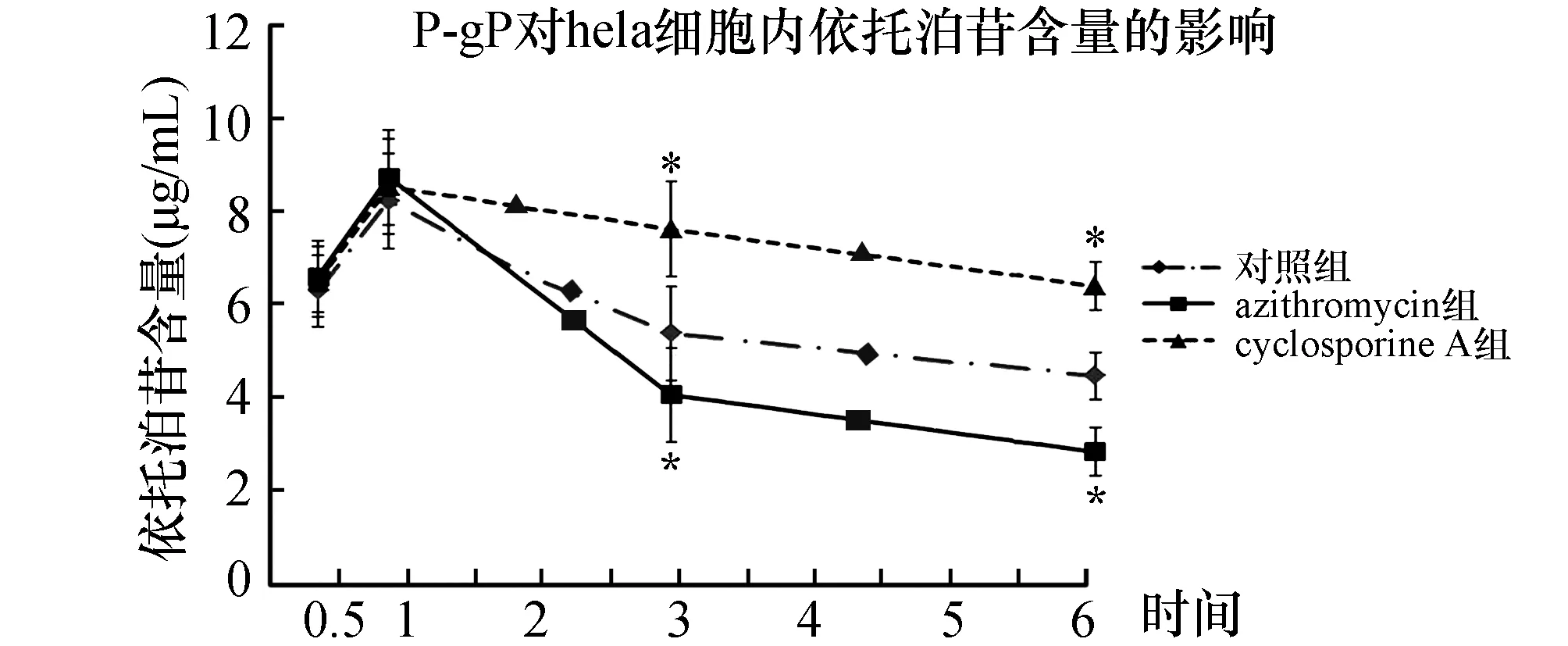
图2 P-gP激活剂和抑制剂对Hela细胞内依托泊苷含量的影响 与对照组比较,*:P<0.05
2.3 P-gP对Hela细胞排出依托泊苷的能力的影响
将Hela细胞培养于transwell套皿中并形成紧密细胞层,加入终浓度为10 μmol/L的依托泊苷使细胞摄取依托泊苷,孵育30 min后分别加入azithromycin或cyclosporine A,继续孵育12 h,取套皿下层培养基检测依托泊苷含量。结果显示,对照组套皿下层培养基中依托泊苷含量为加入的依托泊苷总量的43%,用P-gP激活剂azithromycin处理后,依托泊苷透过Hela细胞层的量增加至62%,而经P-gP抑制剂cyclosporine A处理则抑制依托泊苷通过Hela细胞层。
2.4 P-gP对依托泊苷促凋亡作用的影响及其对凋亡相关蛋白表达的调节
在对照组、azithromycin组和cyclosporine A组Hela细胞中加入10 μmol/L依托泊苷处理30 min后,将azithromycin组和cyclosporine A组Hela细胞分别用azithromycin或cyclosporine A继续孵育24 h,检测各组细胞凋亡情况及凋亡相关因子Bcl-2和Bax的表达水平。结果显示,依托泊苷导致Hela细胞凋亡发生,cyclosporine A进一步促进凋亡,而cyclosporine A能拮抗依托泊苷所导致的细胞凋亡(图3)。同时发现cyclosporine A处理后,凋亡相关基因Bax表达上调,而抗凋亡因子Bcl-2表达降低,azithromycin的作用正好相反(图4)。
3 讨 论
宫颈癌是最常见的女性肿瘤死亡原因之一[6]。宫颈癌常规的治疗方法是手术、放疗或者两者结合应用,虽然近10余年来手术技巧、放疗设备和技术在不断改进,但宫颈癌的治疗效果并无根本性提高。5年生存率停留在40%左右[7]。近年来,宫颈癌发病年龄趋于年轻化,年轻患者对保留卵巢及性功能的要求也较高,更倾向于接受化疗。由于宫颈癌对化疗不敏感,尤其是宫颈鳞癌属于对化疗相对不敏感的肿瘤,化疗仅用于晚期与复发患者的姑息治疗[8]。肿瘤化疗失败的主要原因是细胞耐药的产生。细胞耐药既是正常细胞维持自身稳定的防御机制之一,也是引起肿瘤化疗失败及肿瘤复发的主要原因。易使肿瘤细胞产生多药耐药的药物多为天然的分子量较大的亲脂性药物,如蒽环类、长春花碱类、鬼臼类、紫杉烷类等。肿瘤多药耐药的机制十分广泛,P-gP是耐药相关机制研究最早最深入的机制之一[9-10]。它于1976 年首先在对秋水仙碱耐药的中国仓鼠卵巢癌细胞上分离出来[11]。P-gP 是ATP 结合盒式结构超家族成员,具有ATP 依赖性的药物外排泵功能,能将药物泵出细胞膜外而降低胞内药物浓度[12]。P-gP的表达与肿瘤的耐药及预后密切相关,有研究者提出,膀胱癌患者P-gP表达与阿霉素耐药明显相关,且化疗后残留肿瘤的P-gP表达比未经治疗的肿瘤高5.7倍[13]。而晚期鼻咽癌患者P-gP阳性者,则预示全身化疗后总生存率较低[14]。

图3 P-gP激活剂和抑制剂对依托泊苷介导的细胞凋亡的影响 1:空白组;2:对照组;3:azithromycin组;4:cyclosporine A组.与control组比较,*:P<0.05

图4 P-gP激活剂和抑制剂对Hela细胞内凋亡相关因子表达的影响 1:空白组;2:对照组;3:azithromycin组;4:cyclosporine A组
本文P-gP在宫颈癌组织中表达显著高于宫颈炎组织,并且其表达水平与癌组织的分期密切相关。说明P-gP可能是宫颈癌产生化疗耐药的分子机制之一。实验中利用鬼臼类抗肿瘤药依托泊苷来探讨宫颈癌细胞化疗耐药的分子机制,发现将Hela细胞与依托泊苷共孵育短时间内可增加细胞内药物含量,抑制或增强P-gP活性并不影响此过程,提示P-gP并不影响依托泊苷的摄入过程,但是随着时间的延长,细胞内药物含量逐渐下降,当抑制P-gP作用时,可维持细胞内药物浓度,通过transwell培养实验进一步证实P-gP参与依托泊苷的泵出过程。同时也证实抑制P-gP功能确实增加了Hela细胞的凋亡。由此证实P-gP可能是宫颈癌化疗耐药的重要机制。
针对P-gP的耐药机制,可以通过抑制P-gP的表达和活性来逆转其引起的耐药反应。有研究[15]利用P-gP mRNA的反义寡核苷酸成功抑制了P-gP的表达,同时提高了恶性胶质瘤细胞系U-87 MG细胞内阿霉素的浓度。抗肿瘤药与P-gP抑制剂的联用也可能增强抗肿瘤作用,研究证实cyclosporine A可与P-gP相互作用并抑制P-gP的泵出功能,当cyclosporine A与P-gP合用可显著增加细胞毒性[16]。近年来越来越多的多药耐药逆转药物已经在临床试验中显示了良好的疗效。随着肿瘤耐药机制的研究深入,肿瘤的耐药性问题将逐渐得到解决。
[1] Ngan HY,Cheung AN,Tam KF,et al.Human papillomavirus-16/18 AS04-adjuvanted cervical cancer vaccine:immunogenicity and safety in healthy Chinese women from Hong Kong[J].Hong Kong Med J,2010,16(3):171-179.
[2] Ahmad AT,Haris Z,Brian M,et al.Phase I Trial of Carboplatin and Etoposide in Combination with Panobinostat in Patients with Lung Cancer[J].Anticancer Res,2013,33(10):4475-4481.
[3] Theodore SJ,Catherine ET,Michael BJ,et al.Etoposide Selectively Ablates Activated T Cells To Control the Immunoregulatory Disorder Hemophagocytic Lymphohistiocytosis[J].J Immunol,2014,192(1):84-91.
[4] 孙少卫,郭紫芬,朱炳阳,等.小凹介导氧化低密度脂蛋白跨内皮细胞转运[J].中南医学科学杂志,2009,37(5):512-515.
[5] 陆基宗,许英华,贺晴,等.高效液相色谱法测定白血病人依托泊苷血药浓度及其药物动力学研究[J].中国现代应用药学,2008,18(1):37-39.
[6] Mohar A,Mendivil MF.Epidemiology of cervical cancer[J].Cancer invest,2000,18(6):584-590.
[7] 罗飞,李志英.HPV 感染的子宫颈癌相关基因及基因治疗的研究进展[J].肿瘤预防与治疗,2010,23(5):432-434.
[8] 张国楠.子宫颈癌的术前动脉化疗[J].实用妇产科杂志,2005,21(4):199-201.
[9] Sachiko K,Tomoyuki M,Masahide F,et al.Effect of P-Glycoprotein and Breast Cancer Resistance Protein Inhibition on the Pharmacokinetics of Sunitinib in Rats[J].Drug Metab Dispos,2013,41(8):1592 - 1597.
[10] Mittapalli RK,Vaidhyanathan S,Elmquist WF,et al.Impact of P-Glycoprotein (ABCB1) and Breast Cancer Resistance Protein (ABCG2) on the Brain Distribution of a Novel BRAF Inhibitor:Vemurafenib(PLX4032)[J].J Pharmacol Exp Ther,2012,342(1):33-40.
[11] Juliano RL,Ling V.A surface glycoprotein modulating drug permeability in Chinese hamster ovary cell mutants.[J].Biochim Biophys Acta,1976,455(1):152-162.
[12] Jurjen SL,Carola WD,Robert AW,et al.P-Glycoprotein,Multidrug-Resistance Associated Protein 2,Cyp3a,and Carboxylesterase Affect the Oral Availability and Metabolism of Vinorelbine[J].Mol Pharmacol,2012,82(4):636 - 644.
[13] Tada Y,Wada M,Migita T,et al.Increased expression of multidrug resistance-associated proteins in bladder cancer during clinical course and drug resistance to doxorubicin[J].Int J Cancer,2002,98 (4):630 -635.
[14] Hsu CH,Chen CL,Hong RL,et al.Prognostic value of multidrug resistance 1,glutathione-S-transferase-pi and p53 in advanced nasopharyngeal carcinoma treated with systemic chemotherapy[J].Oncology,2002,62(4):305-312.
[15] Rittierodt M,Tschernig T,Harada K.Modulation of multidrug-resistance-associated P-glycoprotein in human U-87 MG and HUV-ECC cells with antisense oligodeoxynucleotides to MDR1 mRNA[J].Pathobiology,2004,71(3):123-128.
[16] Anglicheau D,Pallet N,Rabant M,et al.Role of P-glycoprotein in cyclosporine cytotoxicity in the cyclosporine-sirolimus interaction[J].Kidney Int,2006,70(6):1019-1025.
P-glycoprotein1MdiatedtheResistanceofCervicalCancertoEtoposide
TONG Wenjuan,SUN Shaowei
(DepartmentofGynecologyandObstetrics,theFirstAffiliatedHospital,UniversityofSouthChina,Hengyang,Hunan421001,China)
ObjectiveTo investigate the roles of P-glycoprotein 1 on etoposide resistance of cervical cancer cells.MethodThe expression of P-glycoprotein 1 in cervical cancer and chronic cervicitis tissue were observed at different periods.The hela cells were treated with azithromycin (P-glycoprotein 1 activator) or cyclosporine A (P-glycoprotein 1 inhibitor) for 6 hours,then incubated with etoposide for different times.The content of etoposide in hela cells was detected by HPLC.Hela cells were grown on a Transwell insert to obtain a tight monolayer and preincubated with etoposide for 30 minutes,then incubated for another 12h after addition of azithromycin,or cyclosporine in the apical reservoir,HPLC was used to detect the content of etoposide in bottom reservoir.Hela cells were treated with azithromycin or cyclosporine for 24h after preincubated with etoposide,the cell viability was determined by MTT assay,Western blot was used to analyze the expression of apoptosis related proteins Bcl-2 and Bax.ResultsThe expression of P-glycoprotein 1 was significantly higher in cervical cancer tissues than in cervicitis,and its expression level was closely related with cancer staging.Azithromycin enhanced the cytotoxic effect of etoposide on hela cells,increased the expression of Bax,and decreased Bcl-2 in concentration-dependent manner,while cyclosporine A played a protective role on hela cells,up-regulated the expression of Bcl-2,and inhibited the expression of Bax.Transwell culture experiment showed that,azithromycin increased the permeability of HeLa cell layer to etoposide,but cyclosporine A prevented the passage of etoposide across cell layer.ConclusionP-glycoprotein 1 promoted HeLa cells to pump out etoposide,and relieved its cytotoxic effect,which therefore mediated the resistance of cervical cancer to etoposide.
P-glycoprotein 1; cervical cancer; etoposide; Hela cells
2095-1116(2014)05-0447-05
2013-11-02
童文娟,本科,主治医师,研究方向:妊娠期高血压,E-mail:tongwenjuan@chinaren.com.通讯作者孙少卫,博士,讲师,心血管药理专业,E-mail:sunshaowei2004@126.com.
R737.33
A
(此文编辑:蒋湘莲)

