超声波提取米团花多糖*
杨婷婷,张广文,朱玲玲,欧仕益
(暨南大学理工学院食品科学与工程系,广东 广州,510632)
米团花(Leucosceptrum canum Smith)别名山蜂蜜、渍糖树、羊巴巴、蜜蜂树花、明堂花,主要分布在我国的滇中至滇南地带,生长在海拔400~1 900 m的林缘、水边和路边草地,是一种蜜源植物,在云南一直被人们作为天然的食用原料添加到食物中[1]。近些年研究表明植物多糖具有抗氧化、抗炎、抗癌、增强免疫力等多种生理功能,因此植物多糖的研究受到了人们的普遍关注[2-4]。但关于米团花多糖的研究鲜有报道,对米团花多糖进行研究不仅能扩大植物多糖的来源,还为开发其潜在的药用价值和商业价值提供理论依据。
传统的多糖提取方法主要是加热或煮沸法,不仅效率低而且耗时长。随着科学技术的进步,超声波提取、微波提取以及超临界萃取等新型提取技术已广泛应用于活性物质的提取,而超声波提取技术因其在植物多糖提取中的众多优点更是被广泛采用[5-8]。本实验对米团花多糖的提取工艺进行了研究,采用超声波辅助提取技术,考察了超声功率、料液比、以及超声时间对米团花多糖得率的影响。在单因素实验的基础上,以米团花多糖得率为响应值,利用响应面分析法(response surface methodology,RSM)对超声波提取米团花多糖工艺条件进行优化,该设计试验方案不仅实验周期短,而且具有求得回归方程精度高的优点[9-10]。并采用多元二次回归方程来拟合因素与响应值之间的函数关系以获得最优工艺参数,从而提高了米团花多糖得率。
1 材料与方法
1.1 材料与仪器
米团花,购于云南省宝山市,依次在65℃烘箱中经24 h烘干后,粉碎,过45目筛,置于干燥器中储存备用;苯酚、无水乙醇、石油醚,分析纯,天津市富起化工有限公司;三氯甲烷、正丁醇、丙酮,分析纯,广州化学试剂厂;考马斯亮蓝、浓H2SO4、葡萄糖,分析纯,天津市富宇精细化工有限公司。
透析袋(齐云生物技术有限公司);HH-4型恒温水浴锅(江苏金坛市宏华仪器厂);RE-552 AAB型旋转蒸发器(上海嘉鹏科技股份有限公司);MP502B型电子分析天平(上海精密科技仪器有限公司);722S型可见分光光度计(上海舜宇恒平科学仪器有限公司);GZX-DH.500-S-Ⅱ型电热恒温干燥箱(上海跃进医疗器械厂);高速万能粉碎机(北京市永光明医疗仪器厂);THC型数控超声波提取机(济宁天华超声电子仪器有限公司);冷冻干燥机(宁波生化仪器有限公司)。
1.2 实验方法
1.2.1 超声波提取米团花多糖
精确称取5.0 g米团花粉末于250 mL圆底烧瓶中,依次用石油醚、丙酮回流脱脂后,在恒定的温度下,按一定的料液比例加入适量蒸馏水,混匀后充分浸透,然后置于超声波仪器内,以一定功率提取一段时间,抽滤提取液,滤液经旋转蒸发仪浓缩,加入4倍体积的体积分数95%乙醇于4℃下醇沉24 h,5 000 r/min离心5 min。取沉淀,加蒸馏水复溶,采用Sevage[V(三氯甲烷)∶V(正丁醇)=4∶1 ]法脱蛋白,按照一定比例取粗多糖溶液和Sevage溶液(体积比4∶1)于20 mL试管中,涡旋5 min,使其充分反应,取其上清液,重复操作3次[11-12],考马斯亮蓝法测定蛋白脱除率。上清液依次于4℃条件下透析2 d后用4倍体积无水乙醇醇沉,10 000 r/min离心5 min,取其沉淀冷冻干燥得米团花多糖样品。
以水作溶剂进行提取,按照上述操作,在恒定温度条件下分别考察超声功率(300~700 W)、料液比[1∶10 ~1∶50(g∶mL)]、超声时间(30 ~70 min)对米团花多糖得率的影响。
1.2.2 多糖含量的测定
采用苯酚-硫酸法[13]。以葡萄糖溶液为标准,在490 nm处测定葡萄糖浓度与吸光度的对应关系,制作标准曲线。标准曲线的回归方程为y=1.070 7x+0.037 7,R2=0.999 2。精确称取米团花多糖样品10.0 mg,水溶解后定容到10 mL,摇匀,作为多糖储备液。精确吸取多糖储备液0.2 mL,加水至2 mL,按测定标准曲线同样的方法测其吸光值。
1.2.3 多糖得率
多糖得率/%=(多糖含量/米团花原料质量)×100。
米团花多糖含量与多糖得率呈正相关,多糖得率即反映了多糖含量,因此采用多糖得率数据为依据来进行实验结果讨论。
1.3 响应面优化实验设计
综合前期单因素试验的结果,根据Box-Behnken试验设计原理,在恒定的温度条件下以超声功率、料液比、超声时间3个因素为自变量,米团花多糖得率为响应值,进行试验设计,并采用响应面分析法在3因素3水平上对提取过程进行优化。试验因素与水平见表1。
1.4 实验验证
精确称取3组米团花多糖样品各1.0 g,按最佳提取工艺条件进行实验,计算多糖得率。
2 结果与分析
2.1 蛋白质脱除率
如图1所示,经过Sevage法脱蛋白,米团花提取液中的蛋白脱除率随着脱除次数的增加而增大,在第3次时达到了92.14%,随后增加脱除次数,脱除率并没有明显的变化。因此以脱除3次为最佳脱除次数。
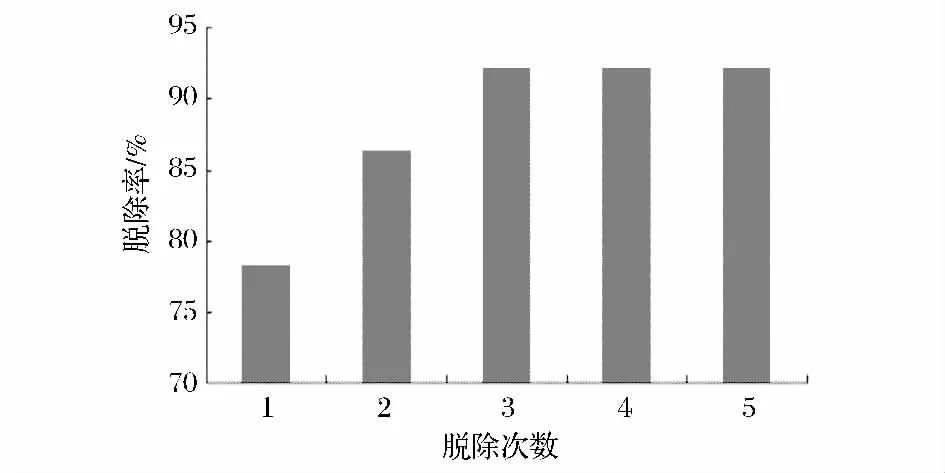
图1 蛋白脱除率Fig.1 The removal rate of protein
2.2 超声波提取米团花多糖单因素实验
2.2.1 超声功率对米团花多糖得率影响
在料液比 1∶30(g∶mL),提取时间 50 min,分别考察超声功率300、400、500、600、700 W 对米团花多糖得率的影响,实验结果如图2所示。由图2所知,随着超声功率的增大,米团花多糖得率也逐渐的提高,在500 W时多糖得率达到最大值为17.48%;超声功率大于500 W时多糖得率反而降低,这主要是由于超声波功率增大机械作用越强,分子扩散越快多糖就容易溶出,而超声功率大于500 W时机械作用和空化作用过强而造成多糖降解为寡糖,引起多糖得率的降低。
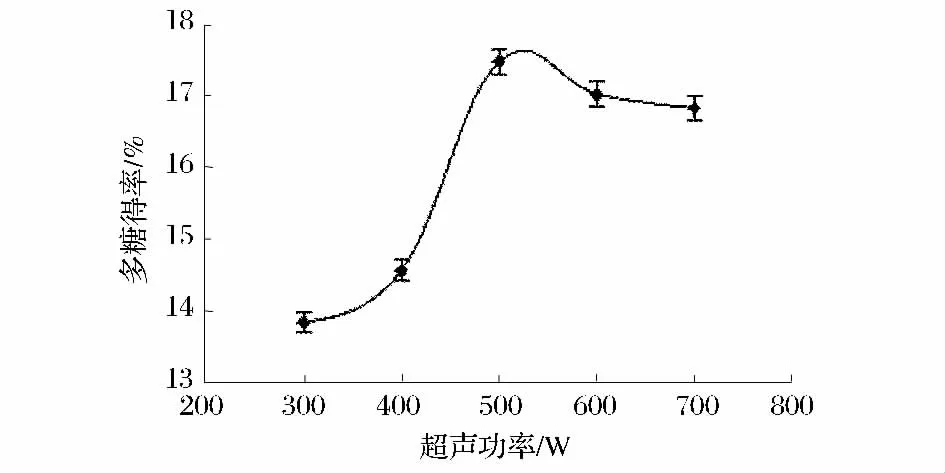
图2 超声功率对多糖得率影响Fig 2 The influence of ultrasonic power on polysaccharide yield
2.2.2 料液比对米团花多糖得率影响
在超声时间50 min,超声功率500 W,分别考察料液比 1∶10、1∶20、1∶30、1∶40、1∶50(g∶mL)对米团花多糖的影响,实验结果如图3所示。从图3中可以看出,在料液比为1∶10 ~1∶30(g∶mL)时,随着料液比的增加,多糖得率从12.32%增加到17.56%。这是因为料液比的增加加大了溶剂与米团花的接触面积从而使多糖更易溶出;当料液比为1∶30~1∶50(g∶mL)时,多糖得率从17.56%降低到16.62%。过多的溶剂不仅造成多糖得率降低,而且也造成溶剂的浪费,增大生产成本,所以选择最佳料液比为1∶30(g∶mL)。
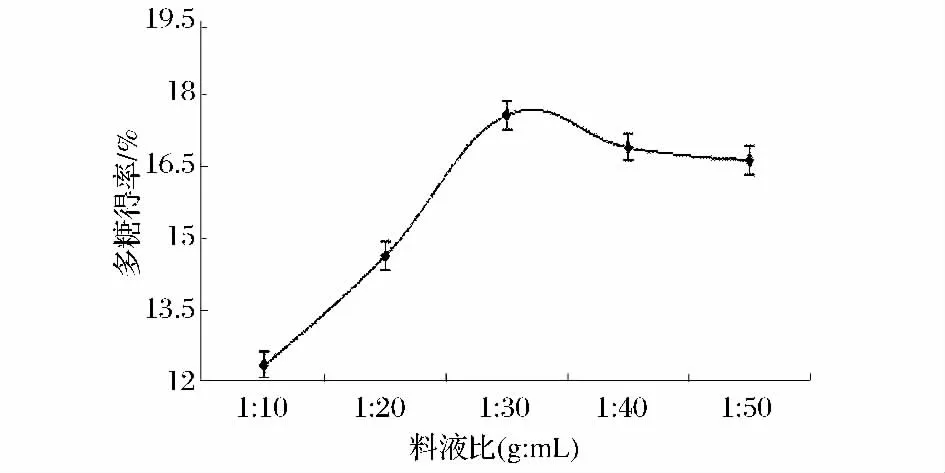
图3 料液比对多糖得率影响Fig.3 The influence of solid-liquid ratio on polysaccharide yield
2.2.3 超声时间对米团花多糖得率的影响
在超声功率500 W,料液比1∶30(g∶mL)条件下,分别考察超声时间 30、40、50、60、70 min 对米团花多糖得率的影响,实验结果如图4所示。从图4中可以看出,在米团花多糖得率在50 min前随着提取时间的增加而增加,之后随着时间的增加多糖得率反而降低。造成这一现象的原因可能是随着超声时间的增加,细胞遭到破坏多糖的溶出率增加;超声时间超过50 min多糖得率降低,一方面是溶剂体系已经达到了动态平衡,另一方面可能是超声时间过长致使多糖发生分解所致。因此,选择最佳超声时间为50 min,米团花多糖得率为17.32%。
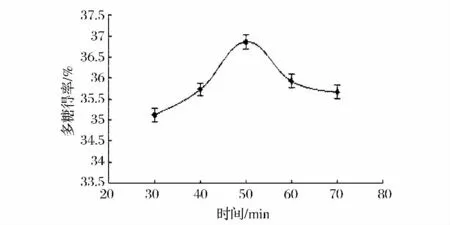
图4 超声时间对多糖得率的影响Fig 4 The influence of ultrasonic time on polysaccharide yield
2.3 响应面优化实验
依据软件Box-Behnken试验方案进行3因素3水平试验,结果见表2。将所得的实验数据采用Design Expert 8.0.6软件进行多元回归拟合分析,得到以多糖得率(Y)为目标函数的二次回归方程:
Y=17.500 00+0.258 75A+0.206 25B+0.272 50C+0.075 000AB-0.297 50AC+0.012 500BC-0.260 00A2-0.090 000B2-0.252 50C2.

表2 Box-Behnken试验设计及结果Table 2 Experiment design and results of Box-Behnken
2.4 回归方程方差分析
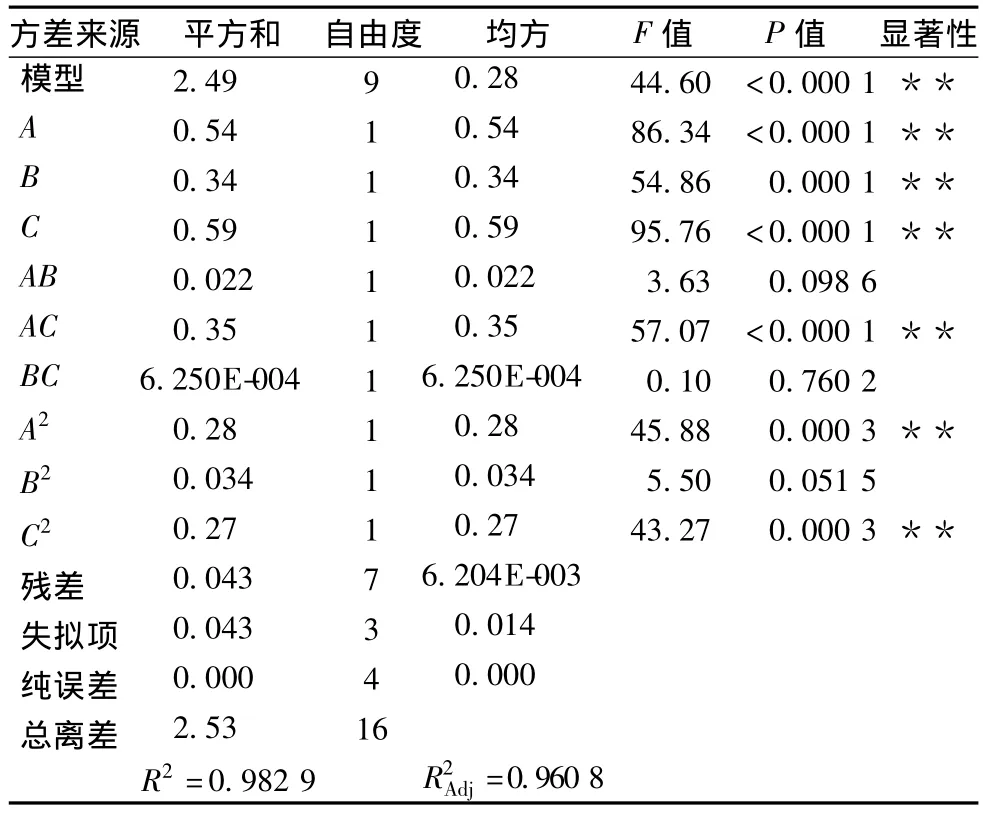
表3 回归方程方差分析Table 3 Analysis of variance(ANOVA)for regression equation
表3可知,回归模型的P<0.000 1,说明该模型极显著,其响应值与各试验因素之间存在显著的线性相关性。模型R2=0.982 9,R2Adj=0.960 8,两者数值极为相近,说明该模型能反映96.08%响应值的变化,因而该模型拟合程度较好,实验误差小CV=0.43%较低,说明实验操作可信。同时失拟项也进一步表明回归方程可以较好地描述各因素与响应值之间的真实关系,综上可以确定回归方程为米团花多糖超声波提取工艺的优化提供了一个合适的模型。
从对各因素的方差分析中可以看出超声功率A、料液比B、超声时间C的P值均≤0.000 1,说明了A,B,C对米团花多糖得率有显著性影响,根据它们的F值可以判断,对多糖得率的影响顺序从大到小依次为:C>A>B。交互项AC的 P值小于0.001,说明AC的交互作用对米团花多糖得率具有显著性影响,而AB,BC对多糖得率的影响均不显著。二次项A2,C2的P值小于0.001,对米团花多糖的得率具有显著性影响,且A2对多糖得率的影响大于C2。而B2对多糖得率影响不显著。
2.5 超声波提取米团花多糖工艺的响应面分析与优化
由图5可知,AC交互影响显著,多糖得率随着超声功率和超声时间的增加而迅速增大。较低超声功率时,随着提取时间的增加,多糖得率呈缓慢上升趋势;增大超声功率,随着时间延长多糖得率呈较大上升趋势,且趋势明显,并且在功率为500 W,时间为50 min时,多糖得率达到最大值。图6可知,BC的交互影响不显著,随着料液比的变化,多糖得率有较小的上升趋势,料液比一定,多糖得率随提取的时间的延长而相应增大;而时间一定时,料液比的增加对多糖得率影响较小。图7可知,AB的交互影响一般显著,料液比一定时,超声功率对多糖影响率较大,随着超声功率的增大多糖得率呈先增后降的趋势。3个因素对多糖得率的影响以及各因素之间的交互影响与回归分析结果相吻合。
从响应面的最高点和等高线可以看出在所选的范围内存在极值,响应面的最高点同时也是等值线中的最小椭圆的中心点。通过岭嵴分析得到米团花多糖最佳超声波提取工艺条件为:超声功率548.3 W,料液比1∶30(g∶mL),提取时间 55.6 min,理论最佳提取率为17.74%。根据实际情况按照料液比1∶30(g∶mL),超声功率548 W,提取时间55 min进行3次平行验证试验,得到米团花多糖的提取率为17.59%,与预测值较为接近,拟合性好。实验结果充分验证了所建模型的正确性,说明响应面法适用于超声波提取米团花多糖工艺条件的回归分析和参数优化。
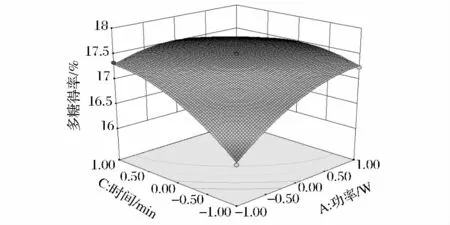
图5 Y=f(A、C)的响应面和等高线图Fig.5 Response surface and contour of Y=f(A、C)
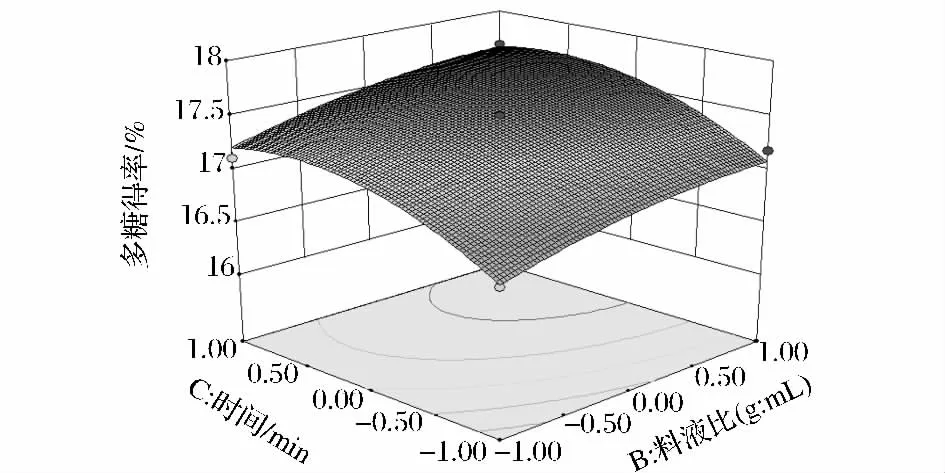
图6 Y=f(B、C)的响应面和等高线图Fig.6 Response surface and contour of Y=f(B、C)
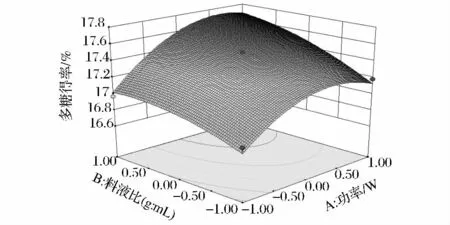
图7 Y=f(A、B)的响应面和等高线图Fig.7 Response surface and contour of Y=f(A、B)
3 结论
在单因素试验的基础上,本研究通过Box-Behnken试验设计,建立了影响米团花多糖得率二次多项数学模型,并应用响应面分析法对影响超声波提取米团花多糖的主要因素(超声功率、料液比、超声时间)进行了优化。结果显示,超声波提取米团花多糖的最佳工艺条件为:超声功率548.3 W,料液比1∶30(g∶mL),提取时间为55.6 min。在此条件下,实际提取率17.59%,与模型理论预测值17.74%的相对误差为0.8%。实验结果证明,利用响应面法对超声波提取米团花多糖工艺进行优化,可获得最优的工艺参数,为米团花多糖的进一步深入研究奠定基础。
传统的热水提取米团花多糖实验。在一定温度下按料液比1∶30(g∶mL),时间为55.6 min进行提取,重复实验5次。在此条件下,米团花多糖提取率为12.38%,这与在超声条件下多糖得率17.59%有着较大差距,因此超声波提取米团花多糖与传统的热水提取相比较具有较为明显的优势。
[1] 吴清林,梁涛,张广文,等.米团花色素提取前后的主要成分变化分析[J].食品研究与发展,2012,33(1):113-115.
[2] Souza B W S,Cerqueira M A,Bourbon A I,et.al.Chemical characterization and antioxidant activity of sulfated polysaccharide from the red seaweed Gracilaria birdiae [J].Food Hydrocolloid,2012,27(2):287-292.
[3] CHEN H X,ZHANG M,QU Z S,et.al.Antioxidant activities of different fractions of polysacchari-de conjugates from green tea(camellia sinensis)[J].Food Chem,2008,106(2):559-563.
[4] XIONG S L,LI A L,HUANG N,et.al.Antioxidant and immunoregulatory activity of different polysaccharide fractions from tuber of phiopogon japonicus[J].Carbohydr.Polym,2011,86(3):1 273-1 280.
[5] 沈霞,张艳,袁慧慧,等.响应面分析法优化艾叶粗多糖提取工艺的研究[J].中成药,2010,32(1):48-51.
[6] 汪显阳,姚春艳,张佩文,等.六味地黄丸中多糖含量测定研究[J].中医药研究,2000,16(4):42-44.
[7] 王洪伟,崔崇士,徐雅琴.南瓜多糖复合酶法提取及纯化的研究[J].食品科学,2007,28(8):247-249.
[8] 赵昱,朱刚,于长青,等.超临界CO2萃取当归油的工艺及当归多糖的提取[J].中国中医药信息杂志,2004,6(11):512-513.
[9] 戴喜末,熊子文,罗丽萍.响应面法优化野艾蒿多糖的超声波提取及其抗氧化性研究[J].食品科学,2011,32(8):93-97.
[10] 张琳,樊金玲,朱文学,等.响应面法优化超声波辅助提取甘草多糖工艺[J].食品科学,2010,31(16):67-71.
[11] 唐志红,于志超,赵巍,等.浒苔多糖超声波提取工艺的研究[J].现代食品科技,2011,27(1):56-59.
[12] 曹楠楠,陈香荣,吴艳.苦豆子多糖的超声波提取工艺优化及理化性质研究[J].现代食品科技,2014,30(2):209-215.
[13] Saha S K,Brewer E F.Determination of the concentrations of oligosaccharides,complex type carbohydr-ates and glycoproteins using the phenol-sulfuric acid method[J].Carbohyd Res,1994,254:175-181.

