鱿鱼墨黑色素铁对缺铁性贫血大鼠的影响
王芙蓉 , 谢中国 , 叶兴乾 , 邓尚贵 , 陈士国 *, 胡亚芹
(1.湖南文理学院 生命科学学院,湖南 常德 415000;2.浙江舟山普陀海洋高科技园区,浙江舟山316100;3.浙江大学 生物工程与食品学院,浙江 杭州 310029;4.浙江海洋学院 食品与药学学院,浙江 舟山 316000)
铁是人体必需的一种营养素,在机体代谢过程中起着非常重要的作用,铁在体内参与血红蛋白、肌红蛋白、细胞色素及某些酶的合成,体内缺铁时将引起一系列疾病[1]。铁缺乏严重时会导致小细胞低色素性贫血即缺铁性贫血(IDA)。IDA是世界范围内严重影响人类健康的主要原因之一,也是世界卫生组织(WHO)确认的四大营养缺乏症之一[2]。
铁剂和铁剂强化食品常被用来防治IDA,但是现有铁制剂的吸收干扰因素较多,生物利用度非常低,并且对胃肠道产生较大刺激,强化的铁剂往往导致食品中的脂质氧化劣变等,不易为患者所接受。因此寻求更为安全和高效的补铁制剂是当前亟待解决的问题。
鱿鱼墨囊大约占鱿鱼体质量的1.3%,鱿鱼墨主要成分为黑色素和蛋白多糖复合体,鲜墨汁中黑色素的质量分数约为30%,属于真黑色素。鱿鱼墨黑色素具有很强的阳离子螯合特性,它主要通过羧基和去质子化羟基等阴离子起作用。黑色素与金属离子的结合能够起着保护细胞的功能。黑色素与金属离子具有很强的螯合能力,特别是对于铁离子的螯合,前期研究表明鱿鱼墨黑色素螯合铁离子的能力可达1.37 mmol/g,远高于天然有机态食品中有机铁的含量,利用鱿鱼墨黑色素螯合金属离子的特性制备一种新型补铁剂—黑色素铁,利用鱿鱼墨黑色素制备出黑色素铁,对于IDA的防治具有重大作用,对其机理有待进一步研究。作者通过大鼠缺铁模型试验,研究鱿鱼墨黑色素铁对缺铁性贫血的影响,并探讨其作用机理。
1 材料与方法
1.1 实验材料与设备
SD大鼠:购于上海斯莱克生物有限公司;血清铁(SI)测定试剂盒、总铁结合力(TIBC)测定试剂盒:购自南京建成生物工程研究所;铁蛋白(SF)、促红细胞生成素(EPO)和转铁蛋白受体(sTfR)测定试剂盒:购于美国R&D公司;紫外可见分光光度计:岛津公司产品;原子吸收分光光度计:AA700型,美国Perkin Elmer公司产品。
1.2 鱿鱼墨黑色素铁的制备
采用高速离心法对鱿鱼墨黑色素进行分离,收集沉淀冷冻干燥后,即得黑色素纯品。黑色素铁的制备:配制一定浓度的FeCl3溶液,加入黑色素,置4℃搅拌24 h,离心收集沉淀,冷冻干燥后即得黑色素铁。样品以硝酸和高氯酸混合溶液消化后,采用原子吸收分光光度法测得其中铁的质量分数为85 g/g。
1.3 动物分组与喂养
健康雄性 SD 大鼠 56只,体质量(80±5) g,以基础饲料适应喂养3 d。随即分为7组,其中8只整个实验过程都饲喂正常饲料,另外48只喂缺铁饲料,耗空28 d建造缺铁性贫血模型。缺铁饲料参照AIN-76饲料配方[3],其中的矿物元素添加剂不添加铁剂。缺铁大鼠根据Hb含量随机分为6组:缺铁组、鱿鱼墨黑色素铁低、中、高剂量组(剂量分别为6,12,18 mg/kg)FeCl3组(剂量为 6 mg/kg),FeSO4组(剂量为6 mg/kg)。缺铁组和正常对照组灌胃等体积去离子水,共21 d。
动物饲养在不锈钢笼中,环境温度湿度恒定((24±1)℃,(55±5)%),自由采食、自由饮用去离子水,光照12 h/d,实验过程避免铁污染。灌胃结束后,56只大鼠分别用巴比妥钠腹腔注射麻醉,在大鼠深度麻醉状态下剖开腹部,从腹主动脉取血10 mL左右,从中取一部分全血测定Hb,另一部分取血清测血清 SI、SF、EPO、sTfR、TIBC。
1.4 检测指标
1.4.1 血液指标的测定 Hb的测定:氰化高铁血红蛋白法[4];血清SI和TIBC:采用南京建成生物工程研究所试剂盒测定。SF、EPO和sTfR采用ELASA法测定。
1.4.2 肝脏和脾脏中铁含量的测定 待测肝脏和脾脏样品分别加硝酸8 mL和高氯酸2 mL缓缓加热,待溶液变成无色时,蒸发余酸至近干,冷却,定容,稀释到合适的倍数后用美国Perkin Elmer公司AA700型火焰原子吸收分光光度计测定铁含量。
1.5 数据处理
采用SPSS18.0软件中的单因子方差分析进行统计,并用Duncan氏新复极差法进行多重比较。
2 结 果
2.1 鱿鱼墨黑色素铁对大鼠血红蛋白的影响
鱿鱼墨黑色素铁对大鼠Hb的影响见表1。造模前各组大鼠Hb含量无显著性差异(P>0.05)。经过28 d的缺铁造模,缺铁组大鼠Hb含量均低于90 g/L,说明大鼠已经处于缺铁性贫血状态。对缺铁性贫血大鼠分别补充鱿鱼墨黑色素铁、FeCl3和FeSO421 d后,大鼠Hb含量已恢复正常,与缺铁组比较差异显著 (P<0.05),与正常对照组比较差异不显著(P>0.05)。
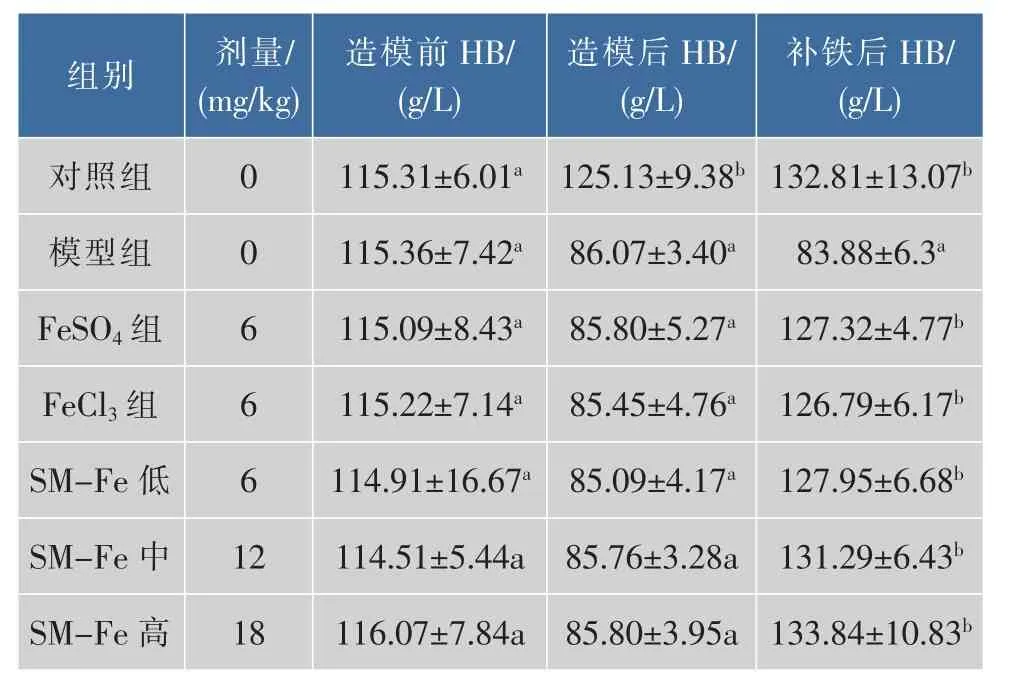
表1 造模前、造模后及补铁后各组大鼠血红蛋白的含量Table 1 Hb content of rats before depletion,depletion and repletion
2.2 鱿鱼墨黑色素铁对大鼠体质量的影响
鱿鱼墨黑色素铁对大鼠体质量的影响见表2。造模前各组大鼠体质量无显著性差异(P>0.05)。经过28 d的缺铁造模,缺铁组大鼠体质量低于正常对照组(P<0.05)。对缺铁性贫血大鼠分别补充鱿鱼墨黑色素铁、FeCl3和FeSO421 d后,补铁组各组大鼠体质量与缺铁组比较差异显著(P<0.05),与正常对照组比较差异显著(P<0.05)。

表2 造模前、造模后及补铁后各组大鼠的体质量Table 2 Body weight changes of rats before depletion,depletion and repletion
2.3 鱿鱼墨黑色素铁对大鼠脏器指数的影响
鱿鱼墨黑色素铁对缺铁性贫血大鼠脏器指数的影响见表3。鱿鱼墨黑色素铁各剂量组、FeCl3组和FeSO4组大鼠心脏指数显著低于缺铁模型组(P<0.05),但明显高于对照组(P<0.05)。
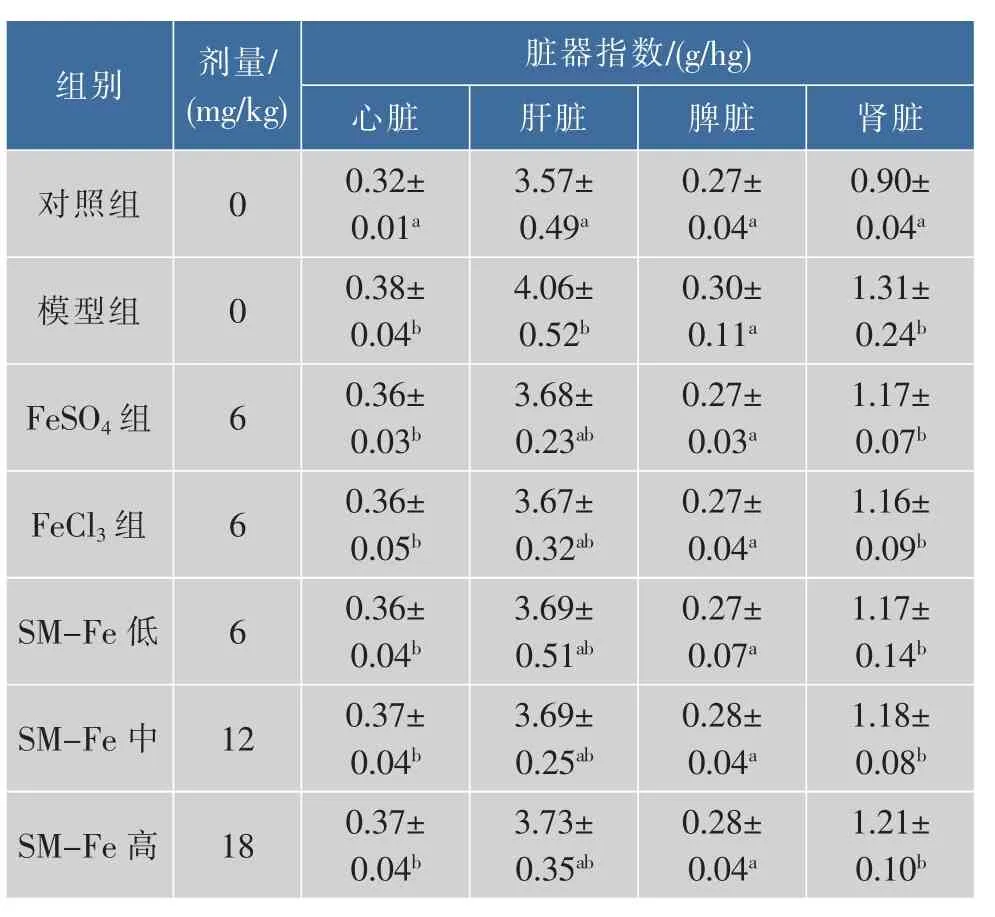
表3 鱿鱼墨黑色素铁对缺铁性贫血大鼠脏器指数的影响Table 3 Effect of SM-Fe on organ indexs in IDA model rats
鱿鱼墨黑色素铁各剂量组、FeCl3组、FeSO4组大鼠的肝脏指数和脾脏指数与缺铁模型组比较差异不显著(P>0.05),与对照组比较差异不显著(P>0.05)。鱿鱼墨黑色素铁各剂量组、FeCl3组、FeSO4组的大鼠肾脏指数与缺铁模型组比较差异不显著(P>0.05),与对照组比较差异显著(P<0.05)。
2.4 鱿鱼墨黑色素铁对大鼠血清铁、总铁结合力、肝脏铁和脾脏铁的影响
鱿鱼墨黑色素铁对缺铁性贫血大鼠血清铁、总铁结合力、肝脏铁和脾脏铁的影响如表4。鱿鱼墨黑色素铁各剂量组、FeCl3组和FeSO4组大鼠血清铁SI与对照组比较差异不显著(P>0.05),与缺铁模型组比较差异显著(P<0.05)。鱿鱼墨黑色素铁各剂量组、FeCl3组和FeSO4组大鼠血清总铁结合力与对照组比较无显著性差异(P>0.05),与缺铁模型组比较差异显著(P<0.05)。鱿鱼墨黑色素铁各剂量组、FeCl3组和FeSO4组大鼠肝脏铁和脾脏铁含量与对照组比较差异不显著(P>0.05),与缺铁模型组比较差异显著(P<0.05)。

表4 鱿鱼墨黑色素铁对缺铁性贫血大鼠血清铁、总铁结合力、肝脏铁和脾脏铁的影响Table 4 Effect of SM-Fe on serum iron,TIBC,liver and spleen iron in IDA model rats
2.5 鱿鱼墨黑色素铁对大鼠血清铁蛋白、促红细胞生成素和转铁蛋白受体的影响
鱿鱼墨黑色素铁对缺铁性贫血大鼠血清铁蛋白、血红细胞生成素和转铁蛋白受体的影响见表5。鱿鱼墨黑色素铁各剂量组、FeCl3组和FeSO3组与缺铁模型组比较可显著提高大鼠血清SF和EPO(P<0.05),但低于对照组(P<0.05)。 鱿鱼墨黑色素铁各剂量组、FeCl3组和FeSO4组与缺铁模型组比较可显著降低大鼠血清转铁蛋白受体含量(P<0.05),但高于对照组(P<0.05)。
3 讨论
缺铁性贫血(IDA)是全世界常见病之一。通过对大鼠饲喂缺铁饲料建立IDA模型,探讨鱿鱼墨黑色素铁对IDA的影响。饲喂缺铁饲料28 d后,饲养缺铁饲料的大鼠Hb含量低于90 g/L,说明已经造模成功。通过对缺铁性贫血大鼠补充鱿鱼墨黑色素铁、FeCl3和FeSO4可以使大鼠Hb恢复到正常水平,说明补充铁剂可有效改善IDA。通过饲喂缺铁饲料可引起大鼠体质量的降低,补充铁剂后体质量仍然低于对照组,说明本实验中缺铁可引起大鼠体质量的降低并影响实验最后的体质量,这与先前的报道一致[3,5]。
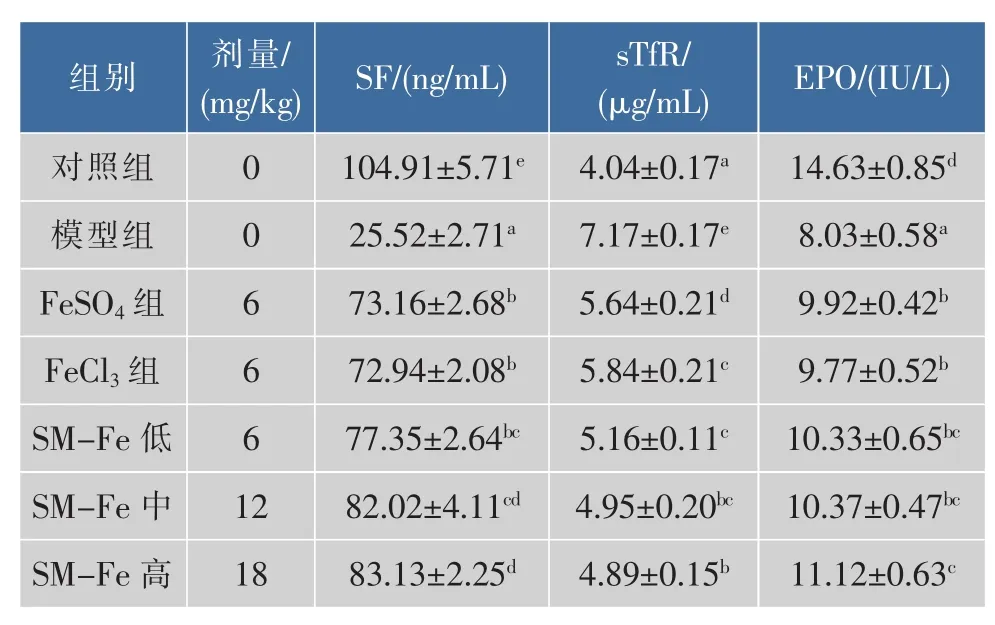
表5 鱿鱼墨黑色素铁对缺铁性贫血大鼠血清铁、转铁蛋白受体和血红细胞生成素的影响Table 5 Effect of SM-Fe on serum ferritin,sTfR and EPO in IDA model rats
IDA大鼠具有相对更重的心脏和心脏比重,表明存在心肌肥厚[6]。同时,贫血大鼠与对照组比较可增加心脏重量和心肌细胞的大小[7]。试验中缺铁性贫血模型组大鼠心脏指数显著高于对照组,补充鱿鱼墨黑色素铁、FeCl3和FeSO4后的各组大鼠心脏指数高于对照组,但与缺铁模型组比较差异不显著。
铁是合成Hb的必需成分,通常认为铁含量不足可引起Hb合成速度的减慢。饲喂缺铁饲料引起大鼠Hb和血清铁显著降低表明血红蛋白铁的耗竭。通过补充铁剂鱿鱼墨黑色素铁、FeCl3和FeSO4可以恢复大鼠Hb水平和血清铁含量。
血清总铁结合力(TIBC)是指能与血清中全部转铁蛋白结合的最大铁量。通过测定TIBC可以用来评价转铁蛋白被饱和的水平,从而评估铁的吸收效果。TIBC偏高说明机体处于缺铁状态。缺铁模型组大鼠血清TIBC明显高于对照组,补充鱿鱼墨黑色素铁、FeCl3和FeSO4后大鼠TIBC低于缺铁模型组。补充铁剂后,动物在吸收利用铁的过程中,由于体内铁含量升高,血清铁含量增加,血红蛋白含量上升,转铁蛋白合成量减少,血清TIBC降低[8]。血清TIBC越小,表明转铁蛋白饱和程度越高,铁的吸收利用效果更好。因此鱿鱼墨黑色素铁比FeCl3和FeSO4的补铁效果更好。
肝脏和脾脏是机体最主要的铁储存器官[9]。缺铁性贫血模型组大鼠肝脏铁和脾脏铁明显低于对照组和补铁组,肝脏铁和脾脏铁含量降低说明机体内储存铁的耗竭,通过补充铁剂鱿鱼墨黑色素铁、FeCl3和FeSO4可以提高肝脏铁和脾脏铁含量,进而提高机体铁的储存。
铁蛋白是机体内一种储存铁的高分子含铁化合物,是体内铁贮备的主要形式之一,也是反映机体体内铁贮备的一个特异性指标[10-11]。血清铁蛋白含量可以反映机体铁储存水平,机体铁贮备减少时,血清铁蛋白也相应降低。缺铁时血清铁蛋白含量低,补铁时或缺铁时,血清铁蛋白含量变化很大[12]。当机体不是处于炎症状态下时,血清铁蛋白浓度可以有效反映机体储存铁的多少[13]。在本研究中,缺铁模型组血清铁蛋白含量明显低于对照组,通过补充鱿鱼墨黑色素铁、FeCl3和FeSO4,可显著提高血清铁蛋白含量。
血清转铁蛋白受体(sTfR)能准确反映体内铁储存状态,一定程度上反映细胞转铁蛋白受体的数量,sTfR是循环于血清中的转铁蛋白受体片段的一种形式,主要以转铁蛋白的受体与转铁蛋白复合物的形式存在于血清中。通过测定血清sTfR浓度可以对IDA进行诊断[14-15]。循环中的sTfR与个体铁储存变化有所不同。血清sTfR含量在轻度铁缺乏状态下也能增加[16]。作者发现,缺铁模型组大鼠sTfR含量显著高于对照组。补充铁剂鱿鱼墨黑色素铁、FeCl3和FeSO4后,可显著降低血清sTfR水平。
促红细胞生成素(EPO)是促进红细胞生成的一个重要因子,它可以刺激红系爆式集落单位(BFUE)的增殖和红系克隆形成单位(CFU-E)的分化,刺激红系祖细胞和前体红细胞的分裂,促使红细胞的生成增多[17]。EPO的产生主要由氧依赖性反馈控制[18]。Hb是氧感受器,当Hb合成受到抑制时,EPO生成减少,血液中的EPO浓度在贫血时非常低。研究发现,缺铁模型组大鼠EPO含量明显低于对照组,补充铁剂鱿鱼墨黑色素铁、FeCl3和FeSO4后,可增加Hb的合成,显著促进EPO生成,进而促进造血功能。
4 结语
用不同剂量的鱿鱼墨黑色素铁灌胃缺铁性贫血大鼠,可提高大鼠血红蛋白含量,提高血清、肝脏和脾脏铁含量、提高血清铁蛋白和促红细胞生成素含量,提高血清和肝脏抗氧化能力,降低血清总铁结合力和转铁蛋白受体含量,改善缺铁性贫血,且比FeSO4和FeCl3补铁效果更佳。
[1]Boldt DH.New perspectives on iron:an introduction[J].American Journal of the Medical Sciences,1999,318:207-212.
[2]WHO/UNI CEF/UNU.Iron deficiency anaemia:assessment prevention,and control[M].Geneva:World Health Organization,2001(WHO/NHD/01.3).
[3]Borel MJ,Smith SH,Brigham DE,et al.The impact of varying degrees of iron nutrition on several functional consequences of iron deficiency in rats[J].Journal of Nutrition,1991,121(5):729-736.
[4]Davidsohn I,Nelson DA.The blood.In:Clinical Diagnosis by Laboratory Methods[M].Philadelphia,PA.1974.
[5]Strube Y N,Beard J L,Ross A C.Iron deficiency and marginal vitamin A deficiency affect growth hematological indices and the regulation of iron metabolism genes in rats[J].Journal of Nutrition,2002,132(12):3607-3615.
[6]Medeiros DM,Beard JL.Dietary iron deficiency results in cardiac eccentric hypertrophy in rats[J].Proceedings of Society for Experimental Biology and Medicine,1998,218(4):370-375.
[7]Rossi MA,Carillo SV,Oliveira JS.The effect of iron deficiency anemia in the rat on catecholamine levels and heart morphology[J].Cardiovascular Research,1981,15(6):313-519.
[8]丁宝淼,张晓鸣,夏书芹.甘氨酸螯合铁纳米脂质体对缺铁性贫血大鼠的补铁效果[J].食品与生物技术学报,2011,30(1):49-54.DING Baoming,ZHANG Xiaoming,XIE Shuqin.Effectiveness of treatment of iron deficiency anemia in rats with ferrous glycinate nanol iposomes[J].Journal of Food Science and Bitechnology,2011,30(1):49-54.(in Chinese)
[9]Munro HN,Linder MC.Ferritin:biosynthesis and role in iron metabolism[J].Physiological Reviews,1978,58(2):317-396.
[10]Van Zeben D,Bieger R,Van Wermeckerken RK,et al.Evaluation of microcytosis using serum ferritin and red blood cell distribution width[J].European Journal of Haematology,1991,44(2):106-109.
[11]Fautrel B, Moel GL, Saint-Marcoux B,et al.Diagnostic value of ferritin and glycosylated ferritin in adult onset Still's disease[J].The Journal of Rheumatology,2001,28(2):322-329.
[12]Pollock AS,Lipschitz DA,Cook JD.The kinetics of serum ferritin[J].Proceedings of Society for Experimental Biology and Medicine,1978,157(3):481-485.
[13]Measurement of Iron Status[M].Washington,DC:International Life Science Institute,1984.
[14]Thorstensen K,Romslo I.The transferrin receptor:its diagnostic value and its potential as therapeutic target[J].Scandinavian Journal of Clinical&Laboratory Investigation,1993,53(s215):113-120.
[15]Punnonen K,Irjala K,Rajamaki A.Iron-deficiency anemia is associated with high concentrations of transferrin receptor in serum[J].Clinical Chemistry,1994,40(5):5774-5776.
[16]Skikne BS,Flowers CH,Cook JD.Serum transferrin receptor:a quantitative measure of tissue iron deficiency[J].Blood,1990,75(9):1870-1876.
[17]Jelkmann,W.Erythropoietin after a century of research:younger than ever[J].European Journal of Haematology,2007,78(3):183-205.
[18]Goldberg MA,Dunning SP,Bunn HF.Regulation of the erythopoietin gene:Evidence that the oxygen sensor is a heme protein[J].Science,1988,242(4884):1412-1415.

