坛紫菜游离氨基酸的检测分析及一种未知成分的结构鉴定
荣 辉 , 林祥志 *, 王龙梅 ,2
(1.国家海洋局 第三海洋研究所,福建 厦门 361005;2.厦门大学 生命科学学院,福建 厦门 361005)
紫菜在世界上养殖面积大、产量高、技术成熟、经济效益好,是食用较普遍的海藻,它的保健和药用价值已逐步为人们所接受和认识,众多潜在利用价值也正在被科学工作者逐步揭示[1-4]。紫菜富含人类必须的氨基酸,其他氨基酸的含量也较大且种类繁多[5-6]。紫菜氨基酸包括总氨基酸和游离氨基酸两大类,总氨基酸由紫菜蛋白质经过酸、碱或酶水解而来,游离氨基酸以游离态存在于紫菜细胞内和细胞间,可通过浸提提取出来[7]。近些年来,随着海藻氨基酸的广泛应用,氨基酸的检测分析水平也在不断提高。作者分别用薄层层析、离子色谱及PITC(异硫氰酸苯酯)-HPLC柱前衍生反相高效液相色谱法对坛紫菜(Porphyra haitanensis)游离氨基酸粗提液进行检测分析研究,并对其中一种含量较高的未知成分进行了结构鉴定。
1 材料与方法
1.1 实验材料
坛紫菜:采自中国福建沿海,经60℃烘箱干燥后粉碎待用。
1.2 试剂及仪器
氨基酸混合标准品:Sigma公司;PITC:异硫氰酸苯酯,Sigma公司;乙腈、正己烷、甲醇等:均为色谱纯;HCl:优级纯;其他试剂均为分析纯。
高效液相色谱仪:日本岛津,LC-20A;半制备高效液相色谱仪:日本岛津,LC-8A;离子色谱仪:美国戴安ICS-3000;核磁共振仪:美国Bruker,Metcurty-400;红外光谱仪:美国 Bruker,VERTEX 70;高分辨质谱仪:美国Waters,LCT Premier XE等。
1.3 坛紫菜游离氨基酸的分离
取一定量粉碎的坛紫菜藻粉用75%的乙醇(料液比为1∶5)浸泡24 h,然后40℃超声提取30 min,共3次。旋转蒸发浓缩至无乙醇(40℃下),将水相用3倍体积的乙酸乙酯萃取3次,留水相。将水相浓缩至一定体积,过阳离子交换树脂,收集3 mol/L氨水洗脱液,浓缩至干,用0.1 mol/L HCl定容,待检测分析。
1.4 薄层层析
将坛紫菜游离氨基酸粗提液以展开剂正丁醇-冰乙酸-水(3∶1∶1,v/v)上行展开,取出层析板,用电吹风吹干,喷上茚三酮乙醇溶液,注意喷洒均匀,然后置于110℃烘箱烘干显色。
1.5 离子色谱检测分析
色谱柱:戴安阴离子交换柱,包括分析柱(2 mm×250 mm) 和保护柱 (2 mm×50 mm); 流速为0.25 mL/min; 进样量 25 μL; 柱温为 30 ℃;250 mmol/L NaOH水溶液、1 mol/L NaAc水溶液和去离子水作为淋洗液进行梯度淋洗。
1.6 PITC-HPLC柱前衍生反相高效液相色谱法检测
1.6.1 色谱条件 色谱柱:Inertsil ODS-SP C18(5 μm×250 mm×4.6 mm);柱温 38 ℃;SPD-M20A 检测器,检测波长254 nm;进样量10 μL。流动相A:0.1 mol/L醋酸钠(用冰乙酸调pH值为6.5)-乙腈(体积比 97∶3)的溶液;流动相 B:乙腈-水(体积比 4∶1)的溶液。 线性洗脱程序:0.0 min,0%B;13 min,7%B;23 min,23%B;29 min,35%B;35 min,40%B;40 min,100%B;45 min,100%B;47 min,0%B。 流速为1.0 mL/min。
流动相A的配制:3 g醋酸钠溶解在370 mL水中,用冰乙酸调至pH 6.5,加入28 mL乙腈,用0.45 μm的滤膜过滤。
1.6.2 对照品混合溶液和样品的衍生 取对照品混合溶液或样品200 μL置于离心管中,加入0.1 mol/L PITC-乙腈 (36 μL PITC和2.164 mL乙腈混合)溶液 100 μL,1.0 mol/L 三乙胺-乙腈(417 μL 三乙胺和2.583 mL乙腈混合)溶液100 μL,混匀,室温下放置1 h后加入400 μL正己烷,漩涡混合器振荡1 min,静置10 min。用移液器吸取下层溶液,经0.22 μm滤膜过滤后进样进行色谱分析。
1.7 未知成分的制备分离
为确定检测到的未知成分的结构,采用半制备型高效液相色谱仪对衍生后的游离氨基酸粗提物进行制备分离。收集到的目标产物浓缩后,经不加醋酸钠的流动相再次分离,除去盐后经旋转蒸发器除去有机溶剂,再进行冷冻干燥,收集样品待结构鉴定。
色 谱 柱 :Shim-Pack PRC-ODS (20 cm×250 cm);SPD-20A检测器,检测波长254 nm;进样量5 mL。流动相A:0.1 mol/L醋酸钠(用冰乙酸调pH值为6.5)-乙腈(体积比 97∶3)的溶液;流动相 B:乙腈-水(体积比 4∶1)的溶液。 线性洗脱程序:0.0 min,0%B;13 min,7%B;23 min,23%B;29 min,35%B;35 min,40%B;40 min,100%B;45 min,100%B;47 min,0%B。流速为 18 mL/min。
1.8 未知成分的结构鉴定
将制备分离到的高纯化合物样品分别进行核磁共振波谱、高分辨质谱、红外光谱分析以确定其结构。
2 结果与分析
2.1 坛紫菜游离氨基酸的分离
坛紫菜粉末先经乙醇超声提取,再经乙酸乙酯萃取,最后经阳离子交换树脂层析除去大量的蛋白质、脂质、多糖等,所收集的3 mol/L氨水洗脱组分经茚三酮乙醇溶液显色反应后发现,其含有高浓度的氨基酸组分。此分离方法运用有机溶剂和超生萃取相结合的方式,减少了提取时间,且增加了提取效果。
为筛选出一种快速、方便、准确的游离氨基酸粗提液检测分析方法,随后分别利用薄层层析、离子色谱及PITC-HPLC三种不同检测方法对其进行检测分析并进行了比较。
2.2 薄层层析
坛紫菜游离氨基酸粗提液通过薄层层析实验可以看出其包含多种氨基酸,经计算Rf值均在0.35~0.75之间,表明所选溶剂系统正丁醇-冰乙酸-水(体积比3∶1∶1)能较好的分离多种不同氨基酸组分,其薄层层析图见图1。通过与标准品对比发现有几种未知成分的存在。 但从图中也可看出,由于样品所含氨基酸种类丰富,薄层层析的分辨率有限,导致有些氨基酸成分并未完全分开。

图1 坛紫菜氨基酸粗提液薄层层析图Fig.1 Free amino acids from the crude extracts of Porphyra haitanensis by thin layer chromatography
2.3 离子色谱检测
坛紫菜游离氨基酸粗提液经离子色谱检测并与氨基酸混合标准品离子色谱检测结果比较分析后,发现坛紫菜游离氨基酸粗提液中除含有多种组成蛋白质的氨基酸外,还含有5种未知成分,在已知蛋白质氨基酸中精氨酸、丙氨酸、谷氨酸的含量较高,为主要氨基酸成分。标准样品及坛紫菜粗提样品的离子色谱图分别见图2和图3。离子色谱与薄层层析相比,分辨率、准确度都较大的提高,但所用仪器昂贵、检测费用较高,且不能制备分离所需具体组分。
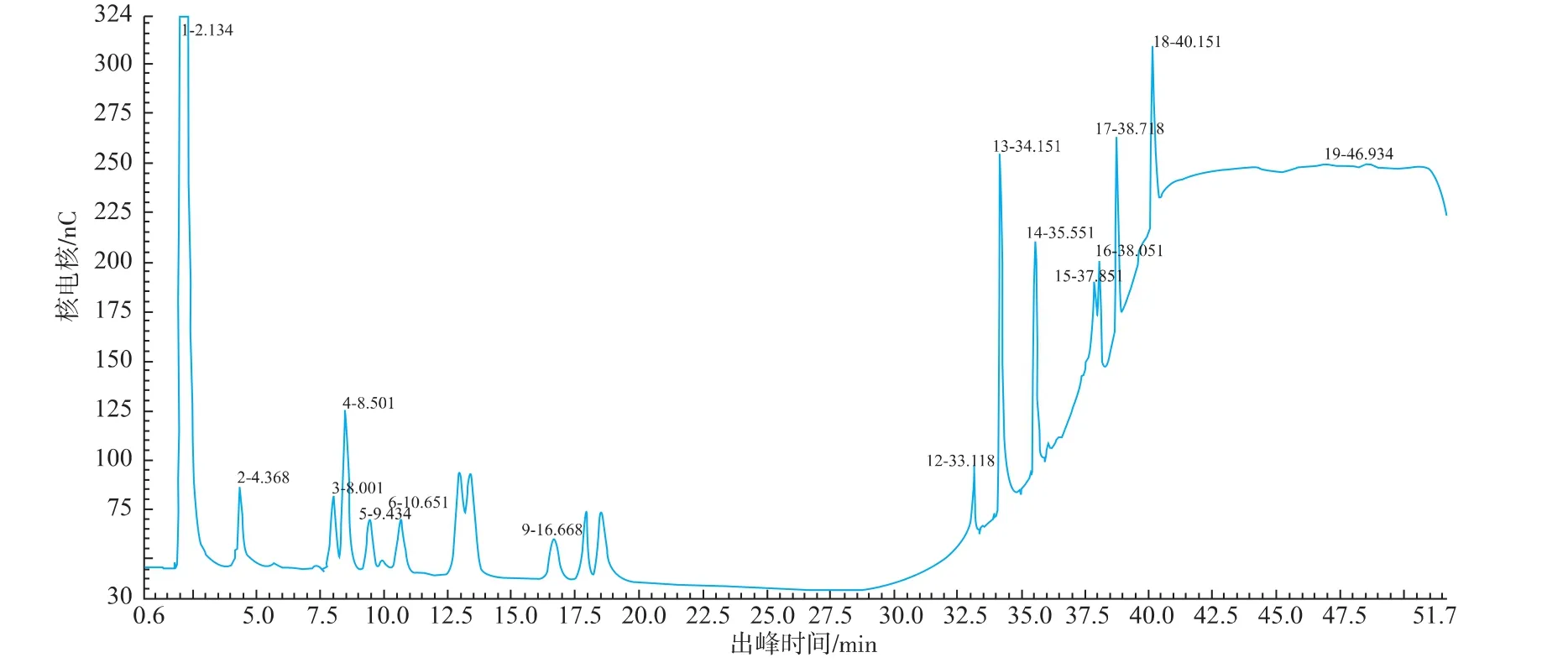
图2 混合标样离子色谱图Fig.2 Mixed standard sample of amino acids by ion chromatography

图3 坛紫菜样品离子色谱图Fig.3 Chromatogram of the sample Porphyra haitanensis by ion chromatography
2.4 PITC-HPLC检测
2.4.1 检测结果 坛紫菜游离氨基酸粗提液通过与混合标准品液相色谱比较分析发现,其中除了组氨酸外,还包含16种其他常见蛋白质氨基酸及5种未知成分,在已知蛋白质氨基酸中精氨酸、丙氨酸、天冬氨酸、谷氨酸的含量较高,采用面积归一法计算其质量分数分别为22.81%、21.69%、7.86%,7.1%,其他常见蛋白质氨基酸质量分数均小于4%,其中一种未知成分质量分数较高,达到7.5%。标准样品及坛紫菜粗提样品的液相色谱图分别见图4和图5。

图4 混合标样液相色谱图Fig.4 Chromatogram of the mixed standard samples by PITC-HPLC
PITC-HPLC法虽然需要将样品先进行柱前衍生,但与其它柱前衍生法相比,其衍生过程简便,衍生物齐全,而衍生物的高灵敏度、高稳定性,使各种氨基酸质量分数的检测结果更加准确可靠,而与离子色谱法相比其费用较低。为进一步证明PITCHPLC法是一种快速、准确、有效的检测方法,还进行了此法的线性分析、精密度、重复性、稳定性和回收率试验。
2.4.2 线性关系分析 分别取 100、50、25、10、5 μL的对照品混合氨基酸标准溶液,使其按照上述方法进行衍生,以各种氨基酸峰面积Y为纵坐标,氨基酸实际浓度X为横坐标,进行线性回归分析。结果表明,17种氨基酸在0.078~1.25 mol/L范围内与峰面积比具有良好的线性关系。氨基酸混合标准品中每种氨基酸的线性回归方程见表1。
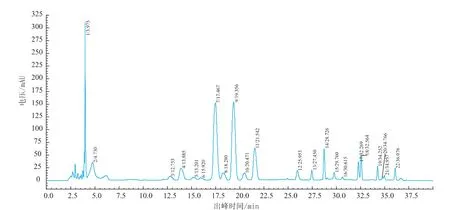
图5 坛紫菜样品液相色谱图Fig.5 Chromatogram of the sample Porphyra haitanensis by PITC-HPLC

表1 17种氨基酸的线性回归方程Table 1 Linear regression equations of 17 kinds of amino acids
2.4.3 方法的精密度、重复性及稳定性试验 取对照品溶液200 μL,按照上述方法衍生后连续进样5次,以色谱峰峰面积为指标计算RSD,考察其精密度,17种氨基酸标准溶液的精密度试验RSD在0.20%~2.49%(n=5),均在允许范围内;取对照品溶液 200 μL 按照上述方法衍生后分别在 0、4、8、12、24、48、56 h进样,以色谱峰峰面积为指标计算RSD,考察其稳定性,17种氨基酸标准溶液的稳定性试验RSD在0.31%~1.31%(n=7),均在允许范围内;取同一批坛紫菜样品5份,按上述方法提取、衍生、测定,以色谱峰峰面积为指标分别计算RSD,考察方法的重复性,坛紫菜所含各种氨基酸峰面积的RSD在0.75%~2.03%,同样均在允许范围内。
2.4.4 回收率试验 吸取已知浓度的坛紫菜样品100 μL,准确加入氨基酸混标 100 μL,按照上述方法分别衍生、进样,外标法定量,如此平行5次,计算各氨基酸的回收率和相对标准偏差,平均回收率在81.50%~101.82%,相对标准偏差在0.46%~2.85%,均在允许范围内。
2.5 制备分离
在5种未知成分衍生物中,四种由于浓度过低而未进行制备分离,最终采用半制备高效液相色谱系统制备分离到其中一种浓度较高的未知衍生成分TZC,其制备分离HPLC色谱图见图6,TZC的出峰时间为24.4 min。收集未知成分经无盐流动相除盐后旋转蒸发除去有机溶剂,再经真空冷冻干燥后TZC为白色絮状固体。
2.6 结构鉴定
分离获得的TZC是衍生剂异硫氰酸苯酯(PITC)与坛紫菜样品某一成分通过衍生反应生成的衍生物,其反应方程式如下:
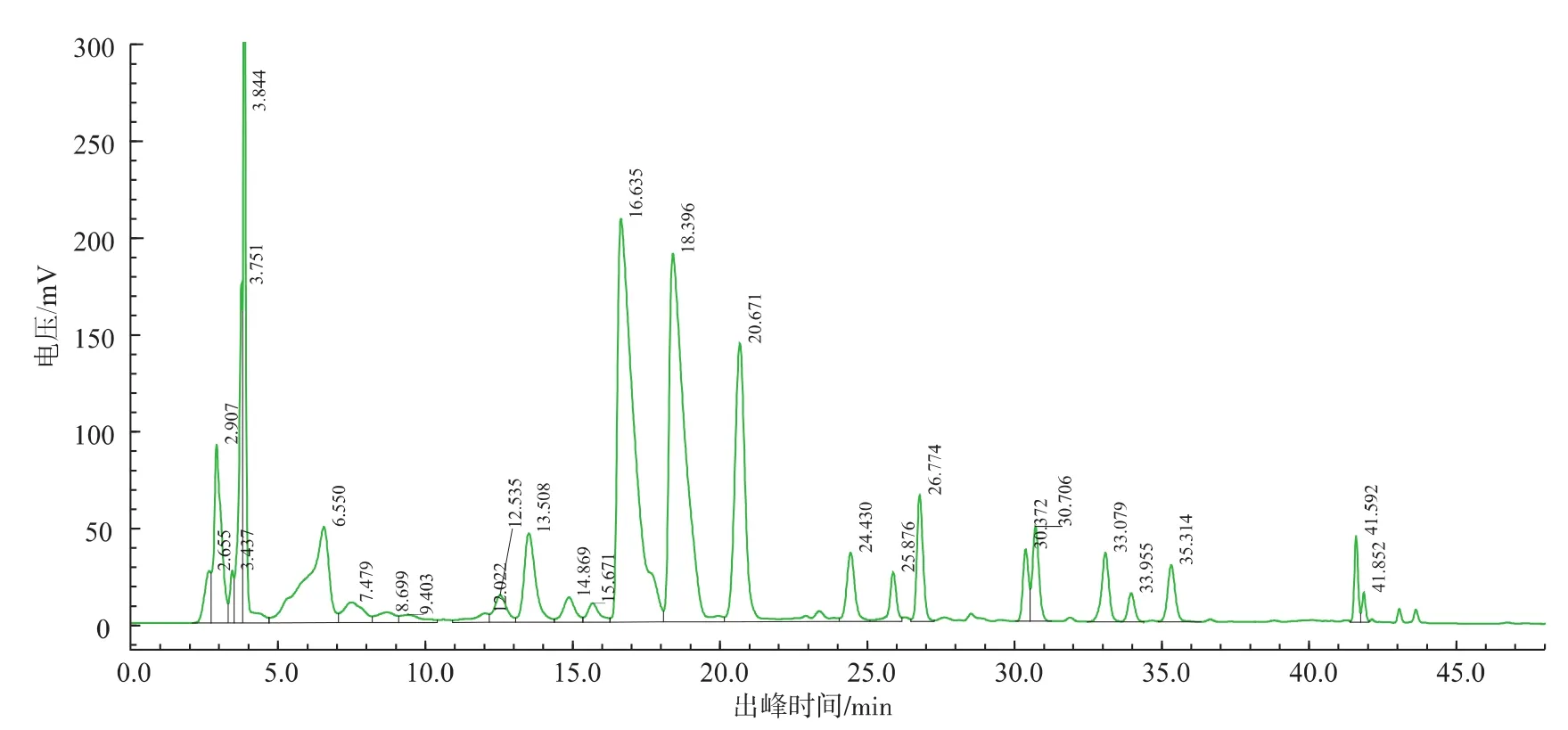
图6 TZC(24.4 min)的HPLC制备分离图Fig.6 Separation of TZC(24.4 min)by PITC-HPLC

通过红外光谱、高分辨质谱、核磁共振波谱分析,对TZC的结构进行鉴定。TZC为白色絮状固体,IR (KBr) υ (cm-1):3361 (NH2),3181 (COOH),1541,1303,924(Ph),1053(C=S);TOF-MS-ESI m/z(%):197.1008[M+H]+;1H-NMR(400 MHz,MeOD)δ:7.43-7.30 (m,4H),7.26-7.19 (m,1H),3.71(br,4H);13C-NMR (100 MHz,MeOD) δ:182.3,139.4,130.4,127.1,125.8,61.4,47.9。 结合核磁共振波谱、高分辨质谱、红外光谱数据,最终推测TZC去掉已知取代基团PITC后的成分为乙醇胺,它的分子式为C2H7NO,相对分子质量为61.08,其分子结构式如图7。

图7 乙醇胺Fig.7 Ethanolamine
3 结语
目前用于氨基酸分离纯化的方法有沉淀法、膜分离法、萃取法以及离子交换法等,其中以离子交换法应用最为广泛。该法根据氨基酸是两性电解质这一特性,以及目的氨基酸与杂质氨基酸pK、pI值的差异,利用离子交换树脂对各种氨基酸吸附能力的不同进行分离纯化[8-9]。作者采用Dowex 50W-X8型阳离子交换树脂对坛紫菜游离氨基酸粗提样品进行分离,收集高浓度氨水洗脱液,经检测发现分离效果较好,含有多种氨基酸组分。
近些年来,随着氨基酸的广泛应用,用液相色谱法检测氨基酸的分析水平也不断提高,柱前衍生是先将氨基酸转化成衍生物,再进行色谱分离的一种衍生方法,与柱后衍生法相比,具有操作简便、快速,灵敏度高的特点,并在短时间内能分离20多种氨基酸,针对各种衍生剂的研究与开发,目前应用广泛的方法有异硫氰酸苯酯(PITC)法、邻苯二甲醛-巯基乙醇(OPA)法、6-氨基喹啉基-N-羟基-琥珀酰亚胺基甲酸酯(AQC)法等[10-12]。作者分别利用三种不同的检测方法对坛紫菜游离氨基酸粗提样品进行检测分析,发现其中除含有多种常见组成蛋白质氨基酸外,还含有5种未知成分。但就方法本身来看,薄层层析法简单快速,价格低廉,但是分辨率不高,有些氨基酸组分分不开,只能作为初步的定性分析。离子色谱检测法虽然不需要对样品进行衍生化处理,快速且灵敏度高,但所用仪器昂贵,检测费用较高。而PITC-HPLC法与其它柱前衍生法相比,其衍生过程简便,衍生物齐全且具有高灵敏度、高稳定性,使各种氨基酸质量分数的检测结果更加准确可靠,而与离子色谱法相比其费用较低,因此PITC-HPLC法不失为一种快速、简单、经济的方法。由于本实验所用的氨基酸标准品(Sigma)仅为17种常见蛋白质氨基酸混合品,缺乏20种常见氨基酸中的天冬酰胺、谷氨酰胺、色氨酸,因此其他5种未知成分还需进一步分离纯化来确定,但因其他4种质量分数过低,最终只分离获得其中一种未知成分并做结构鉴定,结果为乙醇胺,并非是先前预测的氨基酸。这提醒我们能与茚三酮、PITC反应的不只是氨基酸,也可能是醇胺或其他物质如小肽等,在利用上述方法进行氨基酸检测分析时需给予考虑。
作者从坛紫菜中发现天然游离的乙醇胺成分并鉴定了其结构。据报道坛紫菜的特征挥发性物质中有一部分是醇类物质[13-14],乙醇胺在生物体内参与重要的代谢调节过程。在生物体内丝氨酸脱去一分子CO2生成乙醇胺,乙醇胺在乙醇胺激酶的作用下生成磷酸乙醇胺,磷酸乙醇胺在磷酸乙醇胺胞苷酰转移酶的作用下脱去PPi生成胞苷二磷酸乙醇胺(CDP-乙醇胺),在真核细胞中,脑磷酯是由CDP-乙醇胺和1,2-甘油二酯直接作用生成的[15-16]。乙醇胺有着重要和广泛的应用,它主要用作合成树脂和橡胶的增塑剂、硫化剂、促进剂和发泡剂,以及农药、医药和染料的中间体,也是合成洗涤剂、化妆品的乳化剂等的原料[17]。我们的研究为更好的开发利用坛紫菜提供了新的方向。
[1]林增善.紫菜的营养、保健作用和潜在利用价值[J].科学养鱼,2002(1):55-56.LIN Zengshan.Nutrition,health function and potential utilization value of seaweed[J].Scientific Fish Farming,2002(1):55-56.(in Chinese)
[2]俞静芬,朱满达,凌建刚,等.紫菜加工研究进展[J].农产品加工,2011(2):78-80.YU Jingfen,ZHU Manda,LING Jiangang,et al.Advances in processing of seaweed[J].Farm Products Processing,2011(2):78-80.(in Chinese)
[3]LIU L,WEI Y X,LIU Q,et al.Preliminary purification and influencing factors of antimicrobial polypeptides from Porphyra haitannsis[J].Progress in Modern Biomedicine,2011,11(3):476-481.
[4]刘淑集,王茵,吴成业,等.坛紫菜降血压活性肽的分离纯化及分子质量测定[J].食品科学,2011,32(2):213-217.LIU Shuji,WANG Yin,WU Chengye,et al.Isolation,purification and molecular weight determination of antihypertensive peptides derived from Porphyra haitanesis[J].Food Science,2011,32(2):213-217.(in Chinese)
[5]陈必链,林跃鑫,黄键.坛紫菜的营养评价[J].中国海洋药物,2001(2):51-53.CHEN Bilian,LIN Yuexin,HUANG Jian.Nutritional evaluation of porphyra haitanensis[J].Chinese Journal of Marine Drugs,2001(2):51-53.(in Chinese)
[6]XIE C L,HUANG J,SUN B,et al.Chemical composition of Porphyra haitanensis(Rhodophyta,Bangiales) in Chinav[J].Chinese Journal of Marine Drugs,2009,28(1):29-35.
[7]史修周,陈昌生,谢潮添,等.坛紫菜氨基酸提取工艺影响条件的优化与分析[J].台湾海峡,2011,30(1):132-137.SHI Xiuzhou,CHEN Changsheng,XIE Chaotian,et al.Optimization and analysis of Porphyra haitanensis amino acid extraction methods[J].Journal of Oceanography in Taiwan Strait,2011,30(1):132-137.(in Chinese)
[8]武彩莲,郭长江.离子交换法与氨基酸的分离纯化[J].氨基酸和生物资源,2005,27(4):50-53.WU Cailian,GUO Changjiang.Separation and purification of amino acids by ion exchange[J].Amino Acids&Biotic Resources,2005,27(4):50-53.(in Chinese)
[9]ZHOU Z Y,SHI G Q,FONTAINE R,et al.Evidence for the natural toxins from the mushroom Trogia venenata as a cause of sudden unexpected death in Yunnan province,China[J].Angewandte Chemie International Edition,2012,51:1-4.
[10]梁卫青,魏克民,浦锦宝,等.柱前衍生高效液相色谱法测定蚕蛹提取物中氨基酸含量[J].医学研究杂志,2008,37(8):42-45.LIANG Weiqing,WEI Kemin,PU Jinbao,et al.Determination of amino acids in silkworm extract by high performance liquid chromatography with precolumn derivatization[J].Journal of Medical Research,2008,37(8):42-45.(in Chinese)
[11]KUO Y H,ROZAN P,LAMBEIN F,et al.Effects of different germination conditions on the contents of free protein and nonprotein amino acids of commercial legumes[J].Food Chemistry,2004,86:537-545.
[12]赵庆喜,薛长湖,徐杰,等.反相高效液相色谱-柱后衍生法分析检测鱿鱼中的生物胺[J].食品与生物技术学报,2007,26(3):14-19.ZHAO Qingxi,XUE Changhu,XU Jie,et al.Determination of biogenic amines in squid by reversed phase high-performance liquid chromatography and post-column derivatization[J].Journal of Food Science and Biotechnology,2007,26 (3):14-19.(in Chinese)
[13]胡传明,徐继林,朱建一,等.紫菜特征挥发性物质分析[J].海洋科学,2011,35(5):106-111.HU Chuanming,XU Jilin,ZHU Jianyi,et al.Characteristic volatile matters in Porphyra (Bangiales) [J].Marine Sciences,2011,35(5):106-111.(in Chinese)
[14]汪秋安.海藻等水产品的香气成分分析[J].海洋科学,1997,2:26-29.WANG Qiuan.Analysis of flavourin seafoods[J].Marine Sciences,1997,2:26-29.(in Chinese)
[15]李丹,尹辉,张毅,等.植物的磷酸乙醇胺甲基转移酶[J].植物生理学通讯,2007,43(5):949-953.LI Dan,YIN Hui,ZHANG Yi,et al.Plant phosphoethanolamine N-methyltransferase[J].Plant Physiology Communications,2007,43(5):949-953.(in Chinese)
[16]吕俊,吕灿群.豚鼠组织中缩醛磷脂酰乙醇胺生物合成能力的比较[J].皖南医学院学报,2008,27(1):16-21.LU Jun,LU Canqun.Biosynthesis power of phosphatidal-ethanolamine in guinea pig tissues[J].Acta Academiae Medicinae Wannan,2008,27(1):16-21.(in Chinese)
[17]范存良.乙醇胺的反应与分离技术[J].化学工业,2009,27(6):46-49.FAN Cunliang.Production and purification process of ethanolamines[J].Chemical Industry,2009,27(6):46-49.(in Chinese)

