非天然磷酰化氨基酸对胰蛋白酶的荧光猝灭效应
符芳妮 , 张 晖 , 邓少平 , 陈丽春 *,2
(1.浙江工商大学 食品与生物工程学院,浙江 杭州 310012;2.浙江科技学院 生物与化学工程学院,浙江 杭州310023)
胰蛋白酶(Trypsin)是一种广泛分布于生物体内的特异性最强的蛋白水解酶,在食品加工、细胞培养、临床医学等众多领域具有重要-的应用[1-2]。在食品加工技术中,酶法技术能够用于食品蛋白质的改性[3-4],例如,胰蛋白酶已经广泛用于改善食品物理化学性质、提高食品功能性质、延长货架期、增加营养特性。国内外关于有机小分子物质与蛋白酶的相互作用已有很多研究[5-9]。目前,清华大学赵玉芬研究小组关于天然磷酰化氨基酸与生物大分子物质的相互作用已有[10],但是,非天然氨基酸磷酰化前后对蛋白质(胰蛋白酶)结构影响的应用基础研究还未有报道,发现并研究新的有机物质满足各个领域的需求已成为需要解决的一个问题。
N-磷酰化氨基酸(N-phosphoryl amino acid)是在天然-α-氨基酸的氨基上引入磷酰基团[11]。作者在磷酰化氨基酸具有生物活性的基础上[11],利用荧光光谱法进一步研究非天然脂肪酸链磷酰化氨基酸与胰蛋白酶的相互作用,以期深入探究非天然脂肪酸链磷酰化氨基酸在抑制胰蛋白酶活性方面的作用性质。为了研究非天然氨基酸的磷酰化对胰蛋白酶结构的影响,作者自主设计并合成了4种侧链长度不同的非天然脂肪酸链磷酰化氨基酸,用荧光法比较了非天然脂肪酸链氨基酸磷酰化前后对胰蛋白酶结构的影响,对浓度、侧链长度不同的磷酰化氨基酸对胰蛋白酶荧光猝灭的影响等进行研究。为探索和开发酶活性调节物提供了基础,也为蛋白质结构与功能的研究提供了思路,有利于进一步研究磷酰化氨基酸对胰蛋白酶活性的调节作用及可能的机制。
1 材料与方法
1.1 材料与仪器
试剂:L-2-氨基戊酸、L-2-氨基庚酸、L-2-氨基辛酸、L-2-氨基壬酸:质量分数均为98.5%,购于上海滨海瀚鸿生化有限公司;胰蛋白酶:购于吉诺生物医药技术有限公司;Tris-HCl缓冲溶:杭州汇普化工有限公司;核磁试剂(CDCl3):购于Sigma公司;三乙胺、乙醇、四氯化碳、亚磷酸二异丙酯:均为市售分析纯试剂;超纯水。
仪器:500AVANCE III型核磁共振波谱仪,德国 Bruker公司;Therm LCQ TM Deca XP plus离子阱质谱仪:美国Thermo公司;三维荧光光谱仪(F-7000):日本日立公司;RE-52c旋转蒸发仪:巩义市英峪予华仪器厂;DF-101 Z集热型磁力搅拌器:郑州长城科工贸有限公司;制冰机:日本SANYO SIMF140公司;电热恒温水槽:上海精宏实验设备有限公司;B0500891型去离子超纯水仪:美国Millipore公司。
1.2 实验方法
1.2.1 非天然氨基酸的磷酰化与结构表征 合成方法采用赵玉芬院士研究小组的亚磷酸二异丙酯四氯化碳水相合成法[12-14]。以L-2-氨基戊酸、L-2-氨基庚酸、L-2-氨基辛酸、L-2-氨基壬酸为底物,亚磷酸二异丙酯(DIPPH)为磷酰化试剂。合成路线如下:

4种分子的结构式分别为

产物结构经1H NMR鉴定,结果见表1。
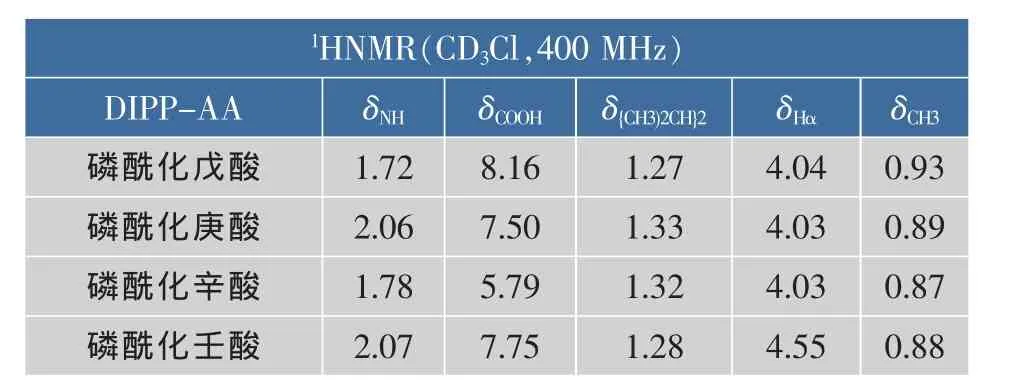
表1 N-二异丙氧磷酰化氨基酸的1H NMR化学位移Table 1 1H NMR chemical shift of NIPP-AA
经ESI--MS鉴定,结果见图1。


图1 ESI--MS分析谱图Fig.1 Spectra of ESI--MS
4种磷酰化氨基酸的理论相对分子质量分别为281.29、309.34、323.37、337.39。 质谱图中显示的质荷比 280.1、308.2、322.2、336.2 分别为产物的分子离子峰,检测电离源为ESI-,说明产品中有DIPPL-2-NH2-戊酸、庚酸、辛酸、壬酸。同时,图1杂峰很少,主峰突出,能够确定合成产物为目标产物。
1.2.2 溶液的配制 室温下取Tris-HCl缓冲溶液,配制0.25%胰蛋白酶溶液。500 V扫描电压,波长扫描范围为300~400 nm,发射与激发狭缝为5、5 nm,于5 mL样品池中加入样品,测其荧光光谱。
室温下取Tris-HCl缓冲溶液配制相同浓度的胰蛋白酶溶液6个样品,恒温水浴槽温度分别设为25、30、35、40、45、50 ℃,将 6 个样品分别放入水浴槽中达到相应的温度。保持温度恒定,扫描电压为500 V,固定激发波长λex为280 nm,发射与激发狭缝为 5、5 nm。
室温下分别配制3 mmol/L的L-2-氨基戊酸、庚酸、辛酸及壬酸溶液。向3 mmol/L的L-2-氨基戊酸、庚酸、辛酸及壬酸溶液中依次加入相同体积的已配制的胰蛋白酶溶液。以胰蛋白酶溶液为空白作对照测荧光强度。荧光光谱的扫描参数同上。
室温下取超纯水分别配制3 mmol/L的N-磷酰化L-2-氨基戊酸、庚酸、辛酸及壬酸溶液。向3 mmol/L的N-磷酰化L-2-氨基戊酸、庚酸、辛酸及辛酸溶液中依次加入相同体积的胰蛋白酶溶液。以胰蛋白酶溶液为空白作对照测荧光光谱。荧光光谱的扫描参数同上。
25 ℃分别配制 1、3、6、8、10、12、15 mmol/L 的磷酰化庚酸溶液,分别加入相同体积的胰蛋白酶溶液,在恒温水浴槽中保持恒温。以胰蛋白酶溶液为空白对照测荧光光谱。荧光光谱的扫描参数同上。
2 结果与分析
2.1 胰蛋白酶的荧光特性
胰蛋白酶具有荧光特性,图2为0.25%胰蛋白酶溶液的三维荧光光谱。可以看出,当激发波长λex=280 nm时,在发射波长λem=335 nm附近有较强的荧光信号。

图2 25℃时0.25%胰蛋白酶溶液的三维荧光光谱图Fig.2 Tridimensional fluorescence spectrum of 0.25%trypsin
2.2 温度对胰蛋白酶荧光发射光谱的影响
众所周知,蛋白质遇热会变性,通常蛋白质的最大激发波长在280 nm左右。
表2为胰蛋白酶溶液在温度分别为25、30、35、40、45、50℃时的荧光强度及发射波长。胰蛋白酶在25~40℃时,其最大发射波长并没有发生明显的位移,说明温度从25℃升高到40℃时,仅仅是胰蛋白酶的荧光强度发生变化,并没有引起其构型的改变。但是当温度超过40℃时,其发射波长有稍微的偏移,荧光强度也发生了变化,所以可以预测温度大于40℃时,胰蛋白酶的构型会发生部分的改变。选择温度25℃,避免温度对胰蛋白酶结构的影响。

表2 温度对胰蛋白酶荧光发射光谱的影响Table2 Effectoftemperatureon thefluorescence spectrum of trypsin
2.3 非天然脂肪酸链氨基酸磷酰化前后与胰蛋白酶的相互作用
图3显示了4种相同浓度的非天然脂肪酸链氨基酸(即L-2-氨基戊酸、庚酸、辛酸、壬酸)存在时胰蛋白酶溶液的荧光强度值。4种非天然氨基酸本身没有荧光特性,不会对实验结果产生干扰。从图3可以看到,L-2-氨基戊酸、庚酸、辛酸存在时,胰蛋白酶溶液的荧光强度基本没有发生变化,说明这3种非天然氨基酸并不能使胰蛋白酶的荧光强度减弱。L-2-氨基壬酸存在时,胰蛋白酶的最大荧光强度从1 680降低到1 570,但总体而言胰蛋白酶的荧光强度并没有明显减弱。并且胰蛋白酶的发射波长没有发生偏移,因此,L-2-氨基戊酸、庚酸、辛酸及壬酸4种非天然氨基酸对胰蛋白酶的荧光基本不存在猝灭效应,并且随着氨基酸侧链碳原子数的增加,不会对胰蛋白酶的荧光强度产生影响。

图3 25℃时4种氨基酸存在时0.25%胰酶的荧光发射光谱Fig.3 Fluorescence intensity of 0.25%trypsin solution(c=3 mmol/L)in the presence of four non-natural amino acids
为了研究4种非天然氨基酸磷酰化后对胰蛋白酶的作用,考察了相同浓度的4种非天然氨基酸及其衍生的非天然脂肪酸链磷酰化氨基酸分别对胰蛋白酶荧光强度的影响,见图4。4种磷酰化氨基酸本身没有荧光性,对实验不存在干扰。图3与图4相比,3 mmol/L的L-2-氨基戊酸、庚酸、辛酸、壬酸对胰蛋白酶荧光没有猝灭效应,但3 mmol/L的磷酰化氨基酸能够使胰蛋白酶溶液的荧光强度明显降低。由此表明,磷酰基的引入显著改变了非天然氨基酸的分子的性质。

图4 25℃0.25%胰蛋白酶溶液在4种非天然氨基酸分子及4种N-磷酰化氨基酸存在时的荧光强度值Fig.4 Fluorescence intensity of 0.25%trypsin solution in the presence of different molecules at 25℃
图5为0.25%胰蛋白酶的荧光强度随4种相同浓度、不同侧链长度的N-磷酰化氨基酸的变化图。从图5可以看出,4种磷酰化氨基酸侧链长度不同,对荧光强度的猝灭效应也不同。随着磷酰氨基酸侧链碳原子数目的增加,胰蛋白酶溶液的荧光强度逐渐降低。空白的胰蛋白酶的荧光强度为2 549,荧光猝灭后的荧光强度则分别变为2 149、2 078、1 897、1 682。从而说明,磷酰化氨基酸的侧链长度能够对胰蛋白酶的荧光强度产生影响。
2.4 不同浓度的磷酰化庚酸与胰蛋白酶的荧光猝灭作用
图6(a)中,胰蛋白酶溶液的荧光强度随着N-磷酰化庚酸的浓度的增大而不断降低。N-磷酰化庚酸对胰蛋白酶溶液有明显的荧光猝灭效应。由于4种N-磷酰化氨基酸只是侧链长度不一样的氨基酸,其他结构均相同,因此可知,其它N-磷酰化戊酸、辛酸、壬酸对胰蛋白酶的猝灭效应随其浓度的增加具有同样的趋势。
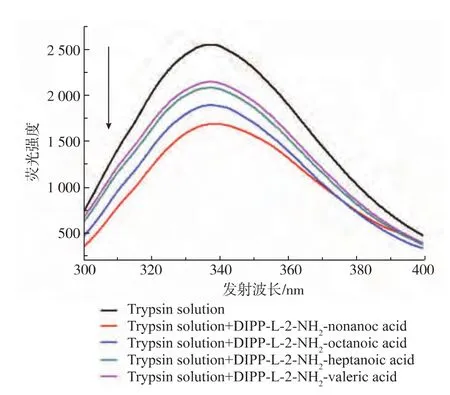
图5 25℃时4种链长不同的N-磷酰化氨基酸存在时0.25%胰酶的荧光发射光谱Fig.5 Fluorescence intensity of 0.25%trypsin solution in the presence of four new N-phosphoryl amino acids at 25℃
从图6(b)可以看出,胰蛋白酶溶液的荧光最大发射光谱在加入N-磷酰化庚酸溶液后没有发生变化,即其最大发射光谱没有随着猝灭剂浓度的增加而改变,一直在335 nm左右,仅仅是其最大荧光强度逐渐减小。其发射峰及峰型基本不变,表明其存在相互作用,由此可以说明,25℃时在N-磷酰化庚酸猝灭剂存在时,胰蛋白酶的构型并没有发生变化,是荧光猝灭剂与胰蛋白酶之间的相互作用猝灭了胰蛋白酶的荧光。


图6 25℃时不同浓度N-磷酰化庚酸与胰蛋白酶的荧光强度和发射光谱Fig.6 Fluorescence spectra oftrypsin solution as function of different concentration of DIPP-L-2-Amino heptanoic acid at 25℃
猝灭过程实际上是与发光过程相互竞争而缩短发光分子激发态寿命的过程 ,猝灭过程可能发生于猝灭剂与荧光物质的激发态之间的相互作用,也可能发生于猝灭剂与荧光物质的基态分子之间的相互作用。前一过程称为动态猝灭,后一种称为静态猝灭[15]。为了解释这个猝灭过程,按照动态猝灭的Stern-Volmer方程[16]处理,即:

F0、F分别表示未加入化合物和加入化合物后胰蛋白酶的荧光强度,ksv是动态猝灭常数,kq表示双分子猝灭过程中的速率常数,τ0为猝灭剂不存在时生物大分子的平均寿命。
25~40℃时胰蛋白酶的分子结构不变,以F0/F对c[DIPP-L-heptanoicacid]作图,作出25℃不同浓度的N-磷酰化庚酸对胰蛋白酶荧光猝灭的Stern-Volmer图,见图7。

图7 25℃时N-磷酰化庚酸与胰蛋白酶相互作用的Stern-Volmer曲线Fig.7 Stern-Volmer plot of DIPP-L-2-Amino heptanoic acid quenching effect on trypsin solution at 25℃
从图7可以看出,25℃时F0/F与磷酰化氨基酸的浓度呈良好的线性关系,线性相关系数R2=0.994。进一步说明了胰蛋白酶的荧光完全可以酰化庚酸所猝灭。结果表明,磷酰化氨基酸对胰蛋白酶荧光的猝灭是静态猝灭,磷酰化氨基酸与胰蛋白酶在基态由于亲和力的作用形成配合物降低了酶的荧光强度,从而能够对胰蛋白酶产生荧光猝灭。
3 结语
作者设计了侧链长度不同的非天然脂肪酸链磷酰化氨基酸,荧光法研究了非天然磷酰化氨基酸与胰蛋白酶的相互作用,荧光光谱结果表明,磷酰化氨基酸对胰蛋白酶能够产生荧光猝灭;非天然L-型氨基酸不能对胰蛋白酶产生荧光猝灭,并且随着磷酰化氨基酸侧链的增长,猝灭效应越明显。同时,随着磷酰化庚酸的浓度增大,荧光强度不断降低,Stern-Volmer曲线表明,胰蛋白酶溶液的荧光能够完全被猝灭。L-型氨基酸的磷酰化能够改变氨基酸的性质,使其对胰蛋白酶更具有亲和力,Stern-Volmer曲线表明,胰蛋白酶溶液的荧光可以完全被猝灭。胰蛋白酶与非天然脂肪酸链磷酰化氨基酸之间相互作用的研究有利于探索和开发酶活性调节物,也为蛋白质结构与功能的研究提供了思路,能够改善胰蛋白酶在食品、生物技术等领域的应用,但磷酰化氨基酸对胰蛋白酶的调节作用机制有待进一步研究。
[1]HU Lianzhe,HAN Shuang,Saima Parveen,et al.Highly sensitive fluorescent detection of trypsin based on BSA-stabilize gold nanoclusters[J].Biosensors and Bioelectronics,2012,32:297-299.
[2]程伟,陈红兵,高金燕,等.酶改性对食物蛋白质过敏原性的影响[J].食品科学,2010,31(23):391-394.CHENG Wei,CHEN Hongbin,GAO Jinyan,et al.A review of the effect of enzymatic modification on the allergenicity of food proteins[J].Food Science,2010,31(23):391-94.(in Chinese)
[3]Da Ren,Pipes Gary D,Liu Dingjiang,et al.An improved trypsin digestion method minimize digestion-induced modification on proteins[J].Anayltical Biochemistry,2009,392:12-21.
[4]FANG Meijuan,LUO Shuna,WANG Heqing,et al.The effect of phosphoryl oxygen on the intermolecular action of alanin and lysozyme[J].Acta Phys-Chim Sin,2005,21(9):1042-1045.
[5]XUE Wangxin,ZHANG Guanxin,ZHANG Deqing,et al.A new label-free continuous fluorometric assay for trypsin and inhibitor screening with tetraphenylethene compunds[J].Ogranic Letters,2010,12(10):2274-2277.
[6]强黎明,董雪茹,吕名秀,等.N-磷酰化肽酯及小肽与溶菌酶相互作用的ESI-MS研究[J].化学学报,2009,67(22):2607-2612.QIANG Liming,DONG Xueru,LU Mingxiu,et al.Study on the interaction between N-phosphoryl dipeptides (or methyl esters)and lysozyme by ESI-MS[J].Acta Chimica Sinica,2009,67(22):2607-2612.(in Chinese)
[7]杨冉,陈晓岚,李萍,等.荧光法研究三种黄酮小分子与溶菌酶的相互作用[J].高等学校化学学报,2006,27(9):1673-1676.YANG Ran,CHEN Xiaolan,LI Ping,et al.Study on the interactions between three flavones and lysozyme by fluorescence method[J].Chemical Journal of Chinese Universities,2006,27(9):1673-1676.(in Chinese)
[8]查隽,何华,刘铁兵,等.荧光光谱法研究共存碳纳米管对牛血清白蛋白与加替沙星相互作用的影响[J].光谱学与光谱分析,2011,31(1):149-153.CHA Jun,HE Hua,LIU Tiebin,et al.Studies on the interaction of gatifloxacin with bovine serum albumin in the presence of carbon nanotubes by fluorescence spectroscopy[J].Spectroscopy and Spectral Analysis,2011,31(1):149-153.(in Chinese)
[9]CUI Xiaodong,WANG Zhuanhua,LI Yuying,et al.Buckwheat trypsin inhibitor enters Hep G2 cells by clathrin-dependent endocytosis[J].Food Chemistry,2013,141:2625-2633.
[10]李永芳.N-磷酰化氨基酸与生物大分子的相互作用[D].北京:清华大学,1995.
[11]赵玉芬,张建臣,徐军,等.磷酰化氨基酸的特性及应用前景[J].郑州大学学报,2003,35(2):89-91.ZHAO Yufen,ZHANG Jianchen,XU Jun,et al.Properties and applications of N-phosphoryl amino acids[J].Journal of Zhenzhou University,2003,5(2):89-91.(in Chinese)
[12]CHEN Zhongzhou,TONG Yufeng,CHEN Shuibing,et al.Orientation of the peptide formation of N-phosphoryl amino acid in solution[J].Chinese Science Bulletin,2002(47):1866-1870.
[13]LIU Huachen,DONG Aijun,TAN Chunyan,et al.The design,synthesis,and anti-tumor mechanism study of N-phosphoryl amino acid modified resveratrol analogues[J].Bioorganic & Medicinal Chemistry,2008,16:10013-10021.
[14]JI Gaijiao,XUE Chubiao,ZENG Jianing,et al.Synthesis of N-(Diiopropyloxyphoryl) amino acids and peptides[J].Synthesis,1988,6(11):444-448.
[15]CHEN Zhongxiu,SU Xiaoxia,DENG Shaoping.Molecular recognition of melamine by vesicles spontaneously formed from orotic acid derived bolaamphiphiles[J].Journa of Physical Chemistry B,2011,115:1798-1806.
[16]陈晓岚,于斐,屈凌波,等.荧光及ESI质谱法研究溶菌酶与磷酰化黄酮的相互作用[J].化学学报,2004,62(2):188-193.CHEN Xiaolan,YU Fei,QU Lingbo,et al.Study on the interaction of lysozyme and diethyl flavon-7-yl phosphate by ESI-MS and fluorescence method[J].Acta Chimica Sinica,2004,62(2):188-19.(in Chinese)

