固相萃取-超高效液相色谱-串联质谱法同时测定饲料中的3 种雌激素
肖全伟 , 吴文林, 杨万林, 梁 润, 李绍波, 刘玲利
(1. 成都市产品质量监督检验院食品中心,四川 成都610100;2. 中国空军第34 师西郊场站医院,北京100195;3. 成都理工大学材料与化学化工学院,四川 成都610059)
激素类物质在动物体内一般难以降解,通过食物链进入人体后,可扰乱人体内分泌系统,导致男性女性化、男性生育能力下降、女性乳腺癌和卵巢癌发生、女性性早熟等[1-3]。我国农业部于2002 年发布的176 号公告明确规定禁止在饲料和动物饮用水中使用雌二醇、苯甲酸雌二醇和戊酸雌二醇[4]。农业部第193 号公告明确规定禁止在所有食用动物饲养中使用苯甲酸雌二醇以促生产或其他用途[5]。
为保障人类动物源性食品的安全,从饲料源头有效监控激素类物质的摄入是解决激素类物质在动物源食品中残留的有效途径之一。因此,严格控制饲料中非法添加激素物质具有重要意义。目前,大多数文献报道的激素残留检测主要针对动物源食品[6-9]和水体[10-13],关于饲料方面的报道还较少。同时,在饲料雌激素检测方面,对17β-雌二醇的检测报道较多,对苯甲酸雌二醇和戊酸雌二醇的报道甚少[14,15]。激素的检测方法主要有高效液相色谱法[15,16]、高效 液 相 色 谱-串 联 质 谱 法[17,18]、气 相 色谱-质谱联用法[19]以及酶联免疫法[20]。高效液相色谱法灵敏度较低,选择性和特异性较差,不适于雌激素痕量残留分析的要求;采用气相色谱法的前处理较为繁琐,需要对样品进行衍生化处理,耗时长;免疫分析法易出现假阳性结果,仅能测定少数几种激素;高效液相色谱-串联质谱法具有操作简便、准确度高、检出限低、特异性强等特点,为饲料中痕量雌激素物质的检测提供了较好的方法。
饲料基质本身是一种极为复杂的样品,有效的提取和净化才能保证雌激素含量的准确测定。目前还没有报道用SPE-UPLC-MS/MS 同时测定17β-雌二醇、苯甲酸雌二醇和戊酸雌二醇3 种雌激素的方法。本文通过对SPE、色谱和质谱条件的优化,建立了测定饲料中上述3 种雌激素的SPE-UPLC-MS/MS 方法,该法快速简便,线性范围宽,检出限低,准确度高,适合饲料中雌激素的检测。
1 实验部分
1.1 仪器与试剂
Acquity UPLC-Quattro Premier XE 超高效液相色谱-串联质谱仪(美国Waters 公司);Elix/Milli-Q 超纯水系统(美国Millipore 公司);Allegra X-22R 冷冻离心机(美国Beckman 公司);Promax 2020 往复式摇床(德国Heidolph 公司);N-EVAP-24 氮吹浓缩装置(美国Organomation公司);MS3 漩涡混合器(德国IKE 公司);Heaion C18固相萃取柱(500 mg/3 mL,天津市贺世科技发展有限公司)、24 位固相萃取装置(德国CNW 公司)、BS224S 电子天平(北京赛多利斯仪器系统有限公司),水相0. 22 μm 聚醚砜微孔滤膜(天津博纳艾杰尔科技有限公司)。
标准物质和同位素内标:17β-雌二醇、苯甲酸雌二醇和戊酸雌二醇(德国Dr. Ehrenstorfer 公司);13C2-17β-雌二醇(纯度99%,美国CIL 公司)。
试剂:甲醇(色谱纯,韩国SK 公司);乙腈(色谱纯,Sigma 公司);甲醇、氨水(分析纯,重庆市川东化工有限公司);乙腈(分析纯,成都市科龙化工试剂厂)。
样品:随机购买市售预混合饲料、配合饲料、浓缩饲料各10 份,每份为1 kg。
实验用水均为超纯水。
1.2 标准溶液的配制和基质匹配标准曲线
标准储备液的配制:分别准确称取适量的标准品,用甲醇溶解并定容,配制成100 mg/L 的标准储备液,于4 ℃下保存。使用时,用甲醇逐级稀释成混合标准中间液,现用现配。
基质匹配标准曲线:称取不含3 种待测物的饲料样品,按1.3 节方法操作,得到空白基质溶液。用空白基质溶液稀释标准溶液配制成一系列混合基质标准工作溶液,现用现配。
1.3 样品处理
准确称取混合均匀的饲料样品5 g(精确到0.1 mg)于250 mL 具塞三角玻璃瓶中,准确加入适量内标和25 mL 乙腈,140 r/min 振荡提取30 min,5 000 r/min 离心5 min。取上清液2 mL,并加入6 mL 超纯水稀释,混匀后通过Heaion C18固相萃取小柱(经6 mL 甲醇和6 mL 超纯水预活化),保持流速约为1 mL/min,然后用3 mL 超纯水淋洗小柱。待淋洗液流尽,减压抽干,用4 mL 甲醇洗脱,收集洗脱液在(50 ±1)℃下氮气吹干,加入1 mL 含30%(v/v)乙腈的水溶液溶解残留物,溶液经0.22 μm 聚醚砜微孔滤膜过滤,滤液上机测定。
1.4 仪器条件
色谱条件:ACQUITY UPLC BEH C18色谱柱(50 mm×2.1 mm,1.7 μm,美国Waters 公司);柱温40 ℃,流速0.3 mL/min;流动相A 为乙腈,流动相B 为0.1%氨水溶液;进样量为5 μL;梯度洗脱程序为:0 ~0.2 min,40%A;0.2 ~3.0 min,40%A ~90% A;3.0 ~4.5 min,90% A ~40% A;4.5 ~5.0 min,40%A。
质谱条件:电喷雾电离源(ESI);正离子(分析苯甲酸雌二醇)和负离子(分析17β-雌二醇、戊酸雌二醇、13C2-17β-雌二醇内标)模式;毛细管电压:正离子模式3.5 kV,负离子模式-2.9 kV;脱溶剂气温度:260 ℃;脱溶剂气流速:600 L/h;多反应监测(MRM)模式检测。
2 结果与讨论
2.1 色谱条件的优化
由于电喷雾质谱的电离过程是在溶液状态下进行,因此流动相的组成除了影响保留时间和峰形外,还会对离子化效率产生影响,最终影响目标化合物的检测灵敏度。同时一些常用的流动相物质如甲酸、乙酸为质子给予体,体积分数要求低于1%;缓冲盐乙酸铵、甲酸铵浓度要求低于10 mmol/L,所以本实验分别采用甲醇-水、乙腈-水、甲醇-0.1% (v/v)甲酸水溶液、乙腈-0.1%(v/v)甲酸水溶液、甲醇-0.1 mmol/L 甲酸铵、乙腈-0.1 mmol/L 甲酸铵、甲醇-0.1%(v/v)氨水、乙腈-0.1% (v/v)氨水作为流动相,考察各流动相体系对于3 种雌激素分离测定的影响。结果表明,采用乙腈-0.1% 氨水作为流动相,同时结合梯度洗脱程序缩短洗脱时间能得到较好分离,且3 种雌激素在质谱上的响应均较高。图1 为混合标准溶液中3 种雌激素和内标的二级质谱提取离子流图。
2.2 质谱条件的优化
分别配制3 种雌激素质量浓度为10 μg/L 的标准溶液,采用针泵进样方式直接进行质谱条件的优化。在MS/MS 状态下,以全扫描的方式观察3 种雌激素的总离子流图,选择适当的准分子离子作为母离子,并优化母离子和子离子的锥孔电压和碰撞能量,得到各物质的质谱采集参数信息见表1。结果表明,选择[M-H]-作为17β-雌二醇、戊酸雌二醇、13C2-17β-雌二醇的母离子,[M +H]+作为苯甲酸雌二醇的母离子时,3 种雌激素的响应值最高。
2.3 样品处理条件的优化
2.3.1 提取溶剂的选择
对甲醇、乙腈、甲醇-水(85∶15,v/v)、乙腈-水(85∶15,v/v)等4 种提取溶剂进行了比较,结果表明,乙腈对3 种目标物的回收率均大于90%。因此,选择乙腈作为提取溶剂。
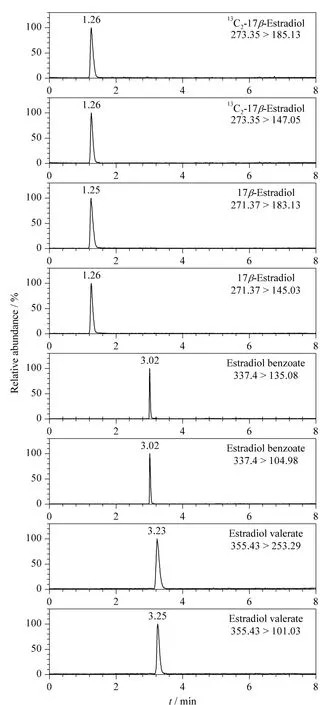
图1 3 种雌激素和内标的二级质谱提取离子流图Fig.1 MS/MS extraction ion spectra of the three exogenous hormones and the internal standard
2.3.2 固相萃取条件的优化
考察了直接提取法、分散固相萃取法(DSPE)和SPE 对3 种雌激素的回收率和净化效果。结果表明:采用SPE 时3 种雌激素的提取效率最高,且质谱图中杂质峰较少。因此,采用SPE 提取样品。
提 取 液 分 别 用 Cleanert PE、Heaion C18、Welchrom C18E 和Cleanert ODS C184 种SPE 小柱净化,比较4 种SPE 小柱对样品中3 种雌激素的回收率影响。结果表明,3 种雌激素在Heaion C18小柱上的回收率最高。
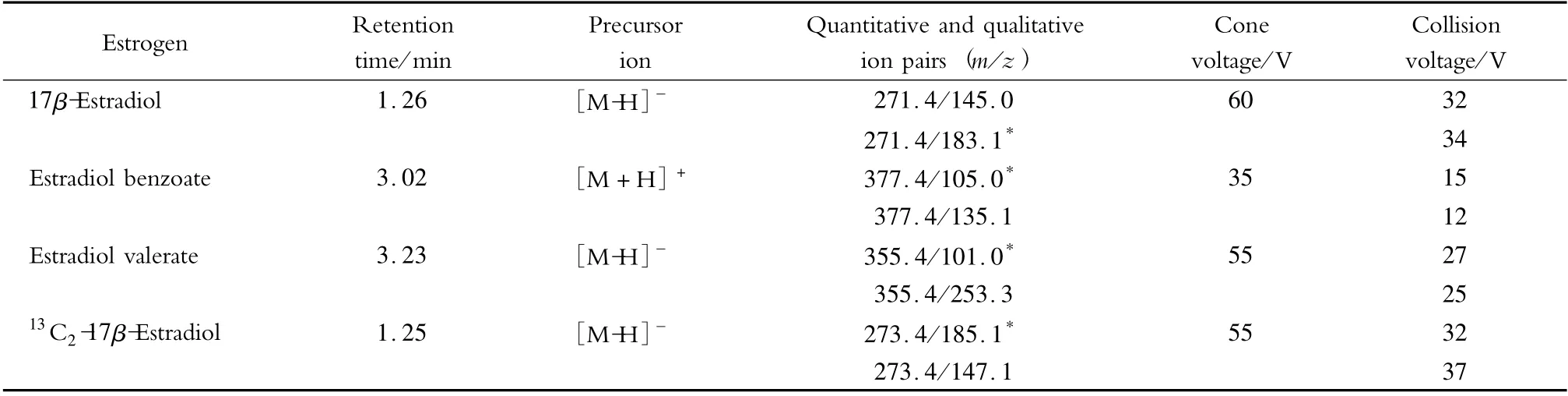
表1 多反应监测(MRM)质谱采集参数Table 1 MS acquisition parameters for multiple reaction monitoring (MRM)
选择Heaion C18作为固相萃取小柱,分别考察了乙腈和甲醇作为洗脱剂对3 种雌激素的洗脱效果。结果显示:当甲醇或乙腈作为洗脱剂时,被测物的回收率均较高,洗脱效果好。由于乙腈毒性比甲醇大,沸点较高,氮气吹干费时,因此选择甲醇作为洗脱剂。
2.4 基质效应
基质是指样品中除分析物以外的一切组分,主要来源于样品中内源性组分和样品处理后引入的杂质。基质对分析物测定的影响即为基质效应,可影响线性关系、检出限(LOD)、定量限(LOQ)等。采用标准曲线法考察了饲料样品对待测物的基质效应。实验结果表明,基质校准曲线的斜率比纯溶剂标准曲线的斜率小,即存在基质抑制效应。在样品中加入同位素内标对待测组分的提取和测定无任何干扰,且受基质成分的影响也极为相似。同位素内标不但可抵消质谱离子化时的基质效应,还可消除样品前处理过程中的差异。因此,为最大限度地消除基质效应干扰,本研究采用基质匹配标准曲线和13C2-17β-雌二醇同位素内标进行定量,可得到3种雌激素的准确可靠结果。
2.5 线性关系、检出限和定量限
称取一定量的预混合、配合和浓缩饲料的空白样品于250 mL 具塞三角玻璃瓶中,准确加入25 mL乙腈,按照1.3 节操作处理样品,得到空白基质溶液。用空白基质溶液稀释混合标准工作液,再加入适量的内标标准溶液,配制成17β-雌二醇、苯甲酸雌二醇、戊酸雌二醇质量浓度均为5、10、20、40、60、80、200 μg/L 的基质混合标准工作液,以对应的基质加标溶液浓度与内标溶液浓度比值为横坐标X,相应的待测物峰面积与内标物峰面积为纵坐标Y,绘制3 种雌二醇的内标校准曲线。以3 倍信噪比(S/N =3)确定仪器的检出限,以10 倍信噪比(S/N=10)确定仪器的定量限,结果见表2。结果表明,该方法检测3 种雌激素的线性范围宽,工作曲线线性良好,17β-雌二醇、苯甲酸雌二醇和戊酸雌二醇的检出限分别为7、5 和7 μg/kg;定量限分别为20、14和20 μg/kg,适用于饲料中3 种雌激素的测定。

表2 3 种雌激素的检出限、定量限、线性方程及相关系数Table 2 Limits of detection,limits of quantification,regression equations and correlation coefficients (r)of the three estrogens
2.6 加标回收率和精密度
在空白样品中分别添加20、40、100、200 μg/kg 4 个水平的混合标准液进行测定,以基质匹配标准曲线内标校准。按照1.3 节进行样品处理,UPLCMS/MS 测定,每个添加水平样品重复测定6 次,分别计算回收率,结果见表3。结果表明:17β-雌二醇、苯甲酸雌二醇和戊酸雌二醇在预混合、配合和浓缩饲料中的平均回收率分别为96.5% ~100.5%、97.2% ~102.0%和96.9% ~100.3%。
在样品中分别添加20、100、150 μg/kg 3 个水平的混合标准溶液,按照1.3 节中所述方法处理样品,每个添加水平各7 份平行样,分别于同一天内连续测定,计算日内精密度,并连续测定5 天,计算日间精密度。结果显示:在预混合、配合和浓缩饲料中17β-雌二醇、苯甲酸雌二醇和戊酸雌二醇的日内精密度为1.0% ~8.7%,日间精密度为1.4% ~11.5%。

表3 3 种饲料样品中3 种雌激素的加标回收率和相对标准偏差(n =6)Table 3 Recoveries and relative standard deviations (RSDs)of the three estrogens spiked in three feed samples (n =6)
2.7 饲料样品的测定
利用该方法测定了市场上购买的30 份饲料样品(预混合饲料、配合饲料、浓缩饲料各10 份),每个样品做3 个平行测定。经检测,30 份样品均未检出目标化合物。
3 结论
本文建立了固相萃取-超高效液相色谱-串联质谱法同时测定饲料中3 种雌激素(17β-雌二醇、苯甲酸雌二醇和戊酸雌二醇)的分析方法。饲料样品采用乙腈提取,Heaion C18固相萃取,氮吹浓缩,超高效液相色谱分离,串联质谱检测。该方法操作简便、线性范围宽、检出限低、准确度高,能够满足饲料中禁用激素类物质的检测要求,弥补了饲料中禁用激素类物质定量确证检测方法的空白,为保障人类和动物健康提供了检测技术支持。
[1] Zhao D Y. China Journal of Food Hygiene (赵丹宇. 中国食品卫生杂志),2003,15(1):58
[2] Shen J Z. Chinese Journal of Veterinary Medicine(沈建忠. 中国兽医杂志),2001,37(1):38
[3] Ding J Y. Chinese Journal of Animal Science (丁建英. 中国畜牧杂志),2006,42(12):4
[4] Ministry of Agriculture of the People’s Republic of China. Announcement No. 176 (中华人民共和国农业部. 公告第176号). (2002-02-09)[2014-06-15]. http:// www.moa.gov.cn/zwllm/tzgg/gg/201104/t20110422_1976307.htm
[5] Ministry of Agriculture of the People’s Republic of China. Announcement No. 193(中华人民共和国农业部. 公告第193号). (2002-04-09)[2014-06-15]. http:// www.moa.gov.cn/zwllm/tzgg/gg/201104/t20110422_1976324.htm
[6] Shao B,Zhao R,Meng J,et al. Anal Chim Acta,2005,548(1/2):41
[7] Wielogorska E,Elliott C T,Danaher M,et al. Food Chem Toxicol,2014,69:260
[8] Socas-Rodríguez B,Asensio-Ramos M,Hernández-Borges J,et al. TrAC-Trends Anal Chem,2013,44:58
[9] Fan Y B,Yin Y M,Jiang W B,et al. Food Chem,2014,142:170
[10] Saravanabhavan G,Helleur R,Hellou J. Chemosphere,2009,76(8):1156
[11] Guo F,Liu Q,Qu G B,et al. J Chromatogr A,2013,1281:9
[12] Ciofi L,Fibbi D,Chiuminatto U,et al. J Chromatogr A,2013,1283:53
[13] Wang Y H,Jin S G,Wang Q Y,et al. J Chromatogr A,2013,1291:27
[14] Liu H J,Yan C,Liu H G. China Feed (刘红菊,闫冲,刘宏果. 中国饲料),2010(18):34
[15] Liu H J,Yan C,Tian Y T. China Feed (刘红菊,闫冲,田英涛. 中国饲料),2008(2):37
[16] Li G L,Dong L H,Wang A H,et al. LWT-Food Sci Technol,2014,55(1):355
[17] Li X,Mu G Q,Chen L J,et al. Chinese Journal of Chromatography (李雪,牟光庆,陈历俊,等. 色谱),2013,31(9):908
[18] Zhang F,Xu C B,Lan F,et al. Chinese Journal of Analytical Chemistry (张峰,许成保,蓝芳,等. 分析化学),2012,40(1):101
[19] Xu Y J,Tian X H,Zhang X Z,et al. Journal of Instrumental Analysis (徐英江,田秀慧,张秀珍,等. 分析测试学报),2012,29(2):152
[20] Fitzpatrick J,Manning B O,Kennedy R. J Agric Food Chem,2004,52(14):4351

