常见园林植物化感作用的初步评价
朱 强,邹梦辉,安 黎,田曾元,郭予琦
(郑州大学生命科学学院,河南郑州450001)
园林植物作为一种独特的植物类群,在快速发展的城市化过程中被广泛应用。对其研究的重点一直放在园艺性状上,而忽略了其他方面潜力的开发。植物化感作用是植物通过淋溶、挥发、残体分解和根系分泌等方式向环境释放化学物质,从而对周围植物产生直接或间接的、有害或有利的作用[1]。系统研究园林植物的化感作用很有必要和意义:一方面,园林植物化感作用对于植物群落演替有着直接影响,同时也影响园林人工生态系统的稳定和功能发挥[2-3],基于化感原理提高园林植物的配置水平,有助于其园艺性状的充分表达。另一方面,由于园林植物种类繁多,其化感作用必定丰富多样,在开发植物源除草剂或生长促进剂方面具有很大潜力,这就极大地拓宽了园林植物的研究领域。目前虽已有一些报道,如万寿菊(Tagetes erecta)[4]、百里香(Thyme mandschuricus)[5]、黑麦草(Lolium perenne)[6]、火炬树(Rhust typhina)[7]已经初步显示出园林植物巨大的化感潜力,但这显然还远远不够。本研究以敏感植物萝卜(Raphanus sativus)为受体,采用传统的培养皿滤纸法初步评价了多种园林植物的化感作用,旨在筛选出具有较高化感活性的园林植物,并为其合理的园林配置奠定基础。另外,由于不同测试方法的结果存在差异,试验还对几种常用的化感作用离体测试方法进行比较,以期论证筛选方法的相对可靠性。
1 材料与方法
1.1 材料
受体植物:化感作用测试常用的敏感植物萝卜,种子购于郑州豫研种子公司。
供体植物:来自30个科的44种果实期园林植物(表1)。2013年9月采于郑州大学校园内,植物种类由郑州大学生命科学学院朱世新副教授及笔者共同鉴定。
1.2 方法
1.2.1 44种园林植物化感作用的初步评价 采用培养皿滤纸法评价44种果实期园林植物鲜叶片的水提取物对萝卜种子萌发和幼苗生长的化感作用。试验先选取海桐(Pittosporum tobira)、毛梾(Cornus wateri)、丁香 (Syringa oblata)、枫杨 (Pterocarla stenoptera)和紫荆(Cercis chinensis)进行活性预测试,发现在0.2 g·mL-1(鲜质量)及0.1 g·mL-1的浸提液浓度下,丁香、枫杨和紫荆处理的萝卜种子几乎完全没有萌发。将浓度降为0.05 g·mL-1时,则抑制程度适中,于是对44种植物的试验中测试浓度均定为0.05 g·mL-1。具体测试方法如下:采来植物新鲜叶片立即用自来水冲洗干净,平铺晾干,剪成1 cm2小片,称取2 g碎片加入20倍的蒸馏水室温浸提24 h。4层纱布过滤得浓度为0.05 g·mL-1的浸提液,立即用于化感活性测试。将籽粒健康均一的萝卜种子冲洗干净,10%次氯酸钠消毒5 min,之后用蒸馏水洗5次,置于垫有两层滤纸的培养皿(直径为9 cm)中。每培养皿摆放30粒,3次重复。每皿中加入8 mL不同植物的水浸液,用蒸馏水作对照。人工气候培养箱中26℃下暗培养3 d。统计发芽率,每皿中取10株测量根长和苗高,取平均值。
1.2.2 薄荷挥发油对萝卜的化感作用 1.2.1试验中44种园林植物化感作用的评价结果显示,薄荷(Mentha haplocalyx)的化感作用最强。水蒸汽蒸馏法[8]提取薄荷挥发油(提取率为0.12%),挥发油测试浓度设为0.5和5 mg·mL-1。由于提取出挥发油极少,将每皿中加入的挥发油溶液减少为6 mL,用蒸馏水作对照,3次重复。其化感作用试验步骤同 1.2.1。
1.2.3 盆栽生物测定 以土壤为载体在光照培养室内测定白玉兰(Magnolia denudata)鲜叶水浸提液对其生态相关种草坪植物剪股颖(Agrostis matsumura)株高和鲜、干质量的影响。土壤选用常见沙性土壤,除杂风干,混匀后装于直径为8 cm的塑料盆中。将一定量的剪股颖种子播于盆中,待幼苗出土后每盆定植5棵苗,浇灌等量白玉兰鲜叶浸提液,清水为空白对照,重复4次。20 d后每处理取10株测量剪股颖株高及鲜、干质量。
1.2.4 不同离体测试方法的比较 本试验采用的方法是化感作用离体测试的传统方法——培养皿滤纸法,但发现部分试验结果与罗小勇等[9]采用琼脂混粉法测试的结果相差较大,甚至出现完全相反的结果,如本试验中白玉兰的化感抑制作用极强,海桐的促进作用最强,而他们的试验结果却是海桐的抑制作用最强,白玉兰的抑制作用较弱。采用琼脂混粉法重新测试,发现此种方法下海桐果然表现出极高的化感抑制作用,但白玉兰的化感作用却同样极高,为了解释此现象,比较几种常用的化感作用离体测试方法的效果,试验设计如下:以白玉兰和海桐的叶片为供体,萝卜为受体,分别采用鲜叶浸提法、干叶浸提法、干粉浸提法、琼脂混粉法进行测试。干叶浸提法:将叶片烘干,剪成1 cm2小片,蒸馏水浸提;干粉浸提法:将叶片烘干粉碎后蒸馏水浸提,测试方法与鲜叶浸提相同。琼脂混粉法完全按照罗小勇等[9]建立的方法进行。鲜叶浸提的浓度为0.05 g·mL-1,干叶浸提法、干粉浸提法、琼脂混粉法的浓度为鲜叶折算后的浓度,以保持浓度一致,白玉兰干叶折算后浓度为21.55 g·L-1,海桐折算后浓度为 18.70 g·L-1。
1.2.5 数据处理与分析 为了便于比较不同植物间化感作用的强弱,采用衡量化感效应的敏感指数(RI值)[10]表示化感效应。计算公式为RI=1-C/T(T>C)或RI=T/C-1(T≤C)。式中,C为对照,是以蒸馏水培养的受体植物各项指标的平均值;T为处理值,是以浸提液培养的受体植物各项指标的平均值;当RI>0时表示浸提液具有促进作用,RI<0时表示具有抑制作用;RI的绝对值代表作用强度的大小。综合效应(SE)为各项敏感指数的算术平均值[11]。
利用SPSS16.0软件对数据进行统计分析,用平均值和标准误表示测定结果,各试验结果均采用Duncan法进行差异显著性分析;采用Excel 2007作图。
2 结果
2.1 不同园林植物叶片水提取物对萝卜的化感作用
在相同浓度(0.05 g·mL-1)下,不同植物对萝卜萌发和生长的作用效果不同甚至完全相反(表1)。其中薄荷和白玉兰的化感抑制作用最强,对萝卜萌发和生长的抑制作用都达到极显著水平(P<0.01),综合效应(SE)分别为 -0.72、-0.65;海桐和国槐(Sophora japonica)的化感促进作用最强,对萝卜幼苗生长具有极显著的促进作用(P<0.01),SE 值分别为 0.47、0.41,而合欢(Albizzia julibrissin)则对萝卜无论萌发还是生长作用甚微。试验筛出了一大批具有较强化感作用的植物。薄荷、白玉兰及红叶李(Prunus cerasifera)对萝卜萌发的抑制作用达到极显著水平(P<0.01),其中薄荷的作用最强,RI值为-0.81;显著或极显著抑制或促进根伸长的有薄荷、白玉兰、国槐、海桐等24种,其中白玉兰的化感抑制作用最强,RI为-0.70,海桐的促进作用最强,RI为0.91;对苗高产生显著或极显著抑制或促进作用的包括薄荷、白玉兰、国槐、海桐等11种,薄荷的化感抑制作用最强,RI为-0.69,国槐的促进作用最强,RI为0.51。另外,SE 值在 -0.10 ~0.10的植物在某些测试项目中却表现出很高的活性,特别是对根的生长,如强烈抑制根伸长的构树和毛白杨,强烈促进根伸长的雪松等。总体上,根比种子和幼苗对化感物质更敏感。但也有例外,如薄荷对萌发的抑制率最高,红叶李对幼苗生长的抑制作用最高。大多数情况下化感作用在不同指标上的表现较为一致,只是程度不同而已,雪松和毛白杨对不同指标间的作用相差较大,而两者的作用模式又截然相反。雪松对萌发和幼苗生长起抑制作用,而对根生长则起到显著的促进作用。毛白杨对萌发没有影响,对根长起抑制作用,而对苗高反而起到促进作用。
2.2 薄荷挥发油对萝卜萌发和生长的化感作用
在测试浓度下,薄荷挥发油对萝卜的萌发和生长均产生显著或极显著的化感抑制作用,且浓度越高抑制作用越强(表2)。在0.5 mg·mL-1浓度下,萝卜种子的发芽率受到显著的抑制作用(P<0.05),根长和苗高受到极显著的抑制作用(P<0.01)。在 5.0 mg·mL-1浓度下,发芽率、根长及苗高均受到极显著的抑制(P<0.01)。在各测试项目中发芽率受到的影响最小,苗高受到抑制作用最强。
2.3 盆栽法测试白玉兰水浸提液对剪股颖株高及生物量的影响
总体上随着白玉兰水浸提液浓度的增加,剪股颖株高和鲜、干质量受到的抑制作用都逐渐增强(图1),其中对干质量的影响最大,对株高的影响最小。对株高、鲜质量的RI值基本上在-0.40~-0.05,干质量在 0.01 g·mL-1浓度下的 RI值已至-0.21,在0.1 g·mL-1浓度下 RI值为 - 0.42,此时株高的RI值为-0.19。由此推断,在土壤中白玉兰鲜叶依然具有较高的化感作用。
2.4 不同离体测试方法间的比较
不同测试方法的效果间存在较大差异(表3),且差异没有固定的模式(因测试植物的不同而变化)。在所有测试方法中,白玉兰对萝卜的萌发和生长都表现出极显著的抑制作用(除干叶浸提和琼脂混粉法对萝卜发芽率的影响)(P<0.01),不同方法作用强弱的顺序为干粉浸提>琼脂混粉法>鲜叶浸提>干叶浸提。海桐在不同的测试方法中对萝卜幼苗生长的影响不同,甚至完全相反。在鲜叶浸提测试中表现为强烈的促进作用,对萝卜根长促进率最高,RI为0.91;在其他方法中则表现出极高的抑制作用,并以琼脂混粉法为最高,RI为-0.95。在琼脂混粉法中海桐对萝卜的抑制率甚至比44种植物采用鲜叶浸提测试中的都高,RI为-0.80。

表1 不同园林植物0.05 g·mL-1水提取物对萝卜种子萌发、根长和幼苗生长的影响Table 1 Effects of aqueous extracts 0.05 g·mL-1 from different garden plants on germination,root length and seedling growth of Raphanus sativus
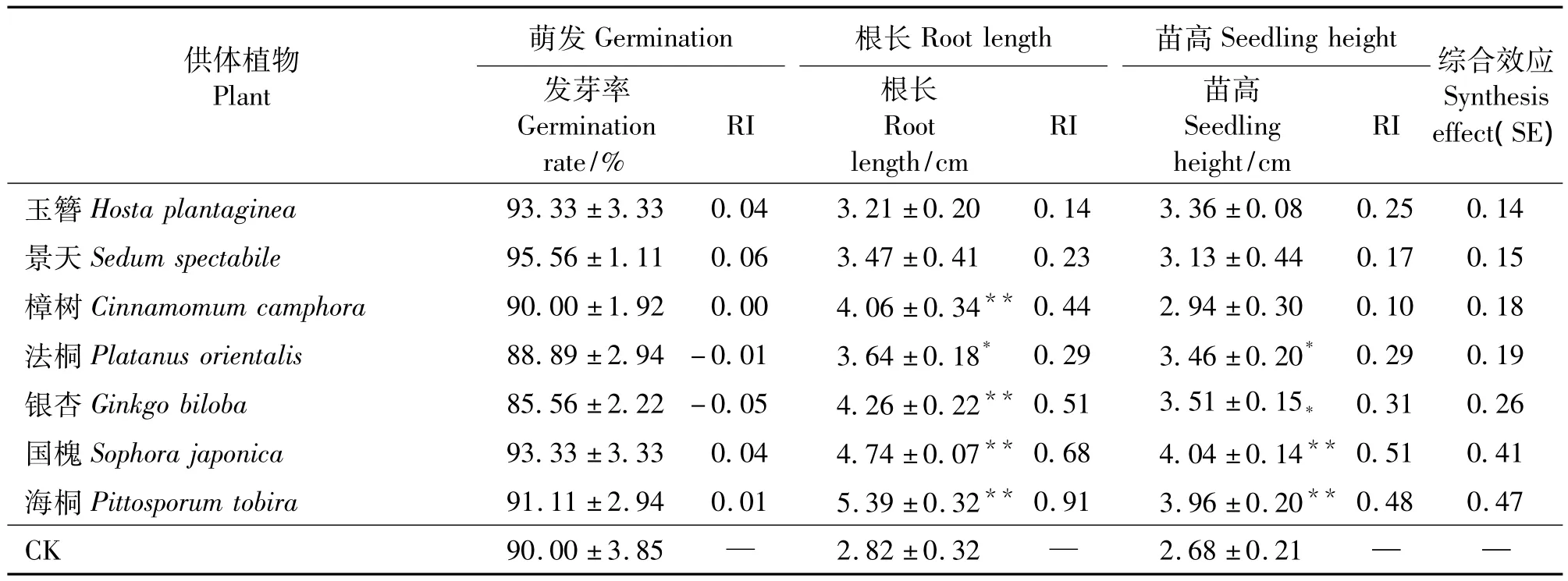
续表1
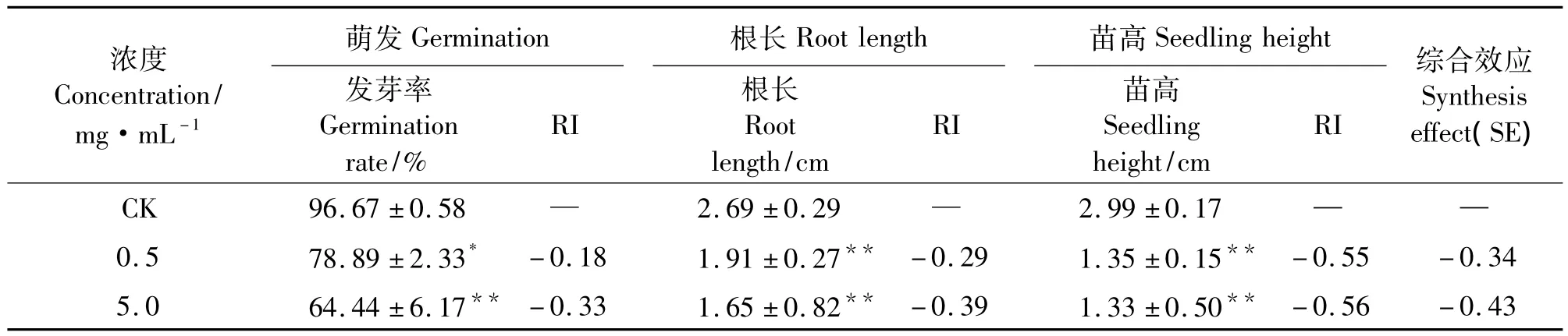
表2 薄荷挥发油对萝卜种子萌发、根长和幼苗生长的影响Table 2 Effects of volatile oil from Mentha haplocalyx on germination,root length and seedling growth of Raphanus sativus

图1 白玉兰水浸液对剪股颖株高及生物量的影响Fig.1 Effects of aqueous extracts from Magnolia denudata on height and biomass of Agrostis matsumurae
3 讨论
试验首先以滤纸为载体评价了44种园林植物水浸液对化感敏感性受体——萝卜的化感作用,对抑制作用最强的薄荷挥发油进行活性测试,又以土壤为载体验证白玉兰的化感作用,另外还探讨了几种化感作用离体测试方法的差别。
本试验筛出多种具有较强化感作用的植物,包括化感抑制作用和促进作用。如薄荷对萝卜发芽率的RI值达 -0.81,海桐对萝卜根长的 RI值高达0.91。薄荷的强化感活性印证了张远莉等[12]的报道;而海桐的高促进作用则与罗小勇等[9]的研究结果完全相反,这是由于研究方法不同(本研究对此进行了确证),笔者曾对比了海桐的老叶和新叶,发现两者鲜叶水浸液在低浓度下都具有较高的促生长作用(未列出),由此推测起促进作用的物质不是生长素或赤霉素,而可能是一种新的促生长物质,且其很容易降解,因为海桐叶片在晒干以后即失去促进活性转而表现出极高的抑制作用(表3)。这种抑制性物质可能是在晒干过程中产生的或者原本就存在,只是在细胞结构遭到破坏后才被释放出来。那么该抑制性物质不易从鲜叶中提取出来。若是新产生的则在晒干过程中必定发生了某种或某些未知的化学反应,这还需深入研究。另外,同科植物的化感作用可能相近,也可能相差较大,同属植物的化感作用较近似。如胡桃楸和核桃同属不同科,化感作用相近,但同科异属的枫杨却表现出更高的化感作用。已有的研究表明,化感作用存在种甚至是品种、个体的特异性[13-15]。

表3 不同测试方法时白玉兰和海桐对萝卜的化感作用Table 3 Allelopathy of Magnolia denudata and Pittosporum tobira on Raphanus sativus in different test methods
44种植物中薄荷的化感作用最强,综合效应为-0.72。张远莉等[12]曾对薄荷的水溶性物质进行初步分离,但最终未得到理想产物,本试验提取了薄荷的挥发油并进行初步测试,发现薄荷挥发油在0.5 mg·mL-1的水溶液状态下即显著或极显著地抑制萝卜的萌发和生长,且对幼苗的抑制作用强于根,这与挥发油易挥发而在水中的溶解度低有关。试验结果初步证明薄荷挥发油中含有活性较高的化感物质。
盆栽试验表明,白玉兰新鲜叶片具有较强的化感作用。化感物质最终都要汇集到土壤中,化感物质与土壤间存在复杂的相互作用:一方面,化感物质能改变土壤理化性质、影响土壤生物群落格局;另一方面,土壤环境,尤其是土壤微生物,也能维持或降解化感物质。这最终会影响到植物的化感活性[16]。
由于水浸提生物测试法具有简单易行、耗费低、快速等优点[17],此方法已被广泛地用于化感作用的测试中[18-19],但离体浸提物与自然分泌物存在一定的差别,所以此方法只是对化感作用进行初步评价。由于植物体内成分的复杂性,每种植物体内必定或多或少地含有对其他植物有一定作用的非化感物质[20],不同处理后的结果必然会存在一定的差异,甚至截然相反。相比而言,鲜叶浸提更接近真实情况,而且几乎不存在渗透压和pH的问题[21]。将植物材料粉碎后提取,在自然条件下不释放的酶、氨基酸、无机盐和含氮物质也释放出来,这使得造成的差别更加巨大[22]。所以,在研究时一定要根据研究目的(如化感作用或除草剂开发)慎重地选择试验方法,并对试验结果小心判断。
研究具有较强化感作用的园林植物不仅对维持园林人工生态系统的稳定具有重要意义,还有可能从中提取出结构新颖的植物源除草剂或其先导化合物。已研究的化感植物较多属于菊科[23],而本试验中化感作用较强的薄荷、白玉兰、枫杨、红叶李等分别属于唇形科、木兰科、胡桃科、蔷薇科。目前对这些植物的化感作用了解甚少,在此基础上对筛选出的具有较高化感活性的园林植物还有待进行系统深入的研究。
致谢!感谢郑州大学生命科学院朱世新副教授在植物鉴定方面给予的帮助。
[1]Rice E L.Allelopathy[M].2nd ed.New York:Academic Press,1984:1-5.
[2]张岚,高素萍.园林植物化感作用研究现状与问题探讨[J].浙江林学院学报,2007,24(4):497-503.
[3]吴晓华.植物化感作用机理及其在园林植物配置中的应用[J].山东农业科技,2010(3):125-129.
[4]Karin K,Kaul K.Autotoxicity in Tagetes erecta L.on its own germination and growth[J].Allelopathy Journal,2000,7(1):109-113.
[5]王玲,马喜娟,张秀珍.东北百里香化感作用[J].东北林业大学学报,2012,40(7):41-44.
[6]高承芳,林仕欣,林碧芬,刘远,张晓佩,李文杨,董晓宁.3个多花黑麦草品种化感作用研究[J].草业科学,2011,28(9):1676-1680.
[7]侯玉平,柳林,王信,闫晓宇,门航,李伟杰,徐维明.外来植物火炬树水浸液对土壤微生态系统的化感作用[J].生态学报,2013,33(13):4041-4049.
[8]孔垂华,黄寿山,胡飞.胜红蓟化感作用研究ⅴ.挥发油对真菌、昆虫和植物的生物活性及其化学成分[J].生态学报,2001,21(4):584-587.
[9]罗小勇,付艳红,周世军.琼脂混粉法的建立及其在植物叶片化感活性测定中的应用[J].青岛农业大学学报(自然科学版),2007,24(4):267-270.
[10]Williamson G B,Richardson D.Bioassays for allelopathy:Measuring treatment responses with independent controls[J].Journal of Chemical Ecology,1988,14(1):181-187.
[11]沈慧敏,郭鸿儒,黄高宝.不同植物对小麦、黄瓜和萝卜幼苗化感作用潜力的初步评价[J].应用生态学报,2005,16(4):740-743.
[12]张远莉,陈建群,卫春,张纪林.薄荷化感物质的作用及其初步分离[J].应用与环境生物学报,2003,9(6):611-615.
[13]Olofsdotter M.Rice-A step toward use of allelopathy[J].Agronomy Journal,2001,93:3-8.
[14]何华勤,林文雄,董章杭,郭玉春,沈荔花,梁义元,陈芳育,梁康迳.水稻对受体植物化感作用的遗传生态学研究[J].应用生态学报,2002,13(12):1582-1586.
[15]孔垂华,徐效华,胡飞,陈雄辉,凌冰,谭中文.以特征次生物质为标记评价水稻品种及单植株的化感潜力[J].科学通报,2002,47(3):203-206.
[16]倪广艳,彭少麟.外来入侵植物化感作用与土壤相互关系研究进展[J].生态环境,2007,16(2):644-648.
[17]林文雄,何海斌,熊君,沈荔花,吴敏鸿,林瑞余,何华勤,梁义元,李兆伟,陈婷.水稻化感作用及其分子生态学研究进展[J].生态学报,2006,26(8):2688-2694.
[18]Zeng D L,Qian Q,Teng S,Dong G J,Fujimoto H,Yasufumi K,Zhu L H.Genetic analysis of rice allelopathy[J].Chinese Science Bulletin,2003,48(3):265-268.
[19]安培坤,王引权,窦莉莉,张金林,康生福.岷山红三叶茎叶水浸液对3种植物种子萌发及幼苗生长的影响[J].草业科学,2012,29(6):960-963.
[20]孔垂华,娄永根.化学生态学前沿[M].北京:高等教育出版社,2011:265-267.
[21]骆世明,林象联,曾任森,孔垂华,曹潘荣,韦琦,邓兰桂.华南农区典型植物的他感作用研究[J].生态科学,1995(2):114-127.
[22]曾任森.化感作用研究中的生物测定方法综述[J].应用生态学报,1999,10(1):123-126.
[23]周凯,郭维明,徐迎春.菊科植物化感作用研究进展[J].生态学报,2004,24(8):1780-1787.

