重组禽腺联病毒传递的miRNAs 对鸡传染性法氏囊病毒复制的抑制
王永娟, 朱善元, 王 岑, 左伟勇
(江苏农牧科技职业学院江苏省兽用生物制药高技术研究重点实验室,江苏 泰州225300)
鸡传染性法氏囊病毒(Infectious bursal disease virus,IBDV)的免疫主要通过疫苗进行,但由于活疫苗免疫能导致鸡法氏囊的凋亡和毒力增强而影响免疫效果[1-2]。VP2 是IBDV 病毒的主要结构蛋白质,在病毒包装、细胞吸附、免疫应答过程中都起重要作用[3-5],所以目前的疫苗相关的研究主要针对VP2 蛋白质。miRNA 作为小RNA 的一种已被证实能抑制病毒基因的表达[6-7]。禽腺联病毒(Avian adeno-associated virus,AAAV)具有与哺乳动物AAV类似的潜伏感染特性和相似的基因组结构,并被证明能在禽源细胞中稳定表达外源基因[8-9],具有无致病性、免疫原性低、细胞感染谱广和外源基因表达稳定持续等优点,被认为是一种很有应用前景的基因转移载体[10],已有学者成功构建了AAAV 基因转移载体和三质粒转染制备rAAAV 方法,获得了滴度较高且能在鸡体内稳定表达人组织激肽释放酶的rAAAV[11]。本试验在前期研究基础上,构建vp2与vp1基因特异miRNA 重组禽腺联病毒转移载体,制备具有抑制IBDV 复制能力的rAAAV,为探索鸡传染性法氏囊病IBD 防制新途径奠定基础。
1 材料与方法
1.1 材料
1.1.1 酶及主要试剂 各种酶及Marker 购自宝生物(大连)公司;Trizol、Wizard DNA Clean-up System购自美国Promega 公司;DMEM 培养基购自美国GIBCO 公司;小牛血清(NBS)购自中美合资兰州民海生物工程有限公司;丁酸钠、多聚乙烯亚胺(PEI)购自SIGMA 公司;其他试剂为国产分析纯级。
1.1.2 主要生物材料 miRNA 表达载体pRFPRNAiC 购于英国Roslin 研究所;DF-1 细胞系、中强毒力IBDV Lurkert 疫苗株由秦爱建教授提供;IBDV LYG 株和YEZ 株由扬州大学兽医学院微生物实验室惠赠,含Ad5 E1基因的AAV-293 细胞,pHelper购自Stratagene 公司。pRFPRNAmivp2E、pRFPRNAmivp2con、pCR-AAAV、pcDNA-ARC 由扬州大学兽医学院微生物实验室提供[6,12-13];DH5α 大肠杆菌感受态细胞由江苏省兽用生物制药高技术研究重点实验室保存。
1.1.3 仪器 倒置荧光显微镜为德国Leica 公司产品;全波长分光光度计为美国NanoDrop 公司产品;透射电子显微镜为荷兰Philips 公司产品。
1.2 方法
1.2.1vp1特异miRNA 表达载体的构建 参照文献报道方法设计vp1特异miRNA 序列[6],合成的序列分别为5'-GAGAGGTGCTGCTGAGCGATACCCAGAAG TCAAGAACTAGTGAAGCCACAGATGTA-3' 和5'-ATTCACCACCACTAGGCAGTACCCAGAAGTCAAGAACT ACATCTGTGGCTTCACT-3',两序列退火形成shRNA并克隆至pRFPRNAiC 以制备pRFPRNAmivp1。
1.2.2 AAAV 转移载体的构建 根据AAAV 基因组DNA 酶切图谱,PmlⅠ与BsmB Ⅰ双酶切pCRAAAV 质粒,回收含AAAV 左右ITR 的约4 100 bp载体片段(对应质粒命名为pAITR),补平;SalⅠ和BamH Ⅰ双酶切pRFPRNAmivp2E、pRFPRNAmivp1和pRFPRNAmivp2con 后回收含红色荧光蛋白质(Red fluorescent protein,RFP)表达盒和miRNA 表达框盒的约3 200 bp 片段,补平后与带ITR 的片段连接,最终拟获得重组质粒pAITR-RFPmivp2E、pAITR-RFPmivp2con 和pAITR-RFPmivp1。
SalⅠ和DraⅠ双酶切pRFPRNAiC 质粒,回收约2 100 bp 片段,补平后与pAITR 连接,最终拟构建仅表达RFP 的pAITR-RFP。
1.2.3 rAAAV 的生产与纯化 将AAAV 转移载体pAITR-RFP-mivp2E、pAITR-RFP-mivp1、pAITR-RFPmivp2con、pAITR-RFP 分别与AAAV 包装载体pcDNA-ARC 和腺病毒辅助载体pHelper 组成三质粒转染系统,参考文献报道的磷酸钙沉淀法[14]共转染AAV-293 细胞,72 h 后收获细胞,采取-20 ℃乙醇浴10 min→37 ℃水浴10 min 的方法反复冻融4 次,10 000 r/min 离心10 min,收集的上清即为rAAAV,其纯化与浓缩方法参照文献报道的进行[14],最终浓缩10 000 倍后病毒液-20 ℃保存备用。
1.2.4 rAAAV 感染性滴度的测定 按照参考文献方法[11],将DF-1 细胞按1 孔1×104细胞的密度接种96 孔培养板,在细胞生长良好时感染倍比稀释好的纯化后rAAAV,每孔接种50 μl(n=2),并加终浓度为10 mmol/L 的丁酸钠。37 ℃、5% CO2孵育48 h 后,在荧光显微镜下计数各孔的红色荧光阳性细胞数,并按TU= 1 ml 中RFP 阳性细胞数×稀释倍数,计算感染性rAAAV 的滴度(TU)。
1.2.5 rAAAV 的鉴定
1.2.5.1 电镜观察 取初步纯化的rAAAV 悬液滴于有支持膜的铜网上,10 min 后用干净滤纸从网边吸去液体,另滴加3%磷钨酸(pH 6.0)染色2 ~3 min,之后吸去液体立即进行透射电镜观察。
1.2.5.2 病毒感染性试验 参考文献报道的方法用 未 纯 化 的 rAAAV-RFPmiVP2E、rAAAV-RFPmiVP1、rAAAV-RFPmiVP2con 和rAAAV-RFP 分别感染DF-1 细胞[14],37 ℃、5% CO2孵育48 h 后,直接在荧光显微镜下观察RFP 的表达。
1.2.6 miRNA 表达的检测 设计miRNA 表达盒的序列上下游引物: 5'-TCCCTCGACCTGCAGC CCAAGCTTGCGGCCGCGACAACACAAGCATCGAGCCC-3'和5'-CCGATTCATTAATGCAGCGGATCCATCGATAAAAAAGCTTACCGT -3',收获rAAAV 感染48 h 后RFP 阳性孔细胞,按Trizol 试剂说明书提取细胞总RNA,以提取的RNA 为模板,用RT-PCR 检测感染细胞中miRNA 的表达。10 μl RT 体系为:4 μg 总
RNA,10 pmol Oligo(dT)18,40 U RNasin,10 mmol dNTPs 和200 U MMLV 反转录酶,反应条件为37 ℃、1 h。50 μl PCR 反应体系为:2 μl RT 产物,15 pmol正、反向引物,5 U DNA polymerase。30 次循环PCR程序为:94 ℃45 s(第一次循环为4 min),69 ℃45 s,72 ℃1 min(最后一次循环为10 min)。反应结束后,进行琼脂糖凝胶电泳分析。
1.2.7 IBDV 野毒株细胞适应毒培养 按常规方法分别感染IBDV LYG 株和YEZ 株于DF-1 细胞,盲传至细胞出现明显肉眼病变时,以Karber 法[15]计算病毒TCID50。
1.2.8 miRNA 对病毒抑制效率的检测
1.2.8.1TCID50测定 将DF-1 细胞按1 孔1×105细胞的密度接种24 孔培养板,培养至细胞密度约为80%时按1 个细胞10 个TU 的剂量接种rAAAV,1 孔500 μl。在感染后约48 h 出现荧光阳性细胞时,参考文献报道[7]的0.001TCID50/TU 的剂量和方法,分别用1 个同源株(Lukert)和2 个异源株(LYG 和YEZ)IBDV 感染(n=3)。在感染后24 h、48 h、72 h、96 h时,分别取100 μl 细胞上清液进行IBDVTCID50测定,以rAAAV-RFP 转导、IBDV 感染细胞培养上清液中的TCID50为参考,计算rAAAV 介导的miVP2E、miVP1 和miVP2con 对IBDV 复制的抑制作用。
1.2.8.2 RT-PCR 检测 在IBDV 感染后96 h,收集各孔细胞并提取细胞及病毒核酸。以Oligo(dT)18为引物进行vp2基因的半定量RT-PCR 反应,检测vp2基因的表达(内参为β-actin基因),PCR 结束后,琼脂糖凝胶电泳、EB 染色,用ND-1000分光光度计对目的条带及内参条带进行灰度扫描,根据rAAAV 转导细胞中vp2扩增产物量的变化判断miRNA 对IBDV 基因表达的抑制作用。
2 结果
2.1 AAAV 转移载体的构建与鉴定
在前期研究基础上,构建了IBDVvp1基因特异miRNA 表达载体pRFPRNAmivp1(图略)。然后利用重组DNA 技术,完成了miRNA-RFP 表达盒与AAAV ITR 的拼接,形成AAAV 转移载体,这些转移载体经EcoR Ⅰ消化、琼脂糖凝胶电泳分离,可见预期的约3 800 bp、2 500 bp、1 450 bp 条带,经鉴定正确的载体分别命名为pAITR-RFPmivp2E、pAITRRFPmivp2con 和pAITR-RFPmivp1(图1)。同时,完成了对照载体pAITR-RFP 的构建,该载体在EcoRⅠ消化后,电泳可见预期的约3 800 bp、2 500 bp、400 bp 条带(图2)。
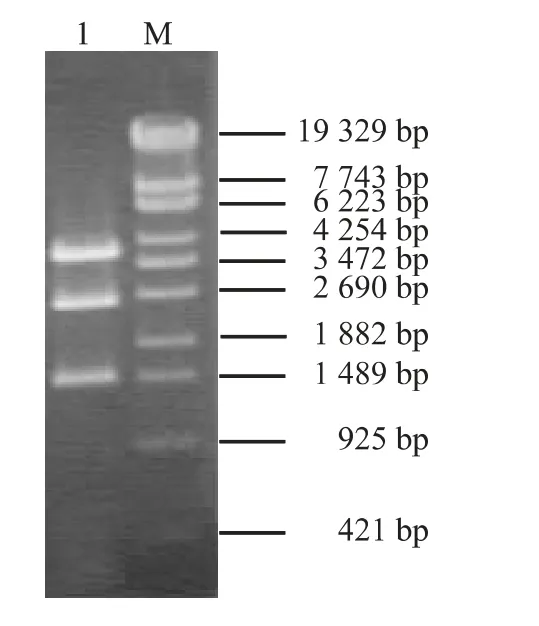
图1 pAITR-RFPmivp2E 酶切鉴定Fig.1 Identification of pAITR-RFPmivp2E
2.2 rAAAV 的产生与感染性滴度测定
通过质粒共转染的方法获得rAAAV,分别用纯化后稀释的重组病毒rAAAV-RFPmiVP2E、rAAAVRFPmiVP1、rAAAV-RFPmiVP2con 和rAAAV-RFP 感染DF-1 细胞,在感染后48 h,可见红色荧光阳性细胞。根据每孔细胞中荧光阳性细胞数计算重组病毒感染滴度,结果纯化、浓缩后的 rAAAV-RFPmiVP2E、rAAAV-RFPmiVP2con 和 rAAAV-RFPmiVP1 的感染性滴度均可达到5×108TU/ml,rAAAV-RFP 的感染性滴度为6×108TU/ml。
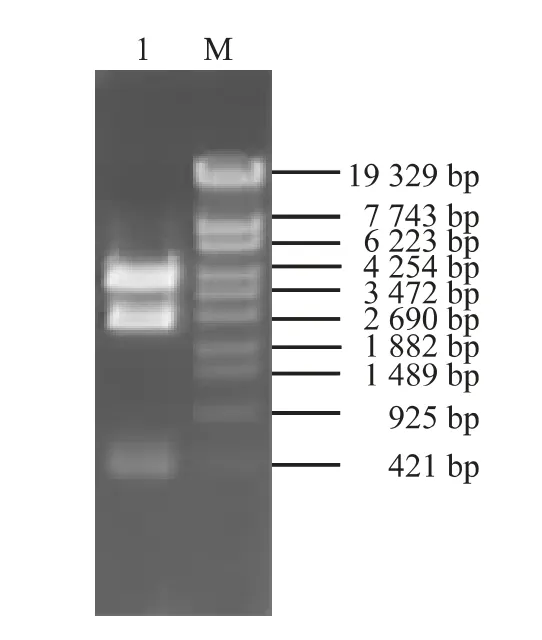
图2 pAITR-RFP 酶切鉴定图Fig.2 Identification of pAITR-RFP
2.3 rAAAV 的鉴定
2.3.1 电镜观察结果 以rAAAV-RFPmiVP2E 为代表,将纯化和浓缩后的rAAAV 进行透射电子显微镜观察,可见典型的AAAV 颗粒,病毒颗粒的直径约为20 nm(图3)。
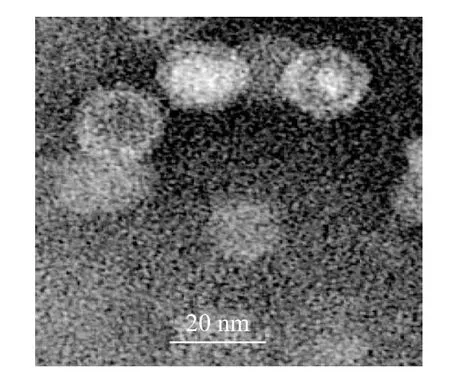
图3 rAAAV-RFPmiVP2E 的电镜照片(×65000)Fig.3 Electronic microscopic examination of rAAAV-RFPmiVP2E (×65000)
2.3.2 病毒感染性试验 在DF-1 细胞被纯化的rAAAV 感染后24 h,荧光显微镜下可观察到带红色荧光的细胞,感染后48 h 荧光阳性细胞数量最多,强度最强,但荧光强度明显弱于质粒转染细胞(图4),这一红色荧光可维持近14 d,此时细胞出现衰老死亡。
2.4 rAAAV 感染细胞中miRNA 的表达检测
在rAAAV 感染后48 h,收集RFP 阳性孔细胞提取总RNA,以针对miRNA 表达盒上、下游序列引物进行RT-PCR 检测,扩增产物经电泳分离后,可见预期1 000 bp 左右特异条带,而不含miRNA 表达盒的rAAAV-RFP 对照病毒无此条带。以rAAAVRFPmiVP2E 为代表的感染细胞的检测结果如图5。

图4 rAAAV-RFPmiVP2E 感染细胞的荧光观察Fig.4 Fluorescence observation of rAAAV-RFPmiVP2E infecting DF-1 cells

图5 RT-PCR 检测rAAAV-RFPmiVP2E 感染细胞中miRNA表达Fig.5 Detection of miRNA expression in rAAAV-RFPmiVP2E infecting DF-1 cells by RT-PCR
2.5 miRNA 对同源IBDV 复制的抑制作用
2.5.1TCID50检测 DF-1 细胞在rAAAV 转导后2 d 感染同源毒株Lukert 株,之后每隔24 h 收取细胞上清液测定病毒TCID50。从图6 可以看出,与rAAAVRFPmiVP2con 和rAAAV-RFP 相比,经rAAAV-RFPmiVP2E 和rAAAV-RFPmiVP1 转导24 h 后,病毒TCID50均下降,这种抑制作用至少维持96 h,针对vp2和vp1基因的miRNA 的抑制率无显著差异。
2.5.2 半定量RT-PCR 在检测细胞上清液中IBDV 的同时,收获感染细胞提取总RNA,以β-actin基因为内参,在同等条件下进行vp2基因的半定量RT-PCR 检测。IBDV 感染后96 h 的检测结果(图7)显示,与对照病毒 rAAAV-RFPmiVP2con 和rAAAV-RFP 转导细胞相比,rAAAV-RFPmiVP2E 和rAAAV-RFPmiVP1 表达的miRNA 对同源株IBDVvp2基因表达的抑制率分别为85.2%和89.6%。
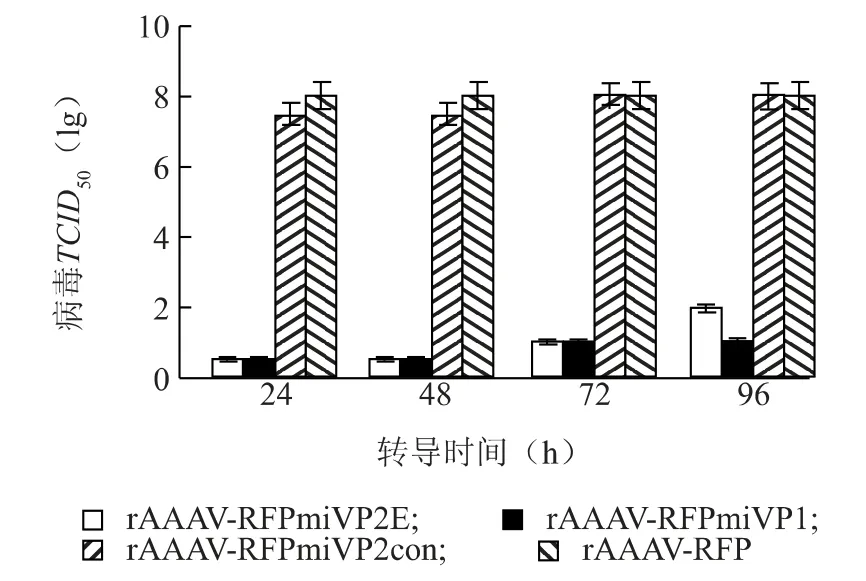
图6 rAAAV 表达的miRNA 对同源株IBDV 复制的抑制作用Fig.6 The inhibitory effect of rAAAV-delivered miRNAs on homologous IBDV replication revealed by TCID50
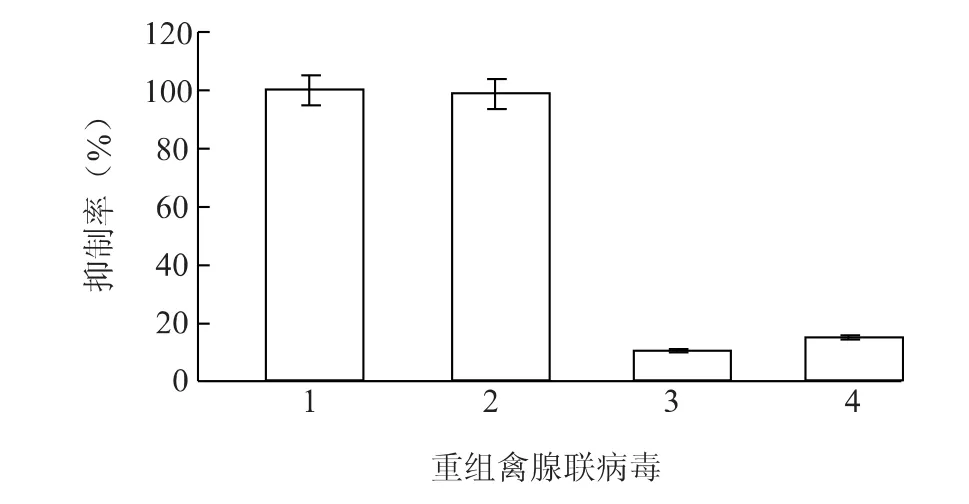
图7 rAAAV 表达的miRNA 对同源株IBDV 基因表达的抑制作用Fig.7 The inhibitory effect of rAAAV-delivered miRNAs on homologous IBDV gene expression detected by semiquantitative RT-PCR
2.6 miRNA 对异源IBDV 复制的抑制作用
DF-1 细胞同样在rAAAV 转导后2 d 感染异源毒株YEZ 株和LYG 株,在感染后96 h,检测细胞上清液中的病毒TCID50,结果(图8)显示,与rAAAVRFPmiVP2con 和 rAAAV-RFP 转导细胞相比,rAAAV-RFPmiVP2E 和rAAAV-RFPmiVP1 转导细胞中YEZ 株和LYG 株IBDVTCID50均下降,其中rAAAV-RFPmiVP2E 转导细胞中LYG 株TCID50下降幅度低于rAAAV-RFPmiVP1。
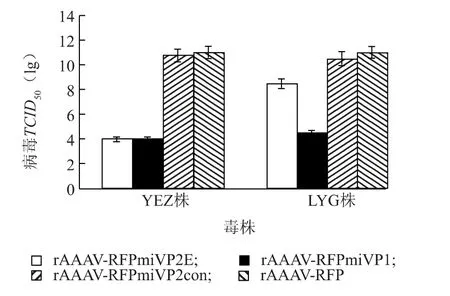
图8 rAAAV 表达的miRNA 对异源株IBDV 复制的抑制作用Fig.8 The inhibitory effect of rAAAV-delivered miRNAs on heterologous IBDV replication detected by TCID50
3 讨论
为了构建表达miRNA 的重组AAAV,本研究将miRNA 表达盒与RFP 表达盒一起插入AAAV 转移载体,将获得的重组载体pAITR-RFP、pAITR-RFPmivp2E、pAITR-RFPmivp2von 和pAITR-RFPmivp1与AAAV 包装载体和腺病毒辅助载体组成三质粒系统,通过共转染AAV-293 细胞获得了表达抑制性miRNA的 rAAAV-RFPmiVP2E 和 rAAAV-RFPmiVP1、rAAAV-RFPmiVP2con(表 达 miRNA 对 照)以 及rAAAV-RFP(不表达miRNA 对照)。通过用PCR 检测、电镜观察和细胞感染等试验证明,重组病毒不仅具有典型的AAAV 形态结构,基因组中含miRNA 表达盒,而且能感染DF-1 细胞和表达报告基因。就重组病毒的滴度而言,同时含miRNA 和RFP 表达盒的rAAAV-RFPmiVP2E、rAAAV-RFPmiVP1 和 rAAAVRFPmiVP2con 低于仅含RFP 表达盒的rAAAV-RFP,这可能与AAAV 的包装容量(≤4 500 bp)有关[11],提示如将RFP 报告基因删除,有可能进一步提高rAAAV 的包装效率和病毒滴度。
AAAV 是一种复制缺陷型病毒,需要辅助病毒的参与才能复制和产生子代病毒颗粒。常用的重组AAAV 制备方法主要有2 种,一是将含外源基因表达盒和AAAV 反向末端重复序列的转移质粒与含AAAV 的复制蛋白(Rep)和(或)外壳蛋白(Cap)基因的辅助质粒共转染细胞,经腺病毒等辅助病毒感染后获得重组病毒;二是所谓的三质粒共转染法,即以含腺病毒E2A、E4和VA基因的质粒代替辅助病毒功能[16]。相比之下,三质粒共转染法可简化重组病毒的纯化,避免辅助病毒污染,并能减少野生型AAAV 的产生[17],因此我们采用三质粒共转染法制备重组AAAV。
AAAV 是一种单链DNA 病毒,当AAAV 进入细胞后,病毒颗粒转运到细胞核内,通过基因组的正、负链退火或单链复制成双链后,才能进行病毒基因的转录和蛋白质表达,这一过程比较缓慢,所以在体外培养的细胞中,AAAV 载体介导的基因表达时间较质粒转染滞后。辅助病毒或者其他的一些化学因素如喜树碱、丁酸钠等可以加速这一过程的发生,从而促进外源基因的表达[11]。
本研究通过细胞感染试验研究rAAAV 表达的miRNA 对不同毒株IBDV 复制的抑制效率。结果显示,在IBDV 感染96 h 时间内,针对vp1和vp2基因的miRNA 对同源Lukert 株IBDV 的抑制作用均较强,可使TCID50下降,明显高于重组质粒表达的相同miRNA 的抑制效率[6],可能原因是rAAAV 的感染效率高于质粒的转染效率。对2 个异源IBDV 毒株而言,针对vp2基因的miVP2E 和针对vp1基因的miVP1 对YEZ 株的抑制作用相当,但前者对LYG株的抑制效率明显低于后者,可能原因是作为主要结构和抗原蛋白,VP2 容易受免疫选择压力等因素的影响而容易发生突变,特别是其高变区[18],而作为RNA 依赖的RNA 聚合酶的VP1,在不同毒株间相对保守[19]。这些研究结果提示,VP1 更适合作为RNA 干扰IBDV 复制的靶基因。
总之,作为有效表达干扰RNA 的载体,rAAAV除具有无致病性和稳定表达等优点外,表达针对不同IBDV 毒株共有保守区siRNA 或miRNA 的rAAAV 有可能克服疫苗免疫的弊端,有望成为预防IBD 的新型生物制剂。
[1] SHARMA J M,KIM I J,RAUTENSCHLEIN S,et al.Infectious bursal disease virus of chickens:pathogenesis and immunosuppression[J].Dev Comp Immunol,2000,24:223-235.
[2] SNYDER D B.Changes in the field status of infectious bursal disease virus[J].Avian Pathol,1990,19:419-423.
[3] BÖTTCHER B,KISELEV N A,MASHCHUK V Y.Three-dimensional structure of infectious bursal disease virus determined by electron cryomicroscopy[J].J Virol,1997,71:325-330.
[4] CASTON J R,MARTINEZ J L,LOMBARDO E.C-terminus of infectious bursal disease virus major capsid protein VP2 is involved in definition of the T number for capsid assembly[J].J Virol,2001,75:10815-10828.
[5] BECHT H,MÜLLER H,MÜLLER H K.Antigenic structure of the two serotypes of infectious bursal disease virus[J].J Gen Virol,1998,69:631-640.
[6] 王永娟,崔平福,孙怀昌.靶向IBDV VP2 有效miRNA 的筛选[J].江苏农业学报,2010,26(6):1270-1276.
[7] GAO Y,LIU W,GAO H,et al.Effective inhibition of infectious bursal disease virus replicationin vitroby DNA vector-based RNA interference[J].Antiviral Res,2008,79(2):87-94.
[8] BAUER H J,MONREAL G.Herpesviruses provide helper functions for avian adeno-associated parvovirus[J].J Gen Virol,1986,67:181-185.
[9] BAUER H J,SCHNEIDER R,GELDERBLOM H R,et al.Biological and physicochemical characterization of the major (1.40)and minor (1.45)component of infectious avian adeno-associated virus[J].Arch Virol,1991,120:123-133.
[10] DURING M J.Adeno-associated virus as a gene delivery system[J].Advanced Drug Delivery Reviews,1997,27:83-94.
[11] WANG A P,SUN H C,WANG J Y,et al.Recombinant avian adeno-associated virus-mediated oviduct-specific expression of recombinant human tissue kallikrein[J].Poultry Science,2008,87(4):777-782.
[12] 王安平,孙怀昌,王建业,等.表达绿色荧光蛋白报告基因重组禽腺联病毒的构建与鉴定[J].病毒学报,2007,23(4):292-297.
[13] 王建业,孙怀昌,朱国强.禽腺联病毒的分离及基因组鉴定[J].扬州大学学报,2005,26(2):1-4.
[14] 吴小兵,董小岩,伍志坚,等.一种快速高效分离和纯化重组腺病毒伴随病毒载体的方法[J].科学通报,2000,45(19):2071-2075.
[15] 殷 震,刘景华.分子病毒学[M].2 版.北京:科学出版社,1997.
[16] 金 奇.医学分子病毒学[M].北京:科学出版社,2001.
[17] COLLACO R F,CAO X,TREMPE J P.A helper virus-free packaging system for recombinant adeno-associated virus vectors[J].Gene,1999,238(2):397-405.
[18] JACKWOOD D J,SOMMER-WAGNER S E.Molecular epidemiology of infectious bursal disease viruses:distribution and genetic analysis of newly emerging viruses in the United States[J].Avian Dis,2005,49(2):220-226.
[19] KIBENGE F S,NAGARAJAN M M,QIAN B.Determination of the 5' and 3' terminal noncoding sequences of the bisegmented genome of the avibirnavirus infectious bursal disease virus[J].Arch Virol,1996,141:1133-1141.

