内生细菌EBS05 对番茄抗中国番茄黄化曲叶病毒的诱导作用
李俊州, 王春梅, 文才艺, 臧 睿
(1.河南农业大学植物保护学院,河南 郑州450002;2.江苏省农业科学院中心实验室,江苏 南京210014)
番茄黄化曲叶病毒病是由中国番茄黄化曲叶病毒(TYLCCV)引起的一种番茄生产上的毁灭性病害,主要由烟粉虱或嫁接传播[1-2]。该病于1939 ~1940 年在以色列番茄产区首次被发现[3],随后在中东、非洲、美洲、欧洲和亚洲等地区相继发生[4-6]。20 世纪90 年代初,中国仅在广西、广东、台湾和云南等地零星发生,自2005 年开始,番茄黄化曲叶病毒病在广西、广东、浙江、江苏、河南和上海等地大面积暴发,给当地番茄生产造成了严重的损失。2009 ~2010 年,番茄黄化曲叶病毒病在江苏、山东和河南等省再次大面积暴发,发病地块减产严重,个别严重的发病地块绝产绝收,已成为对番茄产量影响最严重的病害之一[7]。目前防治番茄黄化曲叶病毒病的方法主要是选育抗病品种和利用化学药剂防治烟粉虱,但是由于中国番茄黄化曲叶病毒为单链DNA 病毒,基因重组频繁,不同地域的病毒分离物致病力存在很大差异,难以选育稳定高抗品种,至今生产上还没有稳定有效的抗病品种[8]。针对传毒介体烟粉虱的杀虫剂和多种抗病毒制剂虽然在一定程度上能控制该病害的发生、蔓延和危害,但是,化学防治容易导致作物药害、农药残留及昆虫抗药性等安全生产问题。近年来,除了利用现代生物技术如转基因工程、RNA 沉默等途径控制TYLCCV 病外[9],人们开始关注利用生物防治等安全有效的防治手段控制番茄黄化曲叶病毒病方面的研究工作。如Abdelbacki 等[10]用乳清蛋白质防治TYLCV 取得良好的效果;王春梅[11]研究了丁香酚对番茄抗黄化曲叶病毒的诱导机理,结果表明丁香酚可以通过提高抗病相关酶活性,增强番茄植株对中国番茄黄化曲叶病毒的抗性。在番茄黄化曲叶病毒病害生防菌株的筛选方面,邢卫锋等[12]筛选出2 株对该病害大田防治效果稳定,且可提高番茄产量和改善番茄品质的生防细菌。
内生枯草芽胞杆菌EBS05(CGMCC No.5239)是从樟树周皮组织中分离的1 株生防细菌。前期研究结果表明,菌株EBS05 对小麦、烟草、黄瓜和辣椒等植物具有明显的促生长作用,同时,该菌所产生的脂肽类抗生素Surfactin A 是诱导烟草对烟草花叶病毒(TMV)产生系统抗性的有效激发子,其诱导抗性效果达67.38%,显示出在植物病毒病害防治方面的应用潜力[13]。为了进一步挖掘内生生防细菌EBS05 的生防潜力,本试验初步研究了EBS05 对番茄抗TYLCCV 的诱导抗性作用,为有效控制番茄黄化曲叶病毒病以及新型抗病毒微生物农药的研制提供依据。
1 材料与方法
1.1 试验材料
生防细菌EBS05 由河南农业大学植物保护学院植物病害生物防治研究室分离、保存;供试植物材料番茄(江蔬14 号)和TYLCCV 侵染性克隆,分别由江苏省农业科学院食品质量安全与检测研究所和植物保护研究所提供。
1.2 试验方法
1.2.1 试验处理 选取长势一致的5 叶期番茄幼苗120 株,分别做如下处理:①50 ml 清水灌根未接种处理(CK);②50 ml 清水灌根处理1 d 后接种TYLCCV(T1);③50 ml EBS05 菌悬液(菌液浓度为108CFU/ml)灌根处理(T2);④50 ml EBS05 菌悬液(菌液浓度为108CFU/ml)灌根处理1 d 后接种TYLCCV(T3)。
1.2.2 试验方法
1.2.2.1 菌株EBS05 对番茄抗TYLCCV 的诱导效果 EBS05 菌悬液灌根处理后自然生长21 d 后,观察番茄植株的生长情况,统计平均株高、根长、鲜质量、干质量等生理指标;接种TYLCCV 后第20 d 调查发病情况,参照Friedmann 等[14]报道的分级标准计算病情指数和诱抗效果。
病情指数(DI)= ∑(发病株数× 发病级数)/(调查总株数×最高病级数)×100
诱抗效果=(对照平均病情指数一处理平均病情指数)/对照平均病情指数×100%
1.2.2.2 菌株EBS05 对番茄叶片防御酶活性的影响 分别于接种TYLCCV 后1 d、3 d、5 d、7 d、9 d、11 d、13 d 和15 d 取番茄同一部位的叶片用于相关生理指标的测定,3 次重复。粗酶液提取采用易龙等[15]报道的方法;超氧化物歧化酶(SOD)活性采用氮蓝四唑还原法[16]测定;过氧化物酶(POD)活性采用愈创木酚比色法[17]测定;多酚氧化酶(PPO)活性参照雷东峰等[18]报道的方法测定;苯丙氨酸氧化酶(PAL)活性参照刘太国等[19]报道的方法测定。
1.2.2.3SOD、POD和PPO同工酶电泳分析 参照苏杭等[20]报道的方法略有改动。同工酶电泳采用10%分离胶、5%浓缩胶,上样量为25 μl,于4 ℃下电泳,电压80 V 预电泳1 h,浓缩胶80 V 电泳30 min,分离胶110 V 电泳5 h。SOD和PPO同工酶染色参照文才艺[21]报道的方法,POD同工酶染色参照刘素纯等[22]报道的方法。
2 结果与分析
2.1 菌株EBS05 对番茄抗黄化曲叶病毒的诱导效果
研究结果显示,EBS05 菌悬液诱导处理后,对番茄植株的促生作用明显(图1),其平均株高、根长、鲜质量和干质量等生理指标明显大于清水对照。接种TYLCCV 处理后,经EBS05 诱导处理的番茄植株发病时间延迟,对照植株接种TYLCCV 后第9 d 开始发病,而菌株EBS05 诱导处理的植株在接种TYLCCV 后第15 d 开始出现轻微症状,且植株长势明显优于对照;接种TYLCCV 后第15 d,对照植株叶片出现变小、卷曲和黄化等典型症状,而菌株EBS05诱导处理的植株仅顶端个别叶片出现卷曲和黄化现象,其他部位叶片症状不明显;接种TYLCCV 后20 d,菌株EBS05 诱导处理的植株病情指数显著低于对照,诱导抗病性效果为53.60%(表1)。

图1 菌株EBS05 对番茄植株的促生效果Fig.1 Growth promotion of tomato plants by strain EBS05

表1 菌株EBS05 对番茄植物的诱抗效果Table 1 Induced resistance in tomato by strain EBS05
2.2 菌株EBS05 诱导处理后番茄体内防御酶活性的变化
2.2.1 超氧化物歧化酶(SOD)活性 由图2 可见,仅接种TYLCCV 或仅用菌株EBS05 诱导处理以及菌株EBS05 诱导处理再接种TYLCCV,叶片中SOD活性均较清水对照明显提高,其中,菌株EBS05 诱导处理再接种TYLCCV,SOD活性增加幅度最大,且于接种后第7 d 达到最高峰值,显著高于清水对照和其他处理。仅用菌株EBS05 诱导处理时SOD活性变化趋势与对照基本一致,且相对稳定,接种TYLCCV 后,SOD活性发生明显的变化。由此可见,菌株EBS05 诱导处理再接种TYLCCV 后植株体内SOD活性的变化是菌株EBS05 诱导植物与TYLCCV 互作的结果。

图2 不同处理下番茄体内超氧化物歧化酶(SOD)活性的变化Fig.2 Changes of SOD activity in tomato plants with different treatments
2.2.2 过氧化物酶(POD) 活性 如图3 所示,仅接种TYLCCV 后1 ~3 d,POD活性变化不大,至第5 d 时,迅速增加,之后,逐渐降低,至第9 d 后,始终低于清水对照;仅用菌株EBS05 诱导处理后1 ~5 d,POD活性降低,处理后第7 d 开始,活性迅速升高,且活性值始终显著高于清水对照;菌株EBS05 诱导处理再接种TYLCCV 后3 ~15 d,POD活性均较清水对照显著增加,其中,接种后第11 d 达到高峰值。
2.2.3 多酚氧化酶(PPO) 活性 如图4 所示,仅接种TYLCCV 后第1 d,PPO活性略有下降,接种后3 ~7 d,PPO活性表现为先升高后下降,处理后至第9 ~15 d,PPO活性始终低于清水对照;仅用菌株EBS05 诱导处理后,除了处理后第1 d,PPO活性显著降低于清水对照外,处理后第3 ~15 d,PPO活性均显著高于清水对照,其中,处理后第7 d 时,达到高峰值;菌株EBS05 诱导处理再接种TYLCCV 后,PPO活性均显著高于清水对照,其中,处理后第3 d,达到最高峰值。
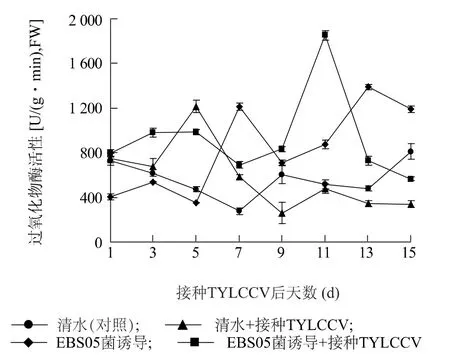
图3 不同处理下番茄体内过氧化物酶(POD)活性的变化Fig.3 Changes of POD activity in tomato plants with different treatments

图4 不同处理下番茄体内多酚氧化酶(PPO)活性的变化Fig.4 Changes of PPO activity in tomato plants with different treatments
2.2.4 苯丙氨酸解氨酶(PAL) 活性 如图5 所示,仅接种TYLCCV 处理或仅用菌株EBS05 诱导处理以及菌株EBS05 诱导处理再接种TYLCCV,番茄植株体内PAL活性均高于清水对照。其中,菌株EBS05 诱导处理后,PAL活性呈逐渐升高趋势,至处理后第9 ~15 d,PAL活性稳定保持在较高水平。菌株EBS05 诱导处理再接种TYLCCV 后1 ~7 d 后,PAL活性逐渐增加,且显著高于清水对照和其他处理;菌株EBS05诱导处理再接种TYLCCV 后9 ~15 d,PAL活性逐渐降低,但均高于清水对照和仅接种TYLCCV 处理。

图5 不同处理下番茄体内苯丙氨酸解氨酶(PAL)活性的变化Fig.5 Changes of PAL activity in tomato plants with different treatments
2.3 菌株EBS05 诱导处理后番茄植株体内同工酶的变化
2.3.1 超氧化物歧化酶(SOD) 同工酶 如图6 所示,清水对照番茄植株体内SOD同工酶均显示2 条谱带,而其他处理,同工酶谱带均较清水对照强(亮),且均出现1 条新的同工酶谱带。该结果与SOD活性测定结果一致,处理后SOD活性升高可能与新的同工酶产生有关。3 个处理组中,菌株EBS05诱导处理再接种TYLCCV 后的同工酶带强度最强,仅用菌株EBS05 诱导处理和仅接种TYLCCV 处理后同工酶带强度基本一致,进一步印证了菌株EBS05 对植株体内SOD活性的影响是EBS05 诱导植物与TYLCCV 互作的结果。
2.3.2 过氧化物酶(POD) 同工酶 如图7 所示,各处理同工酶带的强度对比情况与POD活性测定结果一致。清水对照和仅接种TYLCCV 处理,植株体内POD同工酶均为2 条谱带,菌株EBS05 诱导处理和菌株EBS05 诱导再接种TYLCCV 后,分别于处理后第3 d 和11 d 产生1 条新的POD同工酶带,表明菌株EBS05 可诱导番茄产生新的POD同工酶带。
2.3.3 多酚氧化酶(PPO) 同工酶 如图8 所示,仅接种TYLCCV 后1 ~5 d,PPO同工酶谱带与清水对照一致,均为2 条,但是条带的强度明显增强,处理后7 ~15 d,小分子量的同工酶带明显减弱,甚至消失;仅用菌株EBS05 诱导处理后1 ~3 d,PPO同工酶带明显减弱,处理后第5 d 起,同工酶带逐渐增强,第7 ~13 d,产生新的同工酶带;菌株EBS05 诱导处理再接种TYLCCV 后,无新的PPO同工酶带产生,但是同工酶带明显增强。表明,番茄接种TYLCCV 后7 ~11 d,植株开始发病,而用菌株EBS05 诱导处理后,能有效控制病害的发生,由此推测,TYLCCV 侵染可抑制PPO同工酶的形成,而新PPO同工酶带的产生可能是菌株EBS05 诱导番茄系统抗病性的结果。

图6 不同处理下番茄体内超氧化物歧化酶同工酶的变化Fig.6 Changes of SOD isozymes in tomato plants with different treatments

图7 不同处理后番茄体内过氧化物酶同工酶的变化Fig.7 Changes of POD isozymes in tomato plants with different treatments
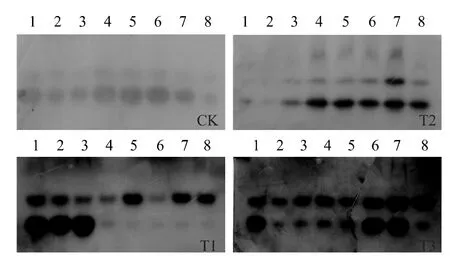
图8 不同处理下番茄体内多酚氧化酶同工酶的变化Fig.8 Changes of PPO isozymes in tomato plants with different treatments
3 讨论
研究寄主植物与病原物互作或寄主植物抗病性生理生化机制是植物病害防治的重要基础工作之一。大量研究结果表明,超氧化物歧化酶(SOD)活性、过氧化物酶(POD)活性、多酚氧化酶(PPO)活性和苯丙氨酸解氨酶(PAL)活性等防御酶活性与植物抗病性密切相关,不同植物病害体系其相关的程度不同。SOD是生物体中最重要的活性氧自由基清除酶,可以减轻植物体内自由基对细胞的损伤。POD是植物体内重要的氧化酶,可以催化脂肪酸、芳香胺和酚类物质的氧化,是木质素合成的关键酶之一,还参与乙烯的生物合成和氧自由基的消除反应。PPO能将酚类物质氧化成对病原菌有毒的醌类物质,进而抑制病原菌并阻止其扩展。PAL是苯丙烷类代谢途径中的关键酶和限速酶,能催化苯丙胺酸脱氨基后产生肉桂酸,最终转化成木质素。本研究结果结果表明,菌株EBS05 诱导处理后,番茄体内SOD、PPO和PAL活性均有不同程度的提高,POD活性在诱导处理后1 ~5 d 略有下降,但是从诱导处理后第7 d 起,活性迅速升高,其始终显著高于清水对照。诱导处理再接种TYLCCV 后,SOD、POD、PPO和PAL活性均明显高于清水对照。结合番茄黄化曲叶病毒病病程分析,番茄植株在接种TYLCCV 后第9 d 开始发病,而第9 d 后,诱导处理的番茄植物体内SOD、POD、PPO和PAL活性均显著高于清水对照,由此可见,菌株EBS05 诱导处理后番茄植物黄化曲叶病毒病害表现延迟和发病程度减轻与番茄体内防御酶活性的提高有一定的相关性。该研究结果与苯并噻二唑(BTH)和核黄素诱导番茄抗番茄黄化曲叶病毒的报道一致[23-24]。病原物侵染导致寄主植物体内一系列与酚类代谢相关的酶活性变化是病程中普遍发生的现象,常见的酶包括POD、PPO和PAL等,这些酶除参与酚类物质代谢外,还参与木质素、植保素等次生抗菌物质的形成和积累,因此是人们研究植物抗病生理生化机制的重要内容[25]。本研究结果表明,接种TYLCCV 后7 ~15 d(发病期),POD和PPO活性显著低于对照,相应的同工酶积累量也减弱,尤其是PPO同工酶,在接种7 d 后小分子量的同工酶谱带显著减弱。而用生防细菌EBS05 诱导处理后7 ~15 d,POD和PPO活性均显著提高,且产生新的同工酶谱带。从PAL活性变化结果来看,用生防细菌EBS05 诱导处理后第5 d起,其活性逐渐增加,并于第9 d 后(对照开始发病),始终维持在较高的活性水平。内生细菌EBS05 诱导处理再接种TYLCCV 后,PPO活性变化更为敏感,其高峰值出现在接种后第3 d,早于PAL、POD和SOD活性高峰值的出现。由此可以推测,内生细菌EBS05诱导番茄对TYLCCV 的抗病性可能与番茄体内酚类代谢途径密切相关。
[1] HARRISON B D,ROBINSON D J.Natural genomic and antigenic variation in whitefly transmitted geminivirus(Begomoviruses)[J].Annual Review Phytopathology,1999,37:369-398.
[2] 何 鑫,赵统敏,赵丽萍,等.间作及几种物理防治对番茄黄化曲叶病毒病的防控效果[J].江苏农业科学,2013,41(5):86-90.
[3] PICO B,DIEZ M J,NUEZ F.Viral diseases causing the greatest economic losses to the tomato cropⅡ.The tomato yellow leaf curl virus:a review[J].Scientia Horticulturae,1996,67:151-196.
[4] BOULTON M I.Gemini viruses:major threats to world agriculture[J].Annals of Applied Biology,2003,142:143.
[5] POLSTON J E,ANDERSON P K.The emergence of whiteflytransmitted Gemini viruses in tomato in the western hemisphere[J].Plant Disease,1997,81:1358-1369.
[6] AVGELIS A D,RODITAKIS N,DOVAS C I,et al.First report of tomato yellow leaf curl virus on tomato crops in Greece[J].Plant Disease,2001,85(6):678.
[7] 刘剑峰,肖启明,张德咏,等.番茄黄化曲叶病(TYLCV)的研究进展[J].中国农学通报,2013,29(13):70-76.
[8] 孙书娥,唐前君,刘 勇,等.RNA 沉默介导的转基因烟草抗中国番茄黄化曲叶病毒研究[J].农业生物技术学报,2013,21(5):530-536.
[9] 唐前君.双生病毒外壳蛋白和传毒相关蛋白基因介导的病毒抗性研究[D].长沙:湖南农业大学,2010.
[10] ABDELBACKI A M,TAHA S H,SITOHY M Z,et al.Inhibition of tomato yellow leaf curl virus(TYLCV)using whey proteins[J].Virology Journal,2010,7:26-30.
[11] 王春梅.丁子香酚和接种番茄黄化曲叶病毒对番茄几丁质酶和β-1,3-葡聚糖酶活性的影响[J].江西农业学报,2013,25(9):78-80.
[12] 邢卫锋,丁雪玲,柯红娇,等.番茄黄化曲叶病毒病生防菌的筛选及防治效果研究[J].江苏农业科学,2013,41(9):110-112.
[13] 周 蕊.内生细菌EBS05 诱导烟草抗TMV 机理的研究[D].郑州:河南农业大学,2013.
[14] FRIEDMANN M,LAPIDOT M,COHEN S,et a1.A novel source of resistance to tomato yellow leaf curl virus exhibiting a symptomless reaction to viral infection[J].Journal of the American Society for Horticultural Science,1998,123(6):1004-1007.
[15] 易 龙,严占勇,肖崇刚,等.拮抗疫病芽孢杆菌对辣椒的控病及诱导抗性[J].西南大学学报:自然科学版,2009,31(8):48-51.
[16] 姜慧芳,任小平.干旱胁迫对花生叶片SOD活性和蛋白质的影响[J].作物学报,2004,30(2):169-174.
[17] 覃 鹏,孔治有,刘叶菊,等.不同破除休眠处理对小麦新种子POD活性的影响[J].中国粮油学报,2012,27(6):5-8.
[18] 雷东锋,蒋大宗,王一理.烟草中多酚氧化酶的生理生化特征及其活性控制的研究[J].西安交通大学学报,2003,37(12):1316-1320.
[19] 刘太国,李永镐,陈万权.水杨酸对感染TMV 烟草叶片PAL活性的影响[J].西北农林科技大学学报:自然科学版,2005,33(8):111-114.
[20] 苏 杭,王春梅,陈 浩,等.丁香酚对烟草抗烟草花叶病毒的诱导作用初探[J].农药学学报,2012,14(1):24-29.
[21] 文才艺.烟草感染PVYN后生理生化变化规律的研究[D].沈阳:沈阳农业大学,1999.
[22] 刘素纯,萧浪涛,廖柏寒,等.铅胁迫对黄瓜幼苗抗氧化酶活性及同工酶的影响[J].应用生态学报,2006,17(2):300-304.
[23] 于 力,孙 锦,郭世荣,等.苯并噻二唑诱导番茄对番茄黄化曲叶病毒病的抗性[J].江苏农业学报,2013,29(1):71-75.
[24] 黑银秀,朱为民,郭世荣,等.核黄素和接种番茄黄化曲叶病毒对番茄叶片防御酶活性的影响[J].西北植物学报,2011,31(11):2252-2258.
[25] 高必达,陈 捷.生理植物病理学[M].北京:科学出版社,2006:153-160.

