耐盐差异性不同棉花品种的抗氧化酶活性及SNP/InDel分析
何林池, 王 康, 魏小云, 荣 平, 王亚峰
(1.江苏沿江地区农业科学研究所,江苏 南通226541;2.南通大学生命科学学院,江苏 南通226019)
盐害是沿海滩涂地区作物生产中常见的非生物胁迫。土壤盐渍化是一个世界性的资源问题和生态问题,1.0 ×109hm2的盐渍土约占全球陆地面积的7.6%[1],广泛分布在100 多个国家和地区。而且,由于土壤的次生盐渍化,全球盐渍化面积还在迅速增加,每年约有1.0 ×107hm2土地因土壤的次生盐渍化而废弃。中国是世界盐碱地面积较大的国家之一,其中海涂土壤近2.41 ×106hm2,占海岸带土壤总面积的17.35%[2]。因此,加速沿海滩涂的开发利用并解决土地盐渍化的生态问题迫在眉睫,而开发耐盐性强的农作物品种是一条有效的措施。棉花是耐盐性较强的农作物,通常能够在含盐量0.3%以下的土壤里正常生长,并产生较好的经济效益[3];然而,沿海滩涂和盐渍化地区的土壤含盐量远远超过0.3%,因此研究棉花的耐盐机制,筛选并培育出耐盐性更强的棉花品种,对农业生产意义重大。
自由基是正常的机体代谢中间产物[4-6]。低浓度自由基是机体正常生理功能所必需的,但自由基含有未配对电子,具有高度反应活性,可引发链式自由基反应,过量的自由基会损伤机体。在衰老或逆境条件下,棉花体内活性氧自由基如O-2、H2O2水平过高,会影响植株的正常生长和产量。在棉花体内存在着抗氧化酶体系,包括超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)等,可以清除体内多余的活性氧自由基,从而保证体内自由基处于较低水平,使自身免受其伤害。抗氧化酶活性的提高是活性氧自由基增加和胁迫条件下减少氧伤害和保护系统建立的标志。这些不同的抗氧化酶协同作用共同抵抗盐分胁迫所诱导的氧化伤害[7]。然而,一旦逆境胁迫超过一定范围后,自由基大量产生,抗氧化酶系统无法有效地将多余的自由基清除,破坏了体内平衡,会严重影响棉花的生长。因此抗氧化酶体系与棉花的耐盐性息息相关。
中棉所35 与中棉所12 亲缘关系较近而耐盐性差异显著[8],其耐盐差异性机理值得探讨。本研究旨在揭示盐胁迫下棉花抗氧化酶体系的生理活性变化,深入了解棉花耐盐性生理调节机理;同时,以陆地棉遗传标准系TM-1 为参考,对中棉所35 和中棉所12 单核苷酸多态性(SNP)进行初步鉴定,为棉花耐盐分子育种提供科学依据。
1 材料与方法
1.1 试验材料
耐盐材料中棉所35、盐敏感材料中棉所12 和陆地棉遗传标准系TM-1 均由中国农业科学院棉花研究所国家棉花种质资源中期库提供。
取中棉所35 和中棉所12 两个棉花品种种子各30 粒,在水中浸泡12 ~24 h,然后采用双层滤纸发芽法促使种子发芽。具体操作如下:将滤纸用蒸馏水浸湿铺于培养皿中,然后取泡好的棉花种子均匀摆放在滤纸上,再用一张浸湿的滤纸盖在种子上,每天用洗瓶将上层滤纸适量喷湿,同时观察记录种子发芽情况。待棉花种子发芽以后,分别种植到装好营养土的小纸杯当中,放到培养箱中培养,每天浇适量的水。10 d 后,将棉花幼苗移栽到桶中,每个品种选取15 颗生长状况良好且相对一致的棉花幼苗,分成3 组作为3 次重复,每组5 颗。待棉花长出4 片叶子以后,每个品种每组取4 株 分 别 用100 mmol/L、200 mmol/L、300 mmol/L、400 mmol/L NaCl 溶液浇灌,1 d 浇2 次,每次浇100 ml;剩余1 株作为空白对照,浇等量清水。盐胁迫处理后3 d,在同一时刻,每组取相同叶位的叶片,装入50 ml 离心管,用以测定3 种抗氧化酶的活性。另取TM-1 种子3 粒,同上催芽种植,以备提取基因组DNA。
1.2 抗氧化酶活性的测定
称取棉花叶片0.5 ~1.0 g,加入5 ~10 ml 提取液[50 mmol/L PBS(pH 7.8,含0.1 mmol/L EDTA、0.3% Triton X-100、0.4%聚乙烯吡咯烷酮)],研磨后用纱布过滤,4 ℃下15 000 r/min离心20 min,上清液为粗酶液。将粗酶液稀释约10 倍,用于酶活性的测定。CAT、POD和SOD活性测定采用紫外分光光度法[9]。
1.3 SNP/InDel 分析
1.3.1 DNA 提取 取中棉所12、中棉所35 及陆地棉遗传标准系TM-1 的新鲜幼嫩叶片进行DNA 的分离纯化。棉花叶片基因组总DNA 的分离与纯化参考Paterson 等[10]的方法,并略作改进。
1.3.2 PCR 扩增及电泳 选用棉花耐盐相关ESTSSR 引物NTU060 对以上3 份材料进行PCR 扩增。PCR 反应体系:1 μl 模板DNA(约50 ng/μl),1 μl dNTPs(2 mmol/L),1 μl 10 × Buffer(含25 mmol/L Mg+),1 μl 引 物(正 向 引 物 和 反 向 引 物,2 μmol/L),1 UTaq酶,最后加ddH2O 至总体积为10 μl。PCR 扩增程序:94 ℃预变性3 min;94 ℃变性30 s,57 ℃退火45 s,72 ℃延伸1 min,共30 个循环;72 ℃延伸7 min,最后4 ℃恒温保存。聚丙烯酰胺凝胶电泳:采用12%的聚丙烯酰胺凝胶,150 V 恒压电泳2 h,银染方法参照张军等[11]。
1.3.3 DNA 测序及序列分析 从12%的聚丙烯酰胺非变性胶中回收条带,放入干净的离心管中,加入100 μl ddH2O,室温放置10 ~30 min,100 ℃煮沸15 min,自然冷却。从中取10 μl 上清液为模板,用原来的引物组合和反应条件重新做PCR。取5 μl 扩增产物在1.2%的琼脂糖凝胶上检测,确信扩增成功后将剩余产物委托上海捷瑞生物工程有限公司进行克隆测序。用DNAMAN 软件对测序结果进行多序列比对分析。
2 结果与分析
2.1 盐胁迫下棉花SOD 活性变化
不同盐浓度处理下棉花SOD活性与盐浓度的关系见图1,耐盐品种中棉所35 在不同盐胁迫下SOD活性的变化较小,随着盐浓度的增大略有上升趋势。盐敏感品种中棉所12 的SOD活性随着盐浓度的增加呈现先增加后下降的趋势,在300 mmol/L的盐胁迫下活性达到最高。当盐浓度达到400 mmol/L时,盐敏感品种中棉所12 的SOD活性开始低于耐盐品种中棉所35。
2.2 盐胁迫下棉花CAT 活性变化
耐盐品种中棉所35 在100 mmol/L的盐浓度处理下酶活性最高,盐敏感品种中棉所12 在200 mmol/L的盐浓度处理下酶活性最高;两个品种的CAT活性变化趋势都是先增加后下降,而中棉所35 在盐处理下CAT整体活性水平高于中棉所12(图2)。
2.3 盐胁迫下棉花POD 活性变化
由图3 可以看出两个棉花品种的POD活性随着盐浓度的增加都呈现出先上升后下降的趋势。其中耐盐品种中棉所35 在盐浓度为100 mmol/L 时POD活性达到最大值,而盐敏感品种中棉所12 在盐浓度为200 mmol/L时POD活性达到最大值。总体而言,相对于中棉所12,中棉所35 的POD活性处于较高的水平。

图1 盐胁迫对不同棉花品种SOD 活性的影响Fig.1 Effect of salt stress on SOD activity in different cotton varieties
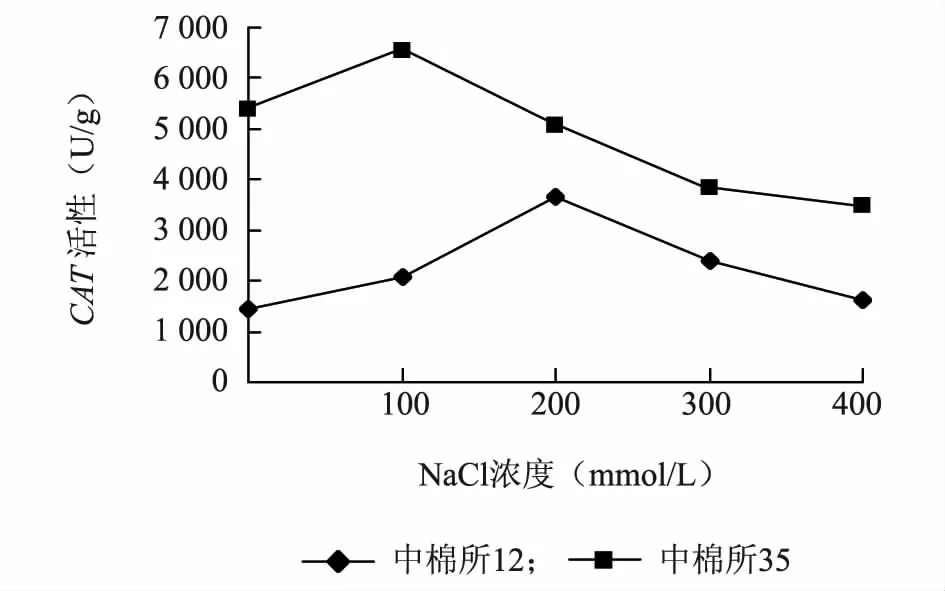
图2 盐胁迫对不同棉花品种CAT 活性的影响Fig.2 Effect of salt stress on CAT activity in different cotton varieties
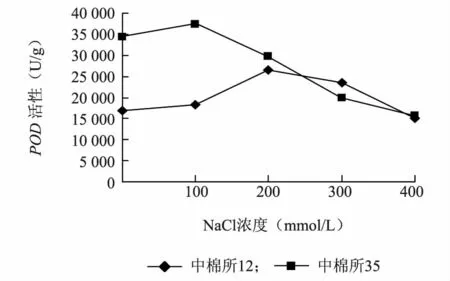
图3 盐胁迫对不同棉花品种POD 活性的影响Fig.3 Effect of salt stress on POD activity in different cotton varieties
2.4 DNA 测序及序列分析
选择针对棉花耐盐相关EST 序列开发的SSR引物NTU060[SSR 重复类型为(TAA)3,其对应的拟南芥基因编号为AT5G57110.2],对中棉所35、中棉所12 进行扩增,同时对陆地棉遗传标准系TM-1 进行扩增以作为对照,再进行序列比对以初步了解其单核苷酸水平的差异。序列比较结果显示,NTU060扩增的产物在这3 份材料中存在着单核苷酸多态性(Single nucleotide polymorphism,SNP),其中包括转换、碱基缺失或插入(Insertion/deletion,InDel)。耐盐品种中棉所35 和盐敏感品种中棉所12 的扩增产物在第124 碱基处存在有1 个InDel,在第169 碱基处存在1 个A/G 转换,在第175 碱基处存在1 个C/T转换(图4)。
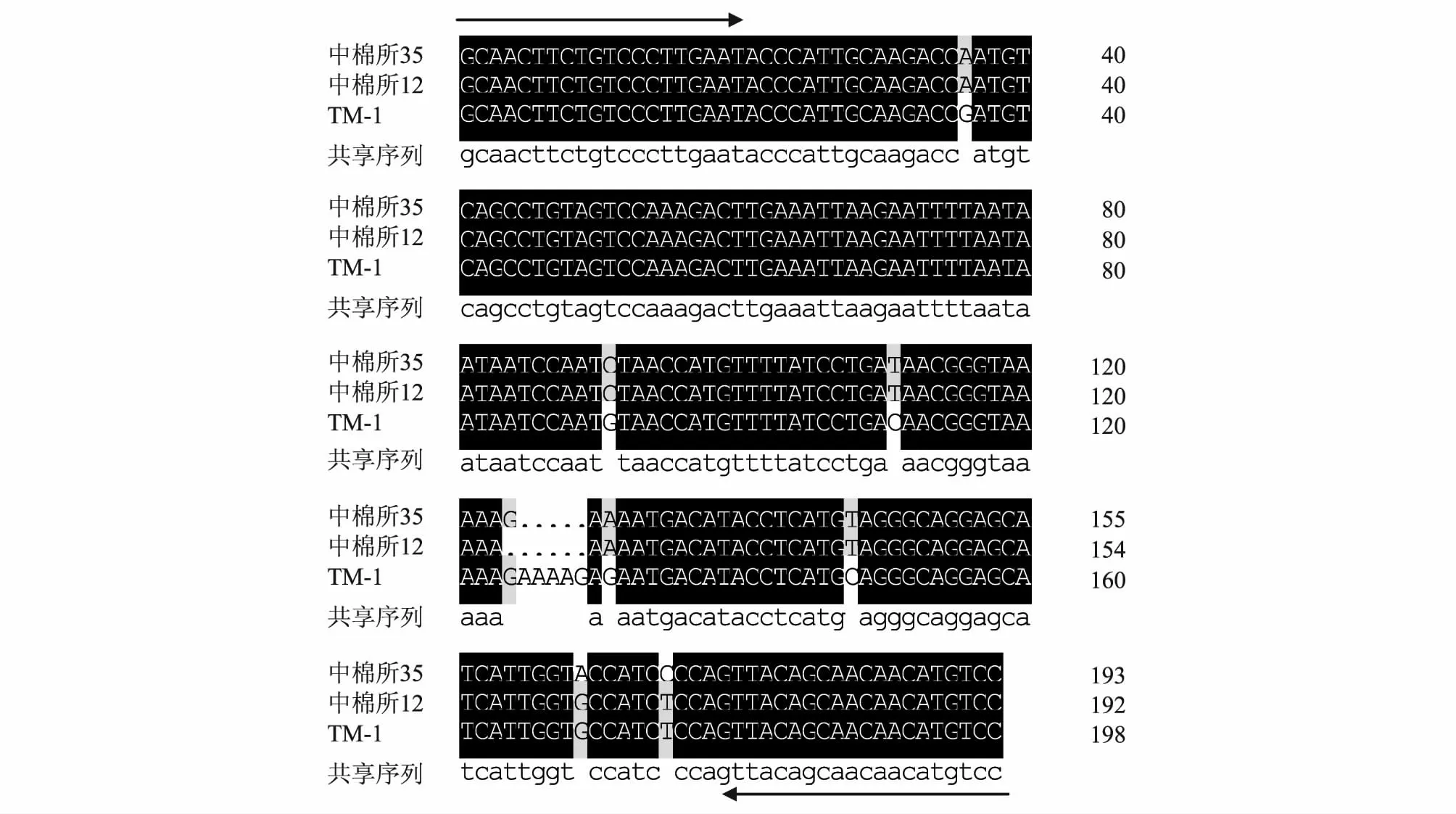
图4 SSR 引物NTU060 在中棉所35、中棉所12 及TM-1 中的扩增产物序列比对Fig.4 Multi-sequence alignment of SSR products of CCRI 35,CCRI 12 and TM-1 with primer NTU060
3 讨论
逆境条件下,自由基大量产生,植物体内原有的平衡被打破,从而对植物体产生伤害。超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和过氧化物酶(POD)作为植物内源的活性氧清除剂,是清除H2O2等活性氧自由基的重要保护酶,在一定程度上保护着细胞膜系统[12]。在逆境中维持较高的抗氧化酶活性,才能有效地清除活性氧使之保持较低水平,从而减少其对膜结构和功能的破坏,因而保护酶体系在抗逆境研究中颇受重视。王秀玲等[13]在盐胁迫对甜高粱生理生化特性的影响研究中发现,NaCl 胁迫不同程度地提高了不同甜高粱材料的SOD、CAT及POD活性,不同浓度的NaCl 胁迫后不同甜高粱材料SOD、CAT及POD活性的变化趋势有所不同,这可能是它们耐盐差异的生理原因之一。杨淑萍等[14]的研究结果表明,海岛棉耐盐品种在低浓度NaCl 处理下可通过提高根、叶内的POD、CAT活性来清除多余的活性氧,在高浓度NaCl 处理下,CAT活性受到抑制;而盐敏感品种在低浓度NaCl 胁迫下抗氧化酶活性便受到抑制,生物膜受影响,引起膜脂过氧化。本试验中,在不同浓度的盐胁迫下棉花耐盐品种和盐敏感品种的SOD、CAT及POD酶活性变化表现不同。
SOD是一种典型的诱导酶,它的活性变化在一定程度上反映了植株受胁迫的程度。SOD是抗氧化系统中一种极为重要的酶,在酶保护系统中处于核心地位[15]。SOD的主要功能是清除O-2,生成无毒的O2和毒性较低的H2O2(2 O-2+2H+→O2+H2O2)。在本试验中,中棉所35 的SOD活性随着盐浓度的上升基本保持不变,其活性的相对稳定说明该品种的SOD有较强的耐盐性;中棉所12SOD活性的变化趋势表明一在定盐浓度范围内,机体为了适应逆境环境产生过多的自由基,引起SOD活性的上升,清除过多的自由基从而保护机体的膜系统,但随着盐浓度的继续增加,棉花叶片细胞内氧自由基含量的增加导致膜脂过氧化加剧,使酶活性下降,降低了对细胞的保护作用。值得注意的是,中棉所12的SOD活性并没有一直低于中棉所35,说明单一的抗氧化酶活性变化还不能说明棉花耐盐性的强弱,因为植物抗氧化系统包括酶系统(CAT、POD、SOD等)和非酶系统(植物体内一些还原性物质如抗坏血酸、胡萝卜素、谷胱甘肽等)[16],另外一些小分子糖、多元醇、甜菜碱、脯氨酸等也有一定的清除细胞内自由基伤害的作用[17]。
Thompson 等[18]研究发现,在有Fe2+等过渡金属离子存在的条件下,H2O2可与O-2通过Harber-Weiss 反应生成氧化能力更强的·OH,直接进攻膜脂的不饱和脂肪酸,引发过氧化作用。而CAT可直接催化H2O2的分解,从而能有效地清除生物体内的过氧化氢对生物分子的氧化作用,因此,生物体内存在CAT是其保护自身免受·OH 毒害的关键。此外,POD亦能通过催化H2O2与其他底物反应以消耗H2O2从而清除植物体内的H2O2。
多位学者通过对基因转录水平的研究发现,植物的耐盐性在分子及生理水平上都是由复杂的机制来调控的[19]。某些基因型植物具有高效的信号感知能力并且在转录水平上发生改变,使它们对环境胁迫具有适应性和完全的耐受性。在本试验中,可能由于耐盐品种的耐盐基因具有高效的信号感知能力,在盐胁迫下CAT及POD活性提高更快,以减少自由基的伤害,从而表现出耐盐品种的CAT和POD活性高于盐敏感品种。在一定盐浓度及一定时间内,随着盐浓度的上升,机体内的活性氧自由基大量产生,导致CAT、POD的活性都有所上升,以此来清除棉花体内多余的自由基,从而保护细胞膜的正常功能,以此保证机体的正常生长;超过一定的盐浓度后,活性氧自由基越来越多,CAT、POD已不能有效清除体内多余自由基,平衡被破坏,膜脂过氧化加剧,植株处于不正常生长的状态,从而使CAT、POD的活性下降。盐敏感品种中棉所12 在不同浓度盐胁迫下CAT、POD活性的变化趋势与中棉所35 基本保持一致,但是由于该品种的耐盐性决定了CAT、POD活性在整体上低于中棉所35,说明对于同样的外界环境,盐敏感品种不如耐盐品种更能有效清除自由基的毒害作用,棉花品种间耐盐性差异与保护酶活性的变化密切相关[20]。
在盐处理过程中SOD、CAT及POD的活性反应整体上一致性,但是后两种酶表现得更敏感些。孔治有等[21]的研究结果表明,在45 ℃高温处理下,SOD的活性变化也不明显。因此,结合我们的实验结果来看,可能是由于SOD具有很强的抗逆性,盐处理对SOD活性的影响较小,亦或是盐处理的梯度过少。
本研究结果表明,分析盐胁迫下抗氧化酶活性与棉花耐盐性的关系时,不能以单一的某一种酶作为其耐盐性指标,SOD、CAT及POD的活性均与棉花的耐盐性具有相关性。虽然在盐胁迫下各种酶之间协同互作机理尚不能确定,但是这3 种酶对保护植物膜系统有着极其重要的作用,是防止作物在盐胁迫条件下受到氧化伤害的重要因素,抗氧化酶系统中酶活性的提高是盐害等逆境下的重要生理反应。在后续试验中需加大盐浓度范围,以及测定更多品种棉花的多种生理指标,更加深入地研究盐胁迫对棉花生理的影响。
中棉所35 母本为丰产品系中23021,父本为抗病、优质杂交材料(中棉所12 ×川1704),与中棉所12 亲缘关系很近,但是这两份材料的耐盐性状有显著的差别[8]。遗传背景相似而耐盐性差异显著的原因很可能是,在配置组合的过程中发生了一些细微的基因组水平上的改变,而这些改变与其差异性状包括耐盐性关系密切。因此对中棉所35 和中棉所12 的SNP/InDel 进行了初步鉴定,结果显示,耐盐品种中棉所35 和敏盐品种中棉所12 具有较多的相似序列,但同时也都存在插入/缺失和点突变,推测不同的耐盐性状可能是由基因组的点突变、插入缺失等复杂突变事件所导致的;SNP/InDel 可能对耐盐性状有调控功能,甚至是耐盐性状的一个重要的影响因素。
[1] 刘友良,汪良驹.植物对盐胁迫的反应和耐盐性[M]//余叔文,汤章城.植物生理与分子生物学.2 版.北京:科学出版社,1998:752-769.
[2] 汪 斌,兰 涛,吴为人.盐胁迫下水稻苗期Na+含量的QTL定位[J].中国水稻科学,2007,21(6):585-590.
[3] 蒋玉蓉,吕有军,祝水金.棉花耐盐机理与盐害控制研究进展[J].棉花学报,2006,18(4):248-254.
[4] 潘乔丹,黄元河,杜清华,等.核桃根和枝不同极性成分的抗氧化活性[J].江苏农业科学,2013,41(10):262-264.
[5] 石雪萍,李小华,杨爱萍.南京雨花茶中总黄酮提取以及DPPH自由基清除活性研究[J].江苏农业科学,2013,41(6):238-240.
[6] 史 娟.山茱萸多糖的提取及清除自由基作用[J].江苏农业科学,2012,40(12):289-291.
[7] MELONI D A,OLIVA M A,MARTINEZ C A,et al.Photosynthesis and activity of superoxide dismutase,peroxidase and glutathione reductase in cotton under salt stress[J].Environ Exp Bot,2003,49:69-76.
[8] 张丽娜,叶武威,王俊娟,等.棉花耐盐性的SSR 标记研究[J].棉花学报,2010,22(2):175-180.
[9] 邹 琦.植物生理学实验指导[M].北京:中国农业出版社,2000:131-161.
[10] PATERSON A H,BRUBAKER C L,WENDEL J F.A rapid method for extraction of cotton (Gossypiumspp.)genomic DNA suitable for RFLP or PCR analysis[J].Plant Molecular Biology Reporter,1993,11(2):122-127.
[11] 张 军,武耀廷,郭旺珍,等.棉花微卫星标记的PAGE/银染快速检测[J].棉花学报,2000,12(5):267-269.
[12] 高秀蕊,崔艳丽,徐富华,等.过氧化氢酶对超氧化物歧化酶清除O-2作用的影响[J].河北师范大学学报:自然科学版,1995,19(4):59-62.
[13] 王秀玲,程 序,谢光辉,等.NaCl 胁迫对甜高粱发芽期生理生化特性的影响[J].生态环境学报,2010,19(10):2285-2290.
[14] 杨淑萍,危常州,梁永超.盐胁迫对海岛棉不同基因型幼苗生长及生理生态特征的影响[J].生态学报,2010,30(9):2322-2331.
[15] SHALATA A,NEUMANN P M.Exogenous ascorbic acid (vitamin C)increases resistance to salt stress and reduces lipid peroxidation[J].Journal of Experimental Botany,2001,52(364):2207-2211.
[16] YASAR F,ELLIALTIOGLU S,YILDIZ K.Effect of salt stress on antioxidant defense systems,lipid peroxidation,and chlorophyll content in green bean[J].Russion Journal of Plant Physiology,2008,55(6):782-786.
[17] 廖 岩,彭友贵,陈桂珠.植物耐盐性机理研究进展[J].生态学报,2007,27(5):2077-2089.
[18] THOMPSON J E,LEGGE R L,BARBER R F.The role of free radicals in senescence and wounding[J].New phytol,1987,105:317-344.
[19] 化 烨,才 华,柏 锡,等.植物耐盐基因工程研究进展[J].东北农业大学学报,2010,41(10):150-156.
[20] 马 丽,侯振安,梁永超,等.NaCl 胁迫对棉花幼苗生理特性的影响[J].石河子大学学报:自然科学版,2008,26(2):180-184.
[21] 孔治有,刘叶菊,覃 鹏.人工加速老化对小麦种子CAT、POD、SOD活性和可溶性蛋白质含量的影响[J].中国粮油学报,2010,25(10):24-27.

