球形NaLa(MoO4)2∶Eu3+的微波辐射合成与发光性能
戴沈华,彭富林,朱媛媛,何秀明,郭新立
(1.东南大学材料科学与工程学院,江苏南京210096;2.苏州电器科学研究院股份有限公司,江苏苏州215011;3.东南大学电子科学与工程学院,江苏南京210096)
钼酸盐(AMoO4,A=Ca,Sr,Ba)是典型的白钨矿晶型,有着四方对称结构(空间群I41/a),其中[AO8]多面体与[MoO4]四面体之间是通过共角相连,[AO8]多面体之间是通过共边相连.在白钨矿结构中,A位的两价离子可以被一价碱金属和三价稀土金属离子代替,形成同样具有白钨矿型的稀土二钼酸盐[1-2].
Eu3+离子在红光、纯红光波段有较强的发射光谱,成为当前红色稀土荧光粉中应用最广泛的稀土离子.以白钨矿结构钼酸盐为基体的荧光粉,具有良好的物理化学稳定性.在有些碱金属和Eu3+共掺杂的MoO4
2-基团中,Mo-O具有较强的共价键,和加入的一价碱金属形成电荷补偿效应,使得Eu3+的浓度效应相对减弱,Eu3+的掺杂浓度可以很高,甚至可以达到100%的基质组成而不发生浓度猝灭[3].因此,具有电荷补偿效应的NaLa(MoO4)2∶Eu3+发光强度更高,是传统的硫化物荧光粉的好几倍[4],可以承受高功率激发,是一种新型高效的发光二极管(LED)用荧光粉.Eu3+离子激发的钼酸盐的激发光谱在紫光和蓝光附近有两个线性激发峰(470,395 nm)[4-6],也可以被紫外(峰值为 270 nm)[6]激发从而发出红光,这些波段适合作为GaN和InGaN芯片的红色荧光涂敷材料.
目前常用的钼酸盐合成法主要包括固相法[7]、溶胶 -凝胶法[8]和水热法[9]等.水热法是文献报道最多的热点合成方法之一,与传统固相法相比,具有反应温度低、合成粉体的结晶性好、产物形貌规整等优点,但是其加热过程仍然是通过热传导,无法消除加热和冷却过程中的温度梯度.微波辐射加热是一种体加热,具有加热速度快、加热均匀、无温度梯度、无滞后效应等特点.微波在化学反应中加快了合成速率,可以达到普通反应的十倍甚至千倍[10].本研究使用微波辐射加热的方法,合成具有均匀粒径尺寸的微米级NaLa(MoO4)2∶Eu3+颗粒,并测定其光致发光性能.
1 试验
1.1 NaLa(MoO4)2粉体的合成步骤
试验采用微波水热的方法合成NaLa(MoO4)2粉体.步骤如下:将La2O3(质量分数为99.99%)溶于HNO3溶液;然后缓慢蒸发多余的 HNO3,制得La(NO3)3;用蒸馏水配成一定浓度的溶液.用反应试管取适量上述溶液,先后加入不同质量的CTAB(质量分数 99.00%)和 0.391 0 g Na2MoO4·2H2O(质量分数99.00%);磁力搅拌2 min后,放到控制功率20 W的微波反应系统中反应3 h;然后自然冷却到室温;将所得沉淀用蒸馏水清洗3~5次后烘干,得到 NaLa(MoO4)2粉体.NaLa(MoO4)∶Eu3+粉体的合成,需要将Eu2O3(质量分数为99.99%)与La2O3(质量分数为99.99%)按一定物质的量比溶于HNO3溶液,然后缓慢蒸发多余的HNO3,制得硝酸盐,其他步骤与NaLa(MoO4)2粉体的合成相同.
1.2 样品表征
采用X射线衍射仪(XRD,ARL X'TRA,瑞士Thermo Electron公司)对合成的产物进行物相分析.通过扫描电子显微镜(SEM,JSM-5900,日本JEOL公司)观察合成的产物的形貌和大小.使用能谱仪(EDS,Vantage DSI,美国 Thermo公司)进行化学元素的探测.粒径分布通过马尔文Mastersizer 2000对合成的粉体的粒径进行测量.使用高分辨透射电子显微镜(HRTEM,JEM-2010UHP,日本JEOL公司)观察颗粒的显微结构.采用分子荧光光谱仪(Fluorolog 3-221,法国Jobin Yvon有限公司)测量样品的发光性能.
2 结果与讨论
2.1 CTAB浓度的影响
使用微波辐射加热的方法,合成NaLa(MoO4)2粉体,研究了表面活性剂CTAB对合成产物形貌的影响.图1为CTAB的加入浓度对产物形貌及尺寸影响的SEM像.图2为溶液中CTAB浓度不同时合成的样品粒径分布图.
由图1a可以看到,在不添加CTAB时合成的颗粒直径约800 nm,形状不规则并且黏结严重;随着溶液中加入了5 mmol·L-1的CTAB,合成的产物是粒径从100 nm到2 μm的球形颗粒.
借助图2a的粒径分布来看,粒径分布有2个峰值,一个峰值在550~631 nm,另一个峰值在2.2~2.5 μm,中心粒径D50=0.961 μm.随着 CTAB 的增加,合成产物的粒径分布有所变化.当加入CTAB为10 mmol·L-1时,形貌与加入5 mmol·L-1CTAB 的样品类似(图1c).从图2b的粒径分布可以看到,大颗粒比例降低,测得中心粒径D50=0.876 μm.增加CTAB的浓度为20 mmol·L-1,颗粒大小趋向统一(图1d).由对应的粒度分析的结构可知:单峰呈正态分布,且分布范围较窄,中心粒径在0.854 μm.CTAB的加入改善了粉体的均一性与分散性,有利于形成致密的荧光粉涂层,并提高器件的发光效率.

图1 CTAB加入量对产物的形貌尺寸影响的SEM像

图2 溶液中CTAB浓度不同时合成的样品粒径分布图
2.2 结构与成分分析
图3为NaLa(MoO4)2粉体图谱.微波辐射合成的球形NaLa(MoO4)2粉体通过Cu包埋减薄后进行TEM的观察.
图3a是一个减薄后的颗粒的碎片,右下角的电子衍射图表明该样品是多晶颗粒,(112)晶面上衍射强度比其他方向大;图3b是典型的高分辨像,可以看到晶面大部分沿[112]取向,测得其晶面间距约为 0.318 nm,对应了四方相 NaLa(MoO4)2的(112)晶面的面间距;图3c的EDS谱图说明了样品中只含有O,Na,Mo和La等元素,没有检测到其他的杂质元素,另外探测到的Cu元素来自透射制样包埋的Cu;图3d为对应样品的XRD图谱,所有的峰均与标准卡片JSPDS No.79-2243相对应(四方晶系,空间群为I41/a(88)),进一步说明合成产物是纯的NaLa(MoO4)2相.
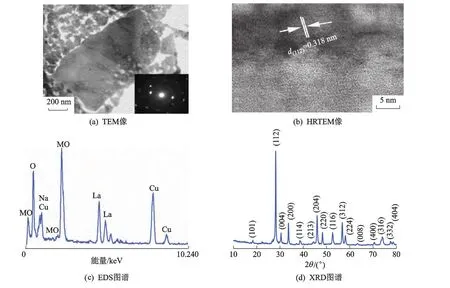
图3 NaLa(MoO4)2图谱
2.3 光学性能
对微波水热合成的球形NaLa(MoO4)2∶Eu3+(摩尔分数为10%)进行了室温PL谱的研究.图4为监测波长616 nm时NaLa(MoO4)2∶Eu3+的激发光谱.

图4 λem=616 nm,NaLa(MoO4)2∶Eu3+的室温激发光谱图
该光谱主要由两部分构成[4,11-13]:在 250 ~350 nm的连续谱为基质吸收,对应了Mo6+-O2-和Eu3+-O2-的电荷转移;在350~500 nm段有很多尖锐的吸收峰,为Eu3+离子的f-f跃迁吸收,其中在394 nm处的峰归属于Eu3+的7F0→5L6跃迁,位于464 nm的激发峰归属于7F0→5D2跃迁,说明了球形粉体能被394 nm的近紫外光和464 nm蓝光有效地激发,进而与近紫外和蓝色LED芯片的发射范围相匹配.其余激发峰分别对应Eu3+的7F0→5D4,7F0→5GJ,7F0→5L7,7F0→5D3和7F0→5D1跃迁.
室温下,椭圆形NaLa(MoO4)2∶Eu3+的激发光谱如图5所示.394 nm激发的发射光谱由一组尖峰组成,为Eu3+的特征谱线,分别属于Eu3+的不同初态5D0到终态7FJ(J=1 ~4)的跃迁[2,4,13].
2个主要发射峰:位于590 nm附近较弱的峰,是由Eu3+磁偶极子跃迁5D0→7F1引起的;位于616 nm主发射峰是由Eu3+电偶极子的5D0→7F2的跃迁引起的.5D0→7F2跃迁比5D0→7F1强,说明Eu3+占据非反演对称中心的位置.其余在653和701 nm处的弱峰对应于Eu3+的5D0→7F3和5D0→7F4跃迁.
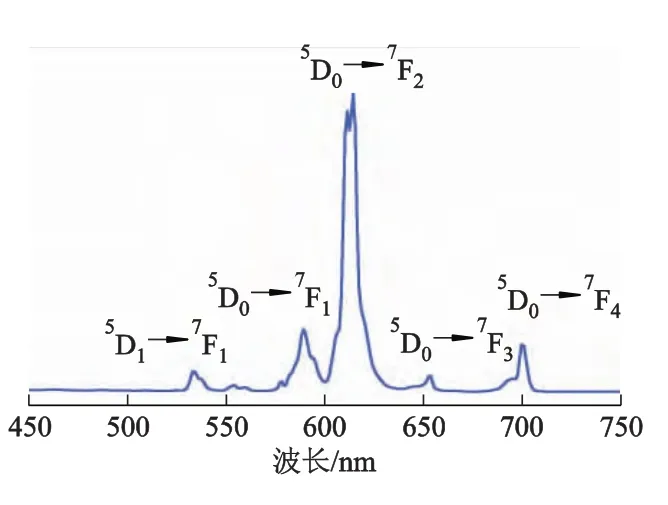
图5 λem=394 nm,NaLa(MoO4)2∶Eu3+的室温发射光谱图
3 结论
使用微波辐射法,在溶液中加入CTAB,合成了均匀的球形NaLa(MoO4)2粉体颗粒.随着CTAB加入量的增加,颗粒团聚减少,直径减小,粒度分布变窄.结构分析表明:NaLa(MoO4)2颗粒为四方相的白钨矿多晶结构.NaLa(MoO4)2∶Eu3+的室温光致发光(PL)谱图表明样品可以被紫外、近紫外和蓝光有效激发,从而发射波长为616 nm的高强度红光,使其在荧光粉转换的LED领域有潜在的应用价值.
References)
[1]Morozova V A,Mironov A V,Lazoryak B I,et al.Ag1/8-Pr5/8MoO4:an incommensurately modulated scheelitetype structure[J].J Solid State Chem,2006,179(4):1183-1191.
[2]Morozova V A,Arakcheeva A V,Chapuis G,et al.KNd(MoO4)2:a new incommensurate modulated structure in the scheelite family[J].Chem Mater,2006,18(17):4075-4082.
[3]汪正良.碱金属-稀土钼/钨酸盐的合成、发光及其在发光二极管的应用研究[D].广州:中山大学化学与化工学院,2006.
[4]Haque M M,Lee Hong-In,Kim Dong-Kuk.Luminescent properties of Eu3+-activated molybdate-based novel red-emitting phosphors for LEDs[J].J Alloys&Compd,2009,481(1/2):792-796.
[5]Yang P P,Li C X,Wang W X,et al.Uniform AMoO4∶Ln(A=Sr2+,Ba2+;Ln=Eu3+,Tb3+)submicron particles:solvothermal synthesis and luminescent properties[J].J Sold State Chem,2009,182(9):2510-2520.
[6]杨志平,韩 勇,李 旭.一种新型的白光LED用红色荧光粉SrMoO4∶Eu3+[J].河北工业大学成人教育学院学报,2005,21(2):13-15.Yang Zhiping,Han Yong,Li Xu.A novel red phosphor for white LED SrMoO4∶Eu3+[J].Journal of Adult Education School of Hebei University of Technology,2005,21(2):13-15.(in Chinese)
[7]Li Xu,Yang Zhiping,Guan Li,et al.Luminescent properties of alkali metal ion and trivalent europium ion co-activated alkaline earth molybate phosphors [J].Journal of Synthetic Crystals,2007,36(5):1192-1196.
[8]周立亚,王 雷,龚福忠,等.CaMoO4超细粒子的制备及发光性能[J].广西大学学报:自然科学版,2007,32(4):394-397.Zhou Liya,Wang Lei,Gong Fuzhong,et al.Synthesis and photoluminescence of CaMoO4superfine powder[J].Journal of Guangxi University:Natural Science Edition,2007,32(4):394-397.(in Chinese)
[9]Lei F,Yan B,Chen H H,et al.Surfactant-assisted hydrothermal synthesis, physicalcharacterization, and photoluminescence of PbWO4[J].Cryst Growth Des,2009,9(8):3730-3736.
[10]Dallinger D,Kappe C O.Microwave-assisted synthesis in water as solvent[J].Chem Rev,2007,107(6):2563-2591.
[11]Lei F,Yan B.Hydrothermal synthesis and luminescence of CaMO4∶RE3+(M=W,Mo;RE=Eu,Tb)submicro-phosphors[J].J Solid State Chem,2008,181(4):855-862.
[12]Su Y G,Li L P,Li G S.Synthesis and optimum luminescence of CaWO4-based red phosphors with codoping of Eu3+and Na+[J].Chem Mater,2008,20(19):6060-6067.
[13]Tian Y,Qi X H,Wu X W,et al.Luminescent properties of Y2(MoO4)3∶Eu3+red phosphors with flowerlike shape prepared via coprecipitation method[J].J Phys Chem C,2009,113(24):10767-10772.

