微波辅助提取山楂红色素及其抗氧化性的研究
闫利萍,程海霞,汪张贵,钱时全
(蚌埠学院 生物与食品工程系,安徽 蚌埠 233030)
山楂红色素属于天然花青素类色素[1-3],含有可溶性糖、酸和黄酮类物质,主要成分为矢菊色素-3-半乳糖苷(含量约为80.4%)、矢车菊色素的双糖或三糖苷(含量为19.6%)等花色苷类化合物。由于其结构中有多个酚羟基,是羟基供体,因而也是一种自由基清除剂,它不仅能和蛋白质结合防止过氧化,而且还能提供质子,有效清除脂类自由基,切断脂类氧化的链式反应[4-5],具有抗氧化和消除自由基作用,有一定的药用和保健价值。
目前,山楂红色素提取的传统方法主要有常温提取、索氏提取法和微波萃取法等3 种提取方法。传统提取方法往往有耗时长、易污染、提取物质不稳定等缺点[6]。而微波萃取技术是利用微波能来提高萃取率的一种新技术,其原理是在微波场中,依靠吸收微波能力的差异使得基体物质的某些区域或萃取体系中的某些组分被选择性加热,从而使得被萃取物质从基体或体系中分离。与传统的常温提取和索氏萃取等方法相比,微波萃取法具有快速、节能、节省溶剂、污染小等优点,而且有利于萃取热不稳定的物质,可以避免长时间的高温引起物质的分解,特别适合于处理热敏性组分或从天然物质中提取有效成分[7]。为此,本文拟采用微波辅助法提取山楂红色素,测定其对羟自由基的清除情况,为山楂红色素性质研究和开发利用提供依据。
1 实验部分
1.1 材料与仪器
新鲜山楂果,购于蚌埠家乐福超市;盐酸、氢氧化钠、邻苯二甲酸氢钾、乙醇、丙酮、乙醚、乙酸乙酯、氯仿、硫酸亚铁、过氧化氢均为分析纯。
RE-52 型旋转蒸发仪;722 紫外-可见分光光度计;HH6 数显恒温水浴锅;FA2004 型电子天平;NTJ07-3 试验专用微波炉。
1.2 测定方法
色素提取分两个阶段,一是选料、清洗、破碎;二是采用微波辅助提取,对预处理过的山楂皮浸提色素。
提取工艺流程为:鲜果→选料→清洗→削皮→切碎→微波处理→常温浸提→过滤→浸提液。
1.2.1 浸提溶剂的选择选取一定量的新鲜山楂,削皮并切碎(约3 mm ×3 mm),分别准确称取6 份5 g山楂样品,置于6 个100 mL 锥形瓶中,然后向这些锥形瓶中分别加入100 mL 蒸馏水、氯仿、乙酸乙酯、95%乙醇、乙醚和丙酮,常温下浸提24 h 后过滤,分别吸取2 mL 各浸提液在533 nm 处测吸光度[6]。每处理组设3 个平行样。
1.2.2 pH 值的选择取5 份100 mL 上述最佳效果的浸提剂,用0.1% 盐酸和0.1% NaOH 调节pH分别为2,4,6,8 和10,然后分别加入5 g 切碎后山楂皮进行浸提,24 h 后再对各浸提液在533 nm 处测吸光度。每处理组设3 个平行样。
1.2.3 萃取时间的选择取5 份100 mL 最佳浸提溶剂,调节pH 至最佳值,然后分别加入5 g 切碎后山楂皮,浸提2,4,8,24,48 h,测各浸提液在533 nm处测吸光度。每处理组设3 个平行样。
1.2.4 微波辅助提取山楂红色素
1.2.4.1 微波处理时间的确定称取5 份5 g 切碎的山楂皮分别置于5 个100 mL 锥形瓶中,分别向各锥形瓶中加入10 mL 95%乙醇溶液,用滤纸将瓶口包盖好,然后将各锥形瓶分别置于微波炉中处理0,1,2,3,5 min 后置于常温下,冷却后各加入90 mL 95%乙醇溶液,调节pH 至最佳,浸提2 h 后,过滤,取滤液,在533 nm 处测吸光度。每处理组设3 个平行样。
1.2.4.2 微波辅助后浸提时间的确定根据上述实验得出最佳微波处理时间,然后采用1.2.4.1 节方法对5 份5 g 切碎后山楂皮进行微波处理,再将其置于常温下分别浸提1,2,5,8,12 h,在533 nm 处测吸光度。每处理组设3 个平行样。
1.2.5 羟自由基(·OH)清除能力的测定采用H2O2/Fe 体系,通过Fenton 反应进行测定羟自由基清除能力(·OH)大小[8-9]。向样品管中加入0.75 mmol/L FeSO4溶液2 mL 和浸提溶液1 mL,混合均匀后,加入1.0 mL H2O2(0.01%)启动反应。
样品管:FeSO42 mL + 浸提溶液1 mL + H2O21 mL
未损伤管:FeSO42 mL + 浸提溶液1 mL
损伤管:FeSO42 mL + H2O21 mL
各混合液于37 ℃恒温反应1 h 后,在533 nm处测定各反应液的吸光度。每处理组设3 个平行样。羟自由基清除率的计算公式:

2 结果与讨论
2.1 浸提溶剂的选择
由表1 可知,山楂红色素不溶于乙醚、氯仿、乙酸乙酯和丙酮,而溶于蒸馏水和95% 乙醇,且在95%乙醇中浸提效果约是蒸馏水中的4 倍,这可能是由于山楂红色素是水溶性的,同时又是由多种物质组成的复合体系,95%乙醇的浸提效果比蒸馏水好。因此,本实验选择95%乙醇为宜。
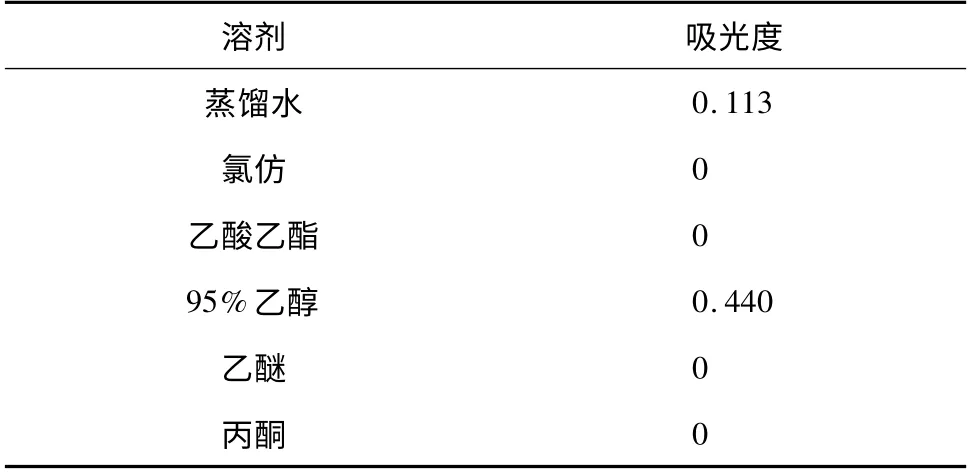
表1 不同溶剂对山楂红色素浸提效果的影响Table 1 Effect of different solvents on the extraction of red pigment hawthorn
2.2 pH 的确定
由图1 可知,山楂红色素随着pH 增加提取效果逐渐降低,其中在pH 2 时提取效果最好。这可能是由于山楂红色素属于花青素类色素的一种,在酸性条件下呈红色的缘故。因此,本实验选择pH 2 为宜。
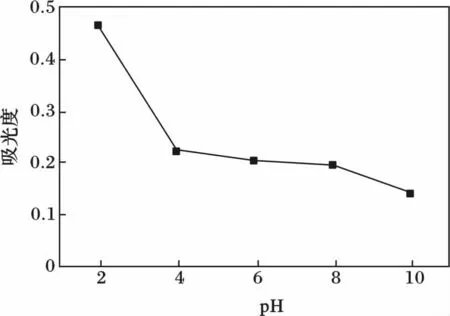
图1 pH 对山楂红色素提取效果的影响Fig.1 Effect of pH on extraction of red pigment from hawthorn
2.3 萃取时间的确定
由图2 可知,随着浸提时间增加,山楂红色素浸提效果逐渐提高,当浸提24 h 时,浸提效果最好,与浸提48 h 几乎无差别。因此,本实验选择常温萃取24 h 为宜。

图2 提取时间对山楂红色素提取效果的影响Fig.2 Effect of extraction time on extraction of red pigment from hawthorn
2.4 微波处理时间的选择
由表2 可知,经微波处理后的浸提液吸光度值明显比未经微波处理要大,其中,以微波处理1 min浸提效果最好,但随着微波处理时间延长,浸提效果反而下降,这可能是由于处理时间过长,破坏了山楂红色素的稳定性。因此,本实验选择微波处理时间1 min 为宜。

表2 不同微波处理时间对山楂红色素浸提效果的影响Table 2 Effect of different microwave-processing time on the extraction of red pigment hawthorn
2.5 微波辅助提取后山楂红色素浸提时间的选择
微波辅助提取后山楂红色素浸提时间的影响见图3。

图3 微波辅助提取后山楂红色素浸提时间对山楂色素提取效果的影响Fig.3 Effect of extracting time after microwave-processing on red pigment concentration from hawthorn
由图3 可知,随着时间延长,山楂红色素浸提液颜色先逐渐加深,当浸提5 h 时,浸提液颜色最深,随后呈现下降趋势,这可能是由于浸提时间太长降低山楂红色素稳定性的缘故。因此,本实验选择山楂红色素微波处理后浸提5 h 为宜。
2.6 山楂红色素抗氧化性的研究
由表3 可知,山楂红色素对羟自由基具有一定的清除作用,并且随着色素浓度的降低,其清除效果逐渐减弱,当浓度低至一定程度时则不表现其清除效果。
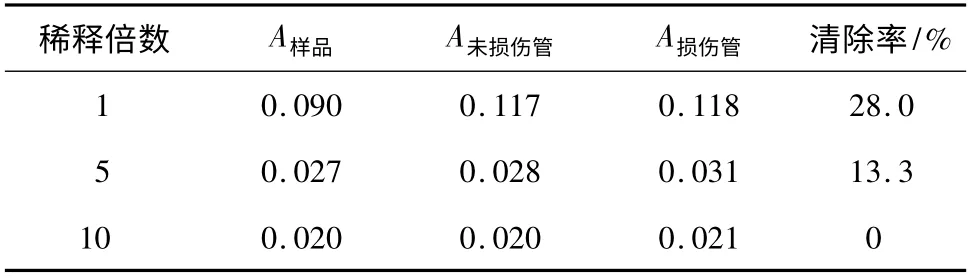
表3 不同浓度山楂红色素浸提液对羟自由基清除效果的影响Table 3 Effect of different concentrations of red pigment extraction from hawthorn on hydroxyl radical scavenging capacity
3 结论
用95%乙醇溶液(pH 2)为浸提溶剂,先微波处理1 min,再常温浸提5 h,山楂皮红色素提取效果最佳。同时,山楂红色素对羟自由基具有一定的清除作用,并且随着浓度下降清除能力逐渐减弱。
[1] 周立国.食用天然色素及其提取应用[M].济南:山东科学技术出版社,1997.
[2] Bridle P.Anthocyanins as natural food colors-selected aspects[J].Food Chemistry,1997,58(1/2):103-109.
[3] Howord M M. Measurement of food flavonoids by high performance liquid chromatography[J]. Food Chem,2000,48(3):577-599.
[4] 郭延红,郝延莉.山楂红色素的理化性质[J].延安大学学报:自然科学版,2006,3(25):49-51.
[5] 王华兴,陈锦屏.山楂色素稳定性的研究[J].食品与发酵工业,1992(6):49-52,38.
[6] 陶满庆,李炳诗,李峰.山楂红色素提取及稳定性研究[J].安徽农业科学,2008,36(8):3083-3084,3107.
[7] 冯作山,赵晓燕,叶润华.微波技术在鲜番茄中提取番茄红素的应用[J]. 新疆农业大学学报,2004,27(2):83-86.
[8] 李敏,李拖平,李巍,等. 山楂红色素抗氧化作用的研究[J].食品工业科技,2011(4):137-138.
[9] 李志洲,陈均志.大枣多糖的抗氧化性研究[J].食品工业科技,2007,28(11):15-17.

