福建沿岸红树林湿地多毛类生态分布
林俊辉,郑凤武,何雪宝,王建军
(国家海洋局第三海洋研究所海洋生物与生态实验室,厦门 361005)
红树林是生长在热带、亚热带海湾河口潮间带的木本植物群落,全球有两个分布中心:一个在东南亚,另一个在中南美洲,我国的红树林属于东南亚类型[1],主要分布于浙江以南的5个沿海省份及港澳台,其中,福建省是我国红树林自然分布的最北缘省份,全省现有红树林面积为 615.1 hm2[2]。
红树林湿地孕育着丰富的生物资源,大型底栖动物是其中最为丰富多样的生物类群[3],迄今为止,国内外学者已对该类群的物种多样性开展了大量、系统的调查研究[4-11]。软体动物、甲壳动物和多毛类动物是红树林底栖动物最重要的3大类别,多毛类以对海洋沉积物的再循环、再造作用、生物扰动以及埋藏有机质等方式在底栖生物群落运作上发挥主要作用[12],尽管多毛类是红树林大型底栖动物的一个重要生态成分[13],但相对于红树林生态系统的其它成分,它们研究得相对少,或是被忽视[14],因此,它在红树林生态系中的总体多样性、丰度和功能作用知之甚少[15]。以往红树林湿地大型底栖动物生态研究大多集中于探讨单一样地下的物种多样性及分布规律,更大空间尺度范围下的底栖动物分布规律研究甚少,本研究同时选择福建沿岸多处红树林典型湿地作为研究对象,描述福建红树林的多毛类动物多样性,分析和探讨红树林多毛类生态分布特征的一般规律及其与主要理化因子的关系,丰富红树林底栖动物生态学研究。
1 材料和方法
1.1 研究区域与采样方法
调查选取了福鼎姚家屿(FDH)、宁德云淡岛(YDH)、泉州洛阳江(QZH)、龙海九龙江口(LHH)和云霄漳江口(YXH)等5块河口海湾的成熟红树林样地(图1),姚家屿红树林是我国分布最北的天然林,洛阳江和九龙江口红树林为省级自然保护区,漳江口红树林是国家级保护区。2009—2012年间先后对5块样地开展了一系列调查,获取春、秋两季大型底栖动物和沉积物样品。为减少采样的偶然性,每块红树林样地设置了2—3条断面,各断面的位置及采样时间见表1。
福建沿岸红树植物主要生长于中潮区的潮滩上,采样断面相应地布设在中潮区。每一采样断面共设4个采样点,红树林内布设3个站点(向陆一侧到向海一侧依次设置3个采样点),邻近红树林区的林外光滩另设1个站位(洛阳江红树林采用林区内外分别设置2个站位)。每一采样点以25 cm×25 cm的定量框随机取4个样方,采样深度25—30 cm,总取样面积0.25 m2,并用网目为0.5 mm的套筛分选标本。标本处理以及室内分析和资料整理均按《海洋调查规范》要求进行。
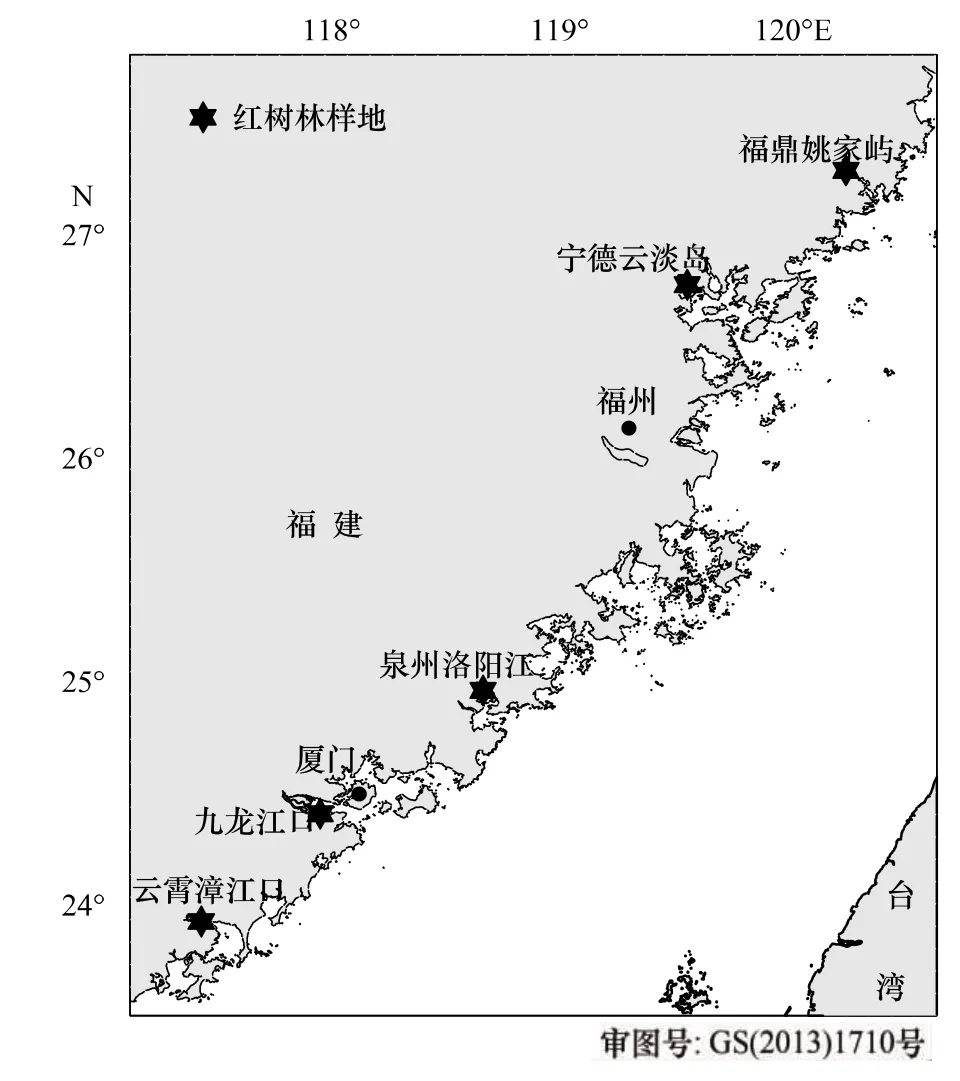
图1 福建沿岸红树林样地图Fig.1 M ap of sam pling locations in coastalmangrove swam ps of Fujian Province
1.2 数据分析
摄食功能群(feeding guilds)作为生态变化的指标最早 由 Fauchald 和 Jumars[16]提 出,最 近 由Pagliosa[17]在环境评估中加以检验。参考相关文献[16-18],文中将多毛类动物划分为五大功能群:肉食动物、杂食动物、表层沉积物摄食者、亚表层沉积物摄食者和悬浮物摄食者。
不同样地(5块样地)和不同季节(春、秋季)的密度和生物量的差异显著性采用双因素方差分析[19](Tukey检验法),检验之前须验证组间方差齐性,若方差不齐,则对数据进行对数转换,再进行方差分析[20];林区内外多毛类数量的差异显著性检验采用非参数Mann-Whitney U检验[21];Spearman秩相关系数用于检验红树林断面的生物参数与环境因子之间的相关程度,生物与环境参数的数值均采用断面所属站位的平均值。多毛类的群落分析基于种-密度矩阵,密度矩阵经方根转换后,计算Bray-Curtis相似性系数,以组平均法进行聚类(CLUSTER),Twoway Crossed ANOSIM对聚类分析形成的组进行差异显著性检验,以检验不同组别的差异,采用BIO-ENV分析分析群落结构与环境因子的关系,得出能够解释群落结构的最佳环境因子组合,RELATE程序检验群落相似性矩阵与环境距离矩阵之间的相关显著性。按 Clarke和 Warwick[22]的建议,在 BIO-ENV 分析和RELATE检验之前,消除环境因子之间的内在自相关(指相关系数≥0.90)。

表1 福建沿岸红树林样地位置及采样时间Table 1 Sam p ling locations and dates in coastalmangrove swam ps of Fujian Province
2 结果
2.1 物种组成和分布
福建沿岸5块红树林样地共记录多毛类种类17科45种,种类性质属低盐或广盐性种类,低盐代表种有圆锯齿吻沙蚕(Dentinephtys glabra)、腺带刺沙蚕(Neanthes glandicincta)、溪沙蚕(Namalycastis abiuma)和长双须虫(Eteone longa)等种类,它们常栖息于河口低盐区,多齿全刺沙蚕(Nectoneanthes multignatha)、双齿围沙蚕(Perinereis aibuhitensis)、长吻吻沙蚕(Glycera chirori)、渤海格鳞虫(Gattyana pohaiensis)和拟突齿沙蚕(Paraleonnates uschakovi)则是较为常见的广盐代表种。多数种类并非红树林湿地所特有,但小部分种类,如印度节裂虫(Mastobranchus indicus)和拟异蚓虫(Parheteromastus tenuis),目前仅见于红树林湿地。
表2为福建红树林湿地多毛类名录及其它们在每一样地的平均密度,5块红树林样地共有的多毛类仅3种,分别是长吻吻沙蚕、圆锯齿吻沙蚕和稚齿虫(Prionospio sp.)。多达21种多毛类动物存在于单一样地,仅7种多毛类在4块及其以上的样地出现,除前述的 3种,还包括了渤海格鳞虫、小头虫(Capitella capitata)、异蚓虫(Heteromastus filiformis)和拟异蚓虫。样地之间的主要种组成有所不同,姚家屿主要种有Aquilsspio sp.、异蚓虫和拟异蚓虫,云淡岛为光突齿沙蚕(Leonnates persica)和圆锯齿吻沙蚕,洛阳江和九龙江口同为圆锯齿吻沙蚕,漳江口是拟异蚓虫和腺带刺沙蚕。圆锯齿吻沙蚕是多块红树林湿地的主要种,出现率高,密度较大。

表2 福建红树林湿地多毛类名录及其它们在每一样地的平均密度Table 2 List of polychaete species and their density in each location in mangrove swamps of Fujian Province

续表
尽管不同样地的多毛类种类组成和主要种都存在差异,但样地之间有其相似之处。整个研究区域的多毛类组成以沙蚕科、海稚虫科和小头虫科种类最为丰富,分别有11种、8种和10种,三者占总种数的64.4%,是福建红树林湿地多毛类组成的重要科,从姚家屿到漳江口的5块红树林样地,3个重要科占各自样地总种类数的比例分别是66.7%、66.7%、55.6%、61.1%和60.0%,均在55%以上。不同样地虽然种类组成明显不同,但种类数接近,姚家屿和漳江口的种类数稍多,其余3块样地均为18种(表3)。春季共记录多毛类种类数为42种,秋季为26种,春季多于秋季,各块样地种类数的季节变动均表现为春季>秋季(图2)。除姚家屿样地主要种季节变化较明显外,其它样地春、秋两季的多毛类主要种组成相近。

表3 福建沿岸红树林湿地多毛类生物组成Table 3 Polychaete com position in coastalmangrove swam ps of Fujian Province

图2 福建红树林样地多毛类种类数及季节变化Fig.2 Species number and seasonal variation in mangrove locations of Fujian Province
2.2 数量组成与分布
春、秋两季福建红树林多毛类平均栖息密度分别为274个/m2和105个/m2,春季大多样地的密度在200个/m2以上,秋季各样地均在200个/m2以下,密度以漳江口和洛阳江红树林较高,云淡岛和九龙江口红树林较低。春季平均生物量是3.06 g/m2,秋季为1.27 g/m2,九龙江口和漳江口红树林的生物量较高,云淡岛和洛阳江红树林较低。样地的多毛类密度和生物量未发现有随着纬度增加而递增或递减趋势,各样地数量的季节变动总体上表现为春季高于秋季。具体见表4。
样地×季节双因素方差分析(two-way ANOVA)结果表明,不同样地(F=6.057,P<0.001)和不同季节(F=10.069,P=0.002)的多毛类栖息密度均呈极显著差异,样地×季节之间的交互作用不显著(F=1.124,P=0.352),样地之间的多重比较表明了姚家屿与其它样地的密度均值呈显著差异,而其它样地彼此之间的密度均值差异不显著。不同样地的多毛类生物量差异不显著(F=2.161,P=0.081),但不同季节间则差异极显著(F=9.378,P=0.003),样地×季节之间的交互作用仍不显著(F=0.949,P=0.441),多重比较显示样地之间的生物量均值均无显著差异。双因素方差分析结果反映出春季的多毛类密度和生物量均显著高于秋季。
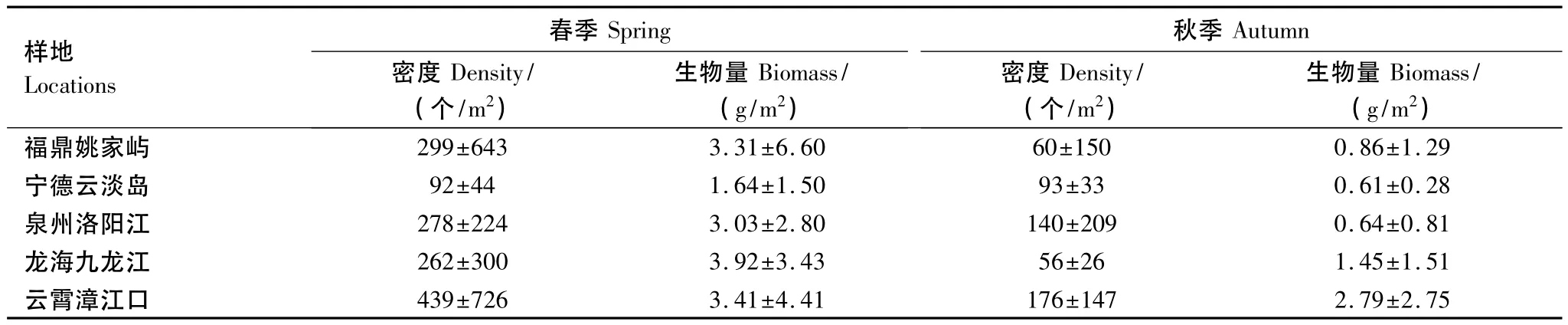
表4 福建沿岸不同红树林湿地的多毛类密度和生物量(±s.d.)Table 4 Polychaete density and biomass in coastalmangrove swamps of Fujian
将春、秋两季所有断面的多毛类数量按红树林区内外分别累积取平均值,林区内外的数量对比结果如图3所示。春季,多毛类密度均值以林区内((161±218)个/m2)<林外光滩((572±741)个/m2),生物量均值同样是林区内((2.22±2.65)g/m2)<林外光滩((5.00±5.34)g/m2);秋季,密度均值以林区内((121±146)个/m2)>林外光滩((89±118)个/m2),生物量均值同样是林区内((1.49±1.94)g/m2)>林外光滩((1.22±1.76)g/m2)。U 检验表明春季林内的多毛类密度(Z=-3.443,P=0.001)和生物量(Z=-2.667,P=0.008)显著高于林外,但秋季林区内外密度(Z=-0.940,P=0.347)和生物量(Z=-1.442,P=0.149)均值差异不显著。

图3 福建红树林湿地林区内外多毛类密度和生物量的差异Fig.3 Difference of polychaete density and biomass between mud flat and forest area in mangrove swam ps of Fujian
2.3 摄食群组成
研究区域多毛类的摄食功能群组成总体上以肉食动物和亚表层沉积物摄食者为主,但不同样地的营养结构组成各异(图4)。图中显示,尽管部分多毛类动物具有分解红树林叶子的潜能[23],而且叶片是红树林中丰富的食物来源,但能摄食红树植物叶片的杂食动物仅在云淡岛和漳江口红树林占有较重要地位,姚家屿、洛阳江和九龙江口3处红树林的杂食动物数量所占比例都较低,如姚家屿红树林多毛类的功能群组成以沉积物摄食者为主(包括表层沉积物摄食者和亚表层沉积物摄食者),洛阳江和九龙江口2块红树林以肉食动物为主。各块红树林样地彼此相似的是悬浮物摄食者所占比例均很低。
2.4 样地差异及其与沉积物理化因子的关系
春、秋两季福建沿岸11条红树林断面以Bray-Curtis相似性系数进行聚类,结果如图5所示。图中显示最先聚集成簇是同一样地相同季节下的断面,紧接着是同一样地下的所有断面,最后才是样地之间逐一聚集成群。这表明了不同样地之间的多毛类类群结构相似程度较低,而同一样地下断面之间的类群结构相似性相对较高。聚类图也反映出九龙江口和云淡岛2块红树林样地在所有样地中相似性最高。采用样地×季节双因素交叉ANOSIM分析检验不同样地和不用季节的类群结构差异显著性,结果表明春、秋两季之间的多毛类类群结构存在显著差异(P=0.007),且不同样地之间也明显不同(P=0.001),样地之间的成对检验显示漳江口与其它4块红树林样地的类群结构具有显著差异,而漳江口以外的其余4块样地两两之间的类群结构差异不明显(表5)。
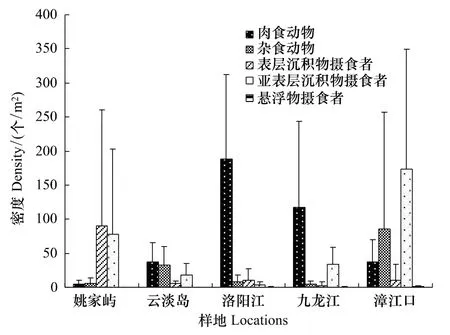
图4 福建各块红树林样地多毛类主要摄食群的平均密度Fig.4 Average density of major feeding guilds in all the mangrove locations of Fujian
表6为春季福建沿岸红树林断面的多毛类生物参数与11个环境因子之间的Spearman秩相关系数。表中显示,红树林断面的平均种类数(种/站)和多样性指数H'均值与沉积物的粘土含量呈显著负相关,表明沉积物粘土含量越高,该断面的平均种类数和多样性指数H'越低,而其它生物参数与环境因子未构成显著相关。根据环境因子自相关分析结果,RELATE和BIO-ENV分析前去除中值粒径(Mdφ)、平均粒径(Mzφ)和分选系数(σiφ)3 个参数。RELATE检验表明多毛类动物的Bray-Curtis相似性矩阵和8个环境因子正态化距离矩阵之间存在显著相关(R=0.235,P=0.027)。BIO-ENV 分析进一步揭示了群落结构与环境变量的关系,在所测定的环境变量中,与福建红树林湿地多毛类类群结构最为匹配的环境因子是地理纬度,相关系数为0.374。
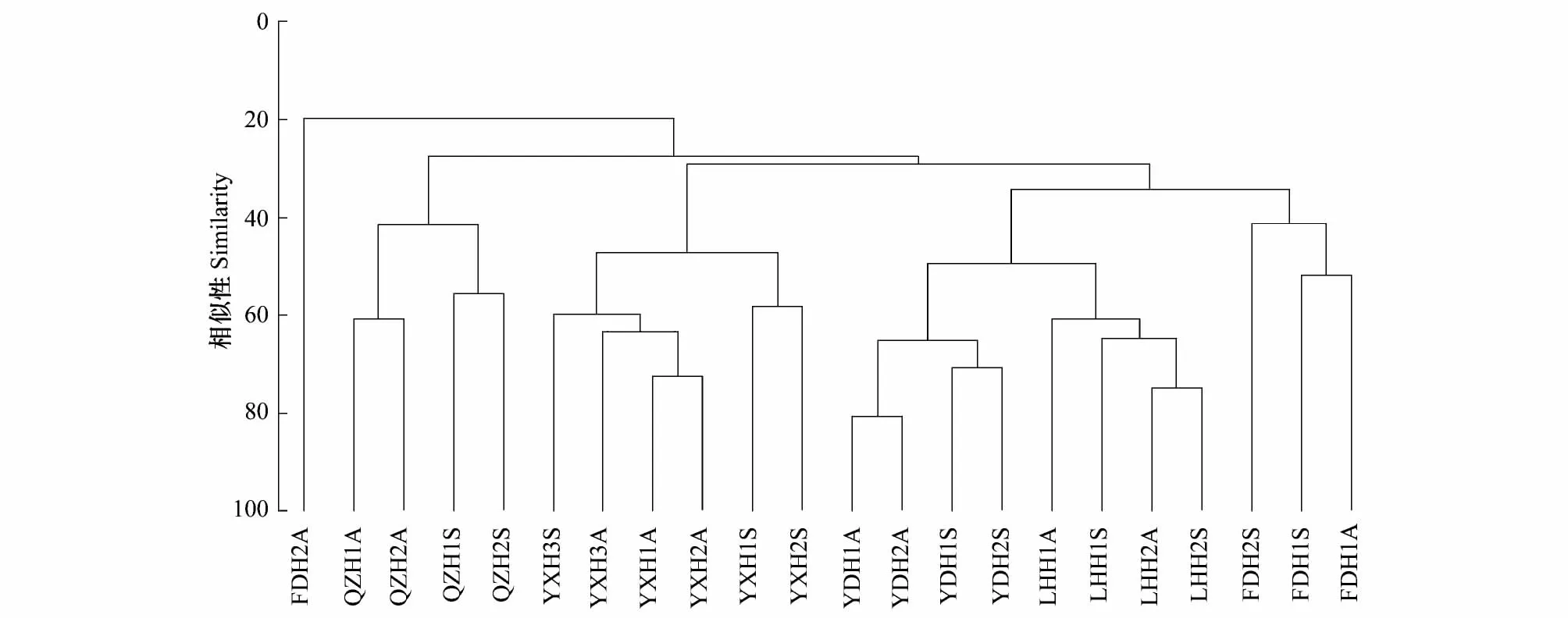
图5 福建红树林湿地断面聚类图Fig.5 C luster map of all the samp ling mangrove transects of Fujian*FDH福鼎姚家屿;YDH宁德云淡岛;QZH泉州洛阳江;LHH龙海九龙江口;YXH云霄漳江口;S春季;A秋季

表5 福建红树林湿地样地×季节双因素交叉ANOSIM检验Table 5 Results of two-way crossed ANOSIM between locations and seasons in mangrove swamps of Fujian

续表

表6 春季福建沿岸红树林湿地多毛类生物参数与环境因子的秩相关系数Table 6 Spearman's rank correlations between polychaete biotic parameters and environmental variables in mangrove swamps of Fujian in spring
3 讨论
3.1 物种多样性
据MacIntosh[14]统计,红树林湿地大型底栖动物以亚洲区最为丰富,种类数为468种,其中多毛类为11种。事实上,上述的种类数被人为低估,2007年我国红树林湿地大型底栖动物共记录13门873种,其中环节动物142种[3]。本研究中,福建沿岸5块典型红树林湿地共记录多毛类种类45种,接近张雅芝[9]所报道的福建8个河口红树林区多毛类种类数(47种)。一般情况下,调查区的种类数与调查的广度和深度相关,此外,分类学上的困难也是一个重要的限制因素。本研究涉及的调查范围还相对有限(5块样地),而且仅是春、秋两季的调查结果,部分短生活周期的种类有可能没有在采样周期内出现,由于红树林栖息地的高度异质性和复杂性,一些偶见种也有可能未被采集到,因此,与红树林相关的多毛类种类还远未被了解,随着调查样地的增多和采样频率的增加,以及红树林湿地多毛类分类知识的提升,将来记录的多毛类种类还会更加丰富多样。
福建沿岸红树林湿地多毛类组成以沙蚕科、海稚虫科和小头虫科种类最为丰富,3个科占总种数的64.4%,国外红树林多毛类也有类似的研究结果[7-8,15]。红树林区底栖生物具有特有种,一些腹足类的属(例如Ellobium,Enigmonia)和种(如Littoraria scabra,T.palustris)是红树林系统所独有[24],但不同学者提出不同观点,Hutchings 和 Recher[13]指出,几乎没有什么动物局限于红树林或是表现出对红树林环境的独特适应。本研究所记录的45种多毛类动物是红树林湿地的常见种,属低盐或广盐性种类,但大多并非红树林特有种,它们在非红树林的潮间带滩涂中也有分布,如溪沙蚕、异足索沙蚕、双齿围沙蚕等,但小部分种类如拟异蚓虫和印度节裂虫,它们至今在红树林湿地外尚未记录过,很可能是红树林湿地所特有,印度节裂虫广泛栖息于印度沿海红树林区。本研究未发现有本地种存在,Metcalfe[15]认为,这可能是因为对多毛类的认知还不够成熟,不足以了解每个种类的分类学界线和分布。
3.2 数量的时空差异及历史变化
双因素方差分析表明福建沿岸红树林湿地多毛类的密度和生物量为春季显著高于秋季,且种类数也是春季多于秋季,雷州半岛红树林多毛类数量同样是春季>秋季[10],这可能是多毛类自然补充规律[25],春季为繁殖季节,许多多毛类新个体进入群落,使其种类数、密度和生物量达到较高值。文献[5]表明红树林植被会影响底栖动物分布,本研究中,红树林湿地林区内的密度和生物量显著低于林外光滩,这反映出林外光滩更适合多毛类栖息,Melcalfe[15]同样发现多样性和丰度最高值出现在红树林靠海一侧松软未硬化的底质,这可能是因为靠海一侧的林外光滩泥土湿润,未板硬化,底表生物获得栖息地的机会增加,故多毛类数量较高。研究同时也发现林内多毛类数量的季节波动相对比林外光滩来得小,这主要是红树植物可提供荫蔽和藏身处,减少水分蒸发对底栖动物的胁迫和其它种群的摄食。张雅芝[9]曾报道春、秋两季福建红树林区多毛类在中潮区的平均密度和生物量分别为28.7个/m2和4.41g/m2,相比之下,本研究的多毛类平均密度更高,为189.5 个/m2,但平均生物量更小,是 2.17 g/m2,表明相对于20世纪80年代的调查,福建红树林区多毛类可能出现小型化,其中的变化有待于进一步确认。
3.3 摄食群组成和类群结构与环境的关系
摄食群结构能够反映生物在物质循环和能量传递中发挥的作用,福建沿岸红树林湿地的多毛类摄食群主要以肉食动物和沉积物摄食者为主,但各块样地的摄食群组成不一样,可能与当地可利用的食物来源有关,沉积物的有机质含量是其中一个重要的影响因素,如姚家屿的有机质含量最高(均值3.90),沉积物中有机碎屑丰富,该样地以沉积物摄食者为主;而洛阳江红树林有机质最低(均值1.93),摄食群以肉食动物数量最为丰富。九龙江口样地的有机质含量为2.86,摄食群组成同样以肉食动物为主,而漳江口红树林虽然有机质含量(均值2.58)介于洛阳江和九龙江口之间,但组成以亚表层沉积物摄食者和杂食动物为主,和后两者不同,表明有机质含量并非是决定样地摄食群组成的唯一因素。以摄食水中悬浮物为主的悬浮物摄食者在各个红树林样地数量均很低,这可能与断面设置有关,11条红树林断面均位于中潮区,潮水淹没时间有限,获得水中食物来源的机会相对不大。Melcalfe[15]研究澳大利亚达尔文港的红树林,其摄食群组成以植食动物的种类最多,丰度最大,但由于该文献未给出任何环境要素,不能分析其与本研究结果不同的原因所在。
本研究中,红树林断面的多毛类平均种类数(种/站)和多样性指数(H')均值与该断面沉积物的粘土含量呈显著负相关,但平均密度和生物量与沉积物环境因子无显著相关,表明沉积物的粘土含量越高,种类多样性越低,但多毛类数量可能降低,也有可能增加,如漳江口样地的沉积物粘土含量明显高于其它4块样地,相应地,漳江口所属3条断面的平均种类数和多样性指数值均较小,但3条断面的多毛类数量相差较大,并非总是高于或是低于低粘土含量的调查断面。这可能是因为粘土含量的增加会导致沉积物更细更粘,适宜这种河口低盐、高粘土含量环境的多毛类种类会相对减少,能在这种沉积环境下栖息的部分多毛类种类会由于缺少食物竞争者,其种群大量繁衍,种类优势度增加,故多样性指数值降低,但相比那些低粘土含量的断面而言,多毛类数量可能较大也可能较小,这取决于该断面优势种的繁衍状况。
BIO-ENV分析表明,在所分析的环境变量中,与福建红树林湿地多毛类类群结构最为匹配的环境因子是地理纬度。传统上认为沉积物特性是决定多毛类类群的主要因子,特别是粒径[17]和粘土含量[26],因为底栖生物摄食策略高度适应于沉积物类型[27]。对于本研究而言,这个说法不完全准确,在小尺度空间下,如单一样地下,沉积物属性或许是影响多毛类类群结构的重要因素,但放大到更大空间范围,各块样地的气候条件有较大不同的情况下,沉积物的作用未必居主导地位。比如,与云霄红树林3条断面的多毛类类群结构最为匹配的沉积物因子是沉积物的有机质含量(相关系数1.0),但有机质含量与全部11条断面的多毛类结构之间的相关系数仅为0.133,相关系数最高的沉积物因子为粘土含量(-0.201),均不及地理纬度(0.374)。本研究中,地理纬度主要反映的是气候条件,如海水的年平均水温、月平均水温等因素,平均水温的不同会影响多毛类生物的繁殖和发育,进而影响到种群的补充,因此,不同断面之间的地理纬度相差越小,气候条件越接近,二者的多毛类类群的相似性就越高,在断面聚类关系图上表现为同一样地下的断面相似性高,不同样地的断面相似性较低。
致谢:感谢江锦祥研究员和陈光程博士在文章修改过程中给予的帮助。
[1] Chen Y X.Ecological effectsof themangrove on the environment.Marine Environmental Science,1995,14(4):51-56.
[2] Wang W Q,Wang M.The Mangroves of China.Beijing:Science Press,2007:63-86.
[3] He B Y,Fan H Q,Wang M,Lai T H,Wang W Q.Species diversity in mangrove wetlands of China and its causation analyses.Acta Ecologica Sinica,2007,27(11):4859-4870.
[4] Sasekumar A.Distribution ofmacrofauna of a Malayan mangrove shore.Journal of Animal Ecology,1974,43(1):51-69.
[5] Macnae W.A general account of the fauna and flora ofmangrove swamps and forests in the Indo-West-Pacific region.Advances in Marine Biology,1968,6:73-270.
[6] Wells F E.An analysis of marine invertebrate distributions in a mangrove swamp in northwestern Australia.Bulletin of Marine Science,1983,33(3):736-744.
[7] Kumar R S.Macrobenthos in the mangrove ecosystem of Cochin backwaters,Kerala southwest coast of India.Indian Journal of Marine Sciences,1995,24(2):56-61.
[8] Frith DW,Tantanasiriwong R,Bhatia O.Zonation ofmacrofauna on a mangrove shore,Phuket Island.Phuket Marine Biological Centre Research Bulletin,1976,10:1-37.
[9] Zhang Y Z,Chen C Z,Wang Y Y,Chen P J,Yang R Q.The ecology of benthos in Fujian mangrove swamps.Acta Ecologica Sinica,1999,19(6):896-901.
[10] Liang C Y,Zhang H H,Ji X Y,Zou F S.Study on biodiversity of mangrove benthos in Leizhou Peninsula.Marine Sciences,2005,29(2):18-25,31-31.
[11] Zou F S,Song X J,Chen W,Zheng X R,Chen J H.The diversity of benthic macrofauna on mudflat in DongZhaigang Mangrove Reserve,Hainan.Chinese Biodiversity,1999,7(3):175-180.
[12] Hutchings P. Biodiversity and functioning of polychaetes in benthic sediments.Biodiversity and Conservation,1998,7(9):1133-1145.
[13] Hutchings P,Recher H F.The fauna of Australian mangroves.Proceedings of the Linnean Society of New South Wales,1982,106:83-121.
[14] MacIntosh D J,Ashton E C.A review of mangrove biodiversity conservation and management.Denmark:Centre for Tropical Ecosystems Research,University of Aarhus,2002.
[15] Metcalfe K N,Glasby C J.Diversity of Polychaeta(Annelida)and other worm taxa in mangrove habitats of Darwin Harbour,northern Australia.Journal of Sea Research,2008,59(1/2):70-82.
[16] Fauchald K,Jumars P A.The diet of worms:a study of polychaete feeding guilds.Oceanography and Marine Biology Annual Review,1979,17:193-284.
[17] Pagliosa P R.Another diet of worms:the applicability of polychaete feeding guilds as a useful conceptual framework and biological variable.Marine Ecology,2005,26(3/4):246-254.
[18] Coyle K O,Konar B,Blanchard A,Highsmith R C,Carroll J,Carroll M,Denisenko S G,Sirenko B I.Potential effects of temperature on the benthic infaunal community on the southeastern Bering Sea shelf:Possible impacts of climate change.Deep-Sea Research PartⅡ:Topical Studies in Oceanography,2007,54(23/26):2885-2905.
[19] Understood A J. Techniques of analysis of variance in experimental marine biology and ecology.Oceanography and Marine Biology Annual Review,1981,19:513-605.
[20] Understood A J.Experiments in Ecology:Their Logical Design and Interpretation Using Analysis of Variance.Cambridge:Cambridge University Press,1997.
[21] Zar J H.Biostatistical Analysis.2nd ed.Englewood Cliffs:Prentice-Hall Inc.,1984.
[22] Clarke K R,Warwick R M.Change in Marine Communities:An Approach to Statistical Analysis and Interpretation.2nd ed.PRIMER-R,Plymouth,2001.
[23] Camilleri JC.Leaf-litter processing by invertebrates in amangrove forest in Queensland.Marine Biology,1992,114(1):139-145.
[24] Plaziat JC.Mollusc distribution in themangal//Por F D,Dor I,eds. Hydrobiology of the Mangal—The Ecosystem of the Mangrove Forests.The Hague:Developments in Hydrobiology 20.Dr.W.Junk Publishers,1984:111-143.
[25] Wang JB,Li X Z,Wang H F,Yu H Y,Li B Q.Relationship between quantitive distribution of benthic polychaete Annelida and environmental factors in Jiaozhou Bay.Chinese Journal of Applied and Environmental Biology,2006,12(6):798-803.
[26] Hsieh H L. Spatial and temporal patterns of polychaete communities in a subtropical mangrove swamp:infulences of sediment and microhabitat. Marine Ecology Progress Series,1995,127:157-167.
[27] Alfaro A C.Benthic macro-invertebrate community composition within a mangrove/seagrass estuary in northern New Zealand.Estuarine,Coastal and Shelf Science,2006,66(1/2):97-110.
参考文献:
[1] 陈映霞.红树林的环境生态效应.海洋环境科学,1995,14(4):51-56.
[2] 王文卿,王瑁.中国红树林.北京:科学出版社,2007:63-86.
[3] 何斌源,范航清,王瑁,赖廷和,王文卿.中国红树林湿地物种多样性及其形成.生态学报,2007,27(11):4859-4870.
[9] 张雅芝,陈灿忠,王渊源,陈品健,杨瑞琼.福建红树林区底栖生物生态研究.生态学报,1999,19(6):896-901.
[10] 梁超愉,张汉华,颉晓勇,邹发生.雷州半岛红树林滩涂底栖生物多样性的初步研究.海洋科学,2005,29(2):18-25,31-31.
[11] 邹发生,宋晓军,陈伟,郑馨仁,陈建海.海南东寨港红树林滩涂大型底栖动物多样性的初步研究.生物多样性,1999,7(3):175-180.
[25] 王金宝,李新正,王洪法,于海燕,李宝泉.胶州湾多毛类环节动物数量分布与环境因子的关系.应用与环境生物学报,2006,12(6):798-803.

