逆境胁迫下苜蓿乙醛脱氢酶基因的表达
许文花,文亦芾,马向丽,罗富成,任 健
(云南农业大学动物科学与技术学院,云南 昆明 650201))
植物生长过程,要经受低温、盐害、干旱等各种不利环境造成的逆境胁迫,逆境的影响广泛涉及各种植物生理和生化过程,严重时影响植物的正常生长甚至导致死亡[1,2]。研究植物对逆境胁迫的生理反应,不仅是认识植物与环境关系的一条重要途径,有助于揭示植物适应逆境的生理机制,而且也为生产中保护植物免受逆境伤害,提高其抗逆性,创造有利于植物生长发育的环境条件提供理论基础[3]。
了解基因在逆境胁迫中的作用,是植物生理研究的重要领域。乙醛脱氢酶被认为是与逆境有很大关系的一类酶类,它是生物体内活性氧物质清除过程中的重要酶类,它可以催化有毒的醛类氧化,形成对应的无毒羧酸,维持生物机体中醛类物质的微量平衡;乙醛脱氢酶能有效降低乙醛的浓度,促进乙醇的消化代谢。因此,乙醛脱氢酶起着实质性消化乙醇的作用,是乙醇消化代谢过程中的关键性酶,乙醛脱氢酶催化乙醛与乙酸之间的相互转化过程,这些作用是在有关植物乙醇消化代谢过程中了解的较少的环节。
试验研究表明,在诱导条件下用荧光定量法(RT-PCR)数据表明羊草乙醛脱氢酶基因的表达量呈先升高后降低的趋势。总体分析表明,该基因对盐的影响要高于干旱和冷冻[4]。半定量RT-PCR研究齿肋赤藓乙醛脱氢酶,结果表明在干旱胁迫状态时的表达量显著高于水合状态,说明乙醛脱氢酶基因可能参与干旱胁迫应答。为进一步研究齿肋赤藓乙醛脱氢酶基因的抗旱机理提供理论依据[5]。转乙醛脱氢酶基因番茄的研究表明,植株对环境胁迫造成的伤害具有较强的抗性,即乙醛脱氢酶基因具有提高植物抗氧化胁迫的功能[6]。
苜蓿属于比较耐逆境胁迫的植株,根系强大,入土很深,在不同的地区都适应生长,从逆境胁迫下苜蓿乙醛脱氢酶基因的表达调控方面深入研究,以期从分子水平揭示苜蓿植株的逆境生理。
1 材料和方法
1.1 试验地自然概况
试验地选择昆明市北郊云南农业大学的草学实习基地,地理位置为 N 25°01′,E 103°00′,海拔1 913m,年平均温度14.7℃ 。年降水量900~1 100mm,年日照时数2 411.8h,pH 6.5。属北亚热带高原季风气候,干湿分明,6~10月份为雨季,11月至次年5月底为旱季。
1.2 材料与仪器、试剂
1.2.1 试验材料 紫花苜蓿种子于2012年12月种植,试验用提取核酸的苜蓿幼苗采于次年4月。
1.2.2 试验仪器和试剂 PCR仪(AB公司Gene-Amp PCR system 9700);实时荧光定量 PCR 仪(AB公司7500Fast Real-Time PCR Systems);GEL DOC 2000凝胶成像系统(美国BIO-RAD公司);低温高速离心机(Legend Micro 21,美国 Thermo公司);台式高速离心机(Fresco 21,美国 Thermo公司);Bio-Rad POWER Pac 1000 稳压电泳仪(美国BIO-RAD公司)。
植物总RNA提取试剂购自北京康为世纪生物科技有限公司,cDNA 合成试剂盒(TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix)和荧光定量PCR试剂盒(TransStart Top Green qPCR SuperMix)均购自北京全式金生物技术有限公司,2×Master MixTaq酶、DNA MarkerⅠ均购自北京天根生化科技(北京)有限公司,DEPC购自TaKa-Ra公司,GoldViewTM核酸染料购自北京赛百胜基因技术有限公司产品,氯仿、无水乙醇等试剂全部为国产分析纯。
1.3 方法
1.3.1 盐、低温、干旱的胁迫处理 选取生长一致的苜蓿幼苗,洗净根系上的泥土,设3个处理,3次重复,每个重复取苜蓿幼苗10~20株,培养于500mmol/L NaCl溶液进行盐胁迫处理,在水溶液中放置于4℃冰箱为冷冻处理,于20%PEG溶液培养进行干旱处理,处理0、4、8、12和24h取叶片,液氮速冻后-80℃保存备用。
1.3.2 总RNA提取 取新鲜嫩叶约2 000mg,放入预冷的研体中,迅速加入液氮充分研磨,收集粉末于离心管中,加入 Trizol Reagent 1mL,4℃、12 000r/min离心5min,离心后吸取上清液于新的离心管中,加入等体积异丙醇,离心沉淀弃上清液,用75%乙醇洗涤沉淀,DNaseI酶解可能混杂的基因组DNA,然后用适量的DEPC处理过的水溶解RNA,在紫外分光光度计上测定RNA的浓度和纯度。
1.3.3 cDNA的合成 按照北京全式金公司产品提供试剂盒使用说明合,反转录程序42℃30min,85℃5min,-20℃保存备用。
1.3.4 RT-PCR 反应 参照苜蓿基因组(http:∥medicagohapmap.org)乙醛脱氢酶基因(GeneID:Medtr3g026140)mRNA序列和Actin基因(GeneID:Medtr 3g095530),结合Primer 5.0的设计和Oligo 6.0评价,并用NCBI数据库中的Primer-Blast工具确认引物的特异性,用于苜蓿乙醛脱氢酶基因和Actin基因的荧光定量PCR扩增。引物由上海生物工程有限公司合成。配制混合液体,混合后,取20μL于平行孔中。反应程序:95℃30s;95℃3s,56℃30s:共45次循环;Dissociation:自动添加反应总体系:20μL。
1.3.5 Real time PCR 数据分析:采用比较 CT 法(△△CT),数据取3次重复的平均值。Spss 17.0进行方差分析。
2 结果与分析
2.1 苜蓿乙醛脱氢酶基因和β-actin基因的PCR扩增
通过琼脂糖凝胶电泳,检测到苜蓿乙醛脱氢酶基因和β-actin基因的PCR扩增DNA的片段(图1)。

图1 苜蓿乙醛脱氢酶基因和β-actin基因的PCR扩增Fig.1 PCR amplification of aldehyde dehydrogenase gene andβ-actin gene
2.2 乙醛脱氢酶基因在苜蓿不同组织部位的表达
取苜蓿的叶、茎、根通过上述测定方法,结果显示在叶片部分的表达量为1.05,在茎的表达量为0.76,在根的表达量为0.03。研究中取叶片作为苜蓿乙醛脱氢酶表达量的测定是较理想的材料。
2.3 盐胁迫处理下苜蓿叶片乙醛脱氢酶基因的表达变化
盐胁迫处理下,苜蓿植株叶片的乙醛脱氢酶基因的表达量发生了变化(表1),与对照相比处理4h,叶片中乙醛脱氢酶含量下降,处理8h的含量也相对小于处理4h,而盐胁迫处理12h的含量相对对照、处理4h、处理8h的含量升高。盐胁迫处理24h的表达量相对下降,低于处理12h的含量。乙醛脱氢酶基因调控着机体内部的变化,在不同处理时间下机体内的乙醛脱氢酶发生着微妙的变化,不同处理间相差显著,表明RT-PCR能够检测到苜蓿植株体内的乙醛脱氢酶的微妙的变化,是对逆境产生这种变化的适应的结果。表明苜蓿植株对盐胁迫表现出明显的适应性,比较敏感。
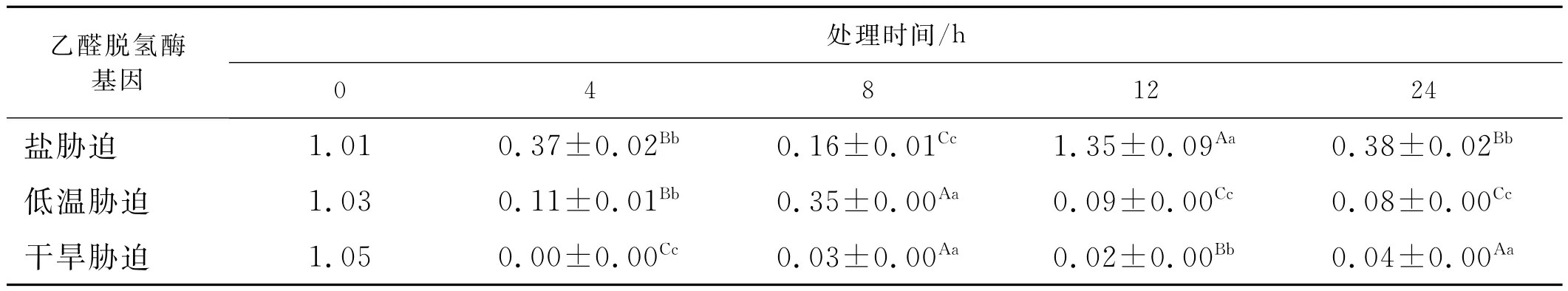
表1 逆境胁迫下苜蓿乙醛脱氢酶基因相对表达量Table1 The expression of ALDH gene under the salt stress
2.4 低温胁迫下苜蓿叶片乙醛脱氢酶基因的表达
低温处理下,RT-PCR能够准确的检测到苜蓿叶片乙醛脱氢酶含量发生的变化(表1),不同处理间相差显著。与对照相比低温处理4h含量低于对照,低温处理8h的苜蓿叶片乙醛脱氢酶含量高于处理4h的,低温处理12h含量低于处理8h含量,低温处理24h的含量低于低温处理12h的含量。低温条件下苜蓿乙醛脱氢酶对逆境表现出一定的适应性,表达量有升有降。
2.5 干旱胁迫下苜蓿叶片乙醛脱氢酶基因的表达
苜蓿在干旱胁迫处理下,乙醛脱氢酶的表达量很少,但RT-PCR能够检测到很少的变化,表明在逆境条件下能够运用RT-PCR技术直观的检测到其微妙变化。干旱胁迫处理4h时植株基本没有表达,干旱处理8h植株乙醛脱氢酶含量的表达量高于4h低于对照,干旱处理12h时低于处理8h、对照。干旱处理24h苜蓿乙醛脱氢酶的表达量高于处理12h的低于对照。乙醛脱氢酶基因的表达量显示苜蓿植株对干旱胁迫处理下表现出明显的调节作用,乙醛脱氢酶基因的表达量显示植株对干旱胁迫很敏感,不同处理间相差显著,对逆境表现出很大的不适应特征。
3 讨论
在逆境胁迫下植株体内发生很多的生理和生化反应,是对外界环境的一种适应性。在逆境胁迫下,苜蓿乙醛脱氢酶的表达量的变化能够反应出对环境的适应性,其中,对盐胁迫处理的适应性高于低温处理,高于干旱处理。干旱处理下植株乙醛脱氢酶的表达量的变化说明环境的调节机制较小,表达量很小。从生理角度讲各种逆境条件如干旱、高盐、低温、水淹或重金属等环境胁迫,都可以使活性氧物质(ROS)在植物细胞中快速、大量的积累,从而造成氧化胁迫。氧化胁迫的危害一方面是活性氧物质直接损伤蛋白质、氨基酸和核酸,并导致膜脂的过氧化反应[7,8];另一方面是膜脂的过氧化反应能产生一些如醛类、烃类、酮和羟酸类等高活性的、有毒的化学物质,毒害细胞甚至导致细胞死亡[9-12]。醛是膜脂过氧化反应的主要产物,是一种活性氧诱导的高毒性物质,它对核酸、氨基酸和蛋白质等会造成严重伤害[13],最终导致细胞死亡。细胞内酶系统的水解活性大于合成活性,氧化活性大于还原活性。试验中在各种逆境胁迫下植株叶片的乙醛脱氢酶基因表达量有升有降,表明逆境下植株的各种代谢活动减弱,植株表现出对环境极大的不适应性。乙醛脱氢酶基因的表达在不同的处理条件下,有升高也有下降的,在处理的这段时间内,植株生理机制发生着微妙的变化,尤其在盐处理、低温处理下植株表现出健壮生长。而在干旱处理下植株表现叶片变薄、萎焉。乙醛脱氢酶基因的表达量很少和基本不表达,表现出对环境的另一种适应性。
4 结论
通过对苜蓿叶、茎、根的乙醛脱氢酶基因表达量的测定,结果表明,叶片的表达量较高,荧光定量PCR能够检测到逆境胁迫下的苜蓿植株的乙醛脱氢酶的基因表达量的微妙的变化。能够把这种方法运用到逆境生理方面;各种胁迫处理条件下苜蓿植株乙醛脱氢酶的表达量不同,在不同的处理时间下苜蓿叶片的乙醛脱氢酶基因的表达量不同。
[1] Munns R.Genes and salt tolerance:Bringing them together[J].New Phytologist,2005,167(3):645-663.
[2] 刘欢,赵桂琴.燕麦抗逆性研究进展[J].草原与草坪,2007(6):63-68.
[3] 张亚军,王丽学,陈超,等.植物对逆境的响应机制研究进展[J].江西农业学报,2011,23(9):60-65.
[4] 李新玲,吴姝菊,王全伟.羊草乙醛脱氢酶(ALDH)基因片段的克隆及表达分析[J].草业学报,2011,20(4):187-193.
[5] 杨红兰,张道远,刘燕,等齿肋赤藓乙醛脱氢酶基因ALDH21的克隆与表达分析[J]基因组学与应用生物学,2010,29(1):24-30.
[6] 张海玲,尚晨,李佶恺,等.乙醛脱氢酶(ALDH)基因转化番茄的研究[J].中国农学通报,2010,26(13):23-29.
[7] Halliwell B,Gutteridge J M C.Protection Against Oxidants in Biological Systems:The Superoxide Theory of Oxygen Toxicity[J].Oxford:Clarendon Press,1989(2):86-123.
[8] 刘建新,王鑫,李博萍.外源一氧化氮供体SNP对NaC1胁迫下黑麦草幼苗叶片抗坏血酸一谷胱甘肽循环的影响[J].草业学报,2010,19(2):82-88.
[9] Allen R D.Dissection of oxidative stress tolerance using transgenic plants[J].Plant Physiology,1995,107(1):1049-1054.
[10] Bartels D.Molecular mechanisms of desiccation tolerance in plants[M]∥Storey K B.Molecular Mechanisms of Metabolic Arrest:Life in Limbo.Oxford:BIOS Scientific Publishers Ltd,2001,8(2):187-196.
[11] Mittle R.Oxidative stress,antioxidants and stress tolerance[J].Trends in Plant Science,2002,7(3):405-410.
[12] Ramanjulu S,Bartels D.Drought-and desiccation-induced modulation of gene expression in plants[J].Plant Cell and Environment,2002,25(4):141-151.
[13] Skibbe D S,Liu F,Wen T J,etal.Characterization of the aldehyde dehydrogenase gene families ofZeamaysandArabidopsistkaliana[J].Plant Molecular Biology,2002,48(3):751-764.

