周期性变动饲粮蛋白质水平对内蒙古白绒山羊内源尿素氮循环和微生物蛋白质合成的影响
樊艳华 孙海洲 桑 丹 李胜利 张春华 珊 丹
(1.内蒙古农业大学动物科学学院,呼和浩特 010018;2.内蒙古自治区农牧业科学院动物营养与饲料研究所,呼和浩特 010031)
反刍动物与单胃动物相比氮利用率较低,为20%~30%,其70%~80%的饲粮氮随粪尿排出体外。所以,通过饲粮管理和周期性的改变饲粮的饲喂方式来提高反刍动物氮利用率是缓解环境污染的一个重要手段。Kiran 等[1]和 Cole等[2]在绵羊和牛上研究发现,饲喂变动蛋白质水平的饲粮可调动反刍动物的尿素氮循环机制,降低粪氮、尿氮排出量,增加沉积氮/摄入氮,而且用于合成的微生物蛋白质的氮增加,机体氮利用率提高。Muscher等[3]通过 Ussing Chamber(US)灌注取瘤胃上皮模拟尿素氮转运来测定尿素氮在瘤胃的流通量,结果显示与中氮饲粮组和变动高氮饲粮组相比,饲喂2 d变动低氮饲粮的羊屠宰后,尿素氮在基膜的流通量更大。
本试验以充分利用尿素氮周转规律为目标,研究周期性变动饲粮蛋白质水平对绒山羊机体内源尿素氮循环及微生物蛋白质合成的影响。
1 材料与方法
1.1 试验动物
本试验选用9只体况良好,体重为(45.63±3.15)kg的装有永久性瘤胃瘘管的内蒙古白绒山羊半同胞羯羊。按体重随机分为3组,每组3只。单笼饲养,常规光照、驱虫与管理,自由饮水。
1.2 饲粮设计
基础饲粮参照我国《肉羊饲养标准》NY/T 816—2004配制,共低蛋白质饲粮(low protein diet,LPD)、中 蛋 白 质 饲 粮 (medium protein diet,MPD)和高蛋白质饲粮(high protein diet,HPD)3种,其组成及营养水平见表1。代谢能为1.4倍维持需要。

表1 基础饲粮组成及营养水平(干物质基础)Table 1 Composition and nutrient levels of basal diets(DM basis)
1.3 试验设计
9只羊采用单因子随机区组试验设计分为3组,分别饲喂中蛋白质饲粮、变动低蛋白质饲粮(oscillating LPD,OSC-LPD)(2 d低蛋白质饲粮—2 d高蛋白质饲粮,循环饲喂)、变动高蛋白质饲粮(oscillating HPD,OSC-HPD)(2 d高蛋白质饲粮—2 d低蛋白质饲粮,循环饲喂)。预试期16 d,正试期12 d。全期饲喂上述饲粮。
1.4 同位素灌注的方法
在正试期的第4天给试验动物的颈静脉安装无菌塑料导管(来自于无菌麻醉包)。从第5天开始连续灌注4 d的[15N15N]-尿素(美国Sigma公司,丰度为98%),根据饲粮蛋白质水平,计算出饲喂低、中、高蛋白质饲粮时对应的同位素灌注量分别为 205.9、343.0 和 476.2 mg/d,同一个变动周期(4 d)内,灌注总量相等,为 823.6 mg/d。
1.5 样品采集
1.5.1 瘤胃液的采集
瘤胃液采集:正试期第5~8天的10:00采瘤胃液,将采集的瘤胃液直接测定pH后用4层纱布过滤,将滤液在3 052×g条件下离心15 min,取0.5 mL上清液用来测定氨氮(NH3-N)浓度,另取0.5 mL上清液加25%的偏磷酸后用于测定挥发性脂肪酸(VFA)浓度。
1.5.2 血样采集
正试期第5~8天的08:30由试验动物颈静脉采血10 mL,缓慢注入涂有肝素(750 IU)的离心管(始终置于冰盒)中,在 30 min内于 4℃2 000×g条件下离心15 min分离血浆样本,制备样品置于-20℃保存。
1.5.3 粪尿样收集
尿样采集:正试期第5~12天收集尿样,用浓度为10%的H2SO4(100 mL/d)来调整尿液pH<3。记录每天总排尿量,过滤后留取10%,分为2份分别用于测定尿氮排出量和[15N15N]-尿素和[14N15N]-尿素含量,于-20℃保存。另外,取10 mL原尿液用蒸馏水稀释到50 mL分装为3份,于-20℃保存,以备测定嘌呤衍生物含量。在正试期的第1~4天以相同的处理方法收集尿液用于测定尿中原有的[15N15N]-尿素和[14N15N]-尿素含量,作为后期计算的对照数据。
粪样采集:正试期第5~12天收集动物鲜粪样,称重后分为2份装袋用于测定粪氮和15N含量,冷冻保存。在试验期的第1~4天以相同的处理方法收集粪样用于测定粪中原有的15N含量。
1.6 样品的分析方法
1.6.1 常规营养成分
粪尿样品的干物质(dry matter,DM)、粗蛋白质(crude protein,CP)、中性洗涤纤维(neutral detergent fiber,NDF)、酸性洗涤纤维(acid detergent fiber,ADF)、钙(calcium,Ca)和磷(phosphorus,P)的测定依据《饲料分析及饲料质量检测技术》[6]测定。
1.6.2 尿素氮
血浆尿素氮(plasma urea nitrogen,PUN)、尿中尿素氮瘤胃液NH3-N浓度以及尿氮、粪氮排出量的测定参照杜建文[7]的方法。
1.6.3 内源尿素氮循环
使用同位素质谱仪(Flash 2000—MAT253联用,美国Thermoelectric公司)测定15N含量,由中国科学院亚热带农业生态研究所完成。
计算粪尿中15N/14N的比值,用于计算进入粪中尿素氮(urea-N loss to feces,UFE)、进入尿中尿素氮(urea-N loss to urine,UUE)含量。
参照 Sarrasecal[8]和 Lobley 等[9]的方法,计算肝脏合成的内源尿素氮(urea-N endogenous produced in liver,UER)、进入胃肠道中的尿素氮(urea-N recycling to the gastrointestinal tract,GER)以及GER当中返回鸟氨酸循的尿素氮(urea-N returned to ornithine cycle,ROC)、用于再合成的尿素氮(urea-N re-used for anabolism,UUA)的含量,计算各部分所占的比例。公式如下:

式中:ED30为每天灌注的[15N15N]-尿素的丰度(%);EU30为尿中[15N15N]-尿素的丰度(%),D30为[15N15N]-尿素的灌注量(mg/d);UUE30为稳定期(正试期第5~12天)尿中[15N15N]-尿素的量(mg/d);u为进入尿中尿素氮/肝脏合成的内源尿素氮;P为尿中同位素含量比值;UUE29为稳定期尿中[14N15N]-尿素的量(mg/d);r为ROC/GER;f为 UFE/GER;a为 UUA/GER。
1.6.4 嘌呤衍生物
尿中嘌呤衍生物排出量的测定参照Chen等[10]的方法测定。
1.6.4.1 尿中嘌呤衍生物排出量
尿中嘌呤衍生物排出量(mmol/d)=尿囊素+尿酸+黄嘌呤+次黄嘌呤。
1.6.4.2 嘌呤衍生物摄取量
Y=0.76×X+(0.202×W0.75×e-0.25)[11]。
式中:X为山羊嘌呤衍生物的摄取量(mmol/d);Y为尿中嘌呤衍生物排出量(mmol/d);0.76代表尿中排出的嘌呤衍生物占总摄取嘌呤衍生物的比例,是个恒定值[8];0.202 也是一个恒定值,代表内源嘌呤供给量(mmol/kg W0.75)[12]。
1.6.5 微生物蛋白质合成量
MN=X×70/(0.116×0.83×1 000)=0.727×X[13]。
式中:MN为微生物蛋白质合成量(g/d,以氮含量计),微生物嘌呤的消化吸收率为0.83,嘌呤中氮的含量是70 mg/mmol,嘌呤中的氮/瘤胃微生物总氮为 0.116。
1.7 数据统计分析
试验数据处理采用SAS 9.0软件的ANOVA进行单因素方差分析。结果均以平均值±标准差表示,以P<0.05作为差异显著判断标准,以 P>0.05作为差异不显著判断标准。
2 结果
2.1 瘤胃发酵参数
从表2可见,中蛋白质饲粮组与变动蛋白质饲粮组比较,瘤胃液pH显著降低(P<0.05),瘤胃液NH3-N 浓度显著增加(P<0.05),乙酸、丙酸和总VFA的浓度显著降低(P<0.05)。变动低蛋白质与变动高蛋白质饲粮组比较,瘤胃液NH3-N浓度显著降低(P<0.05),乙酸浓度显著增加(P<0.05),丁酸浓度显著降低(P<0.05),乙酸/丙酸显著增加(P<0.05),总 VFA浓度无显著变化(P>0.05)。

表2 周期性变动饲粮蛋白质水平对山羊瘤胃发酵参数的影响Table 2 Effects of oscillating dietary protein levels on ruminal fermentation parameters of goats
2.2 氮代谢
从表3可见,中蛋白质饲粮与变动蛋白质饲粮组比较,干物质采食量、摄入氮的量、粪氮/总排出氮、尿氮/总排出氮和血浆尿素氮浓度无显著差异(P>0.05),粪氮、尿氮排出量及总排出氮/摄入氮和尿中尿素氮含量显著增加(P<0.05),沉积氮和沉积氮/摄入氮显著降低(P<0.05)。变动高蛋白质饲粮组与变动低蛋白质饲粮组比较,以上指标均无显著差异(P>0.05)。
2.3 内源尿素氮循环
从图1、图2可见,饲喂中蛋白质饲粮时,尿中[15N15N]-尿素的丰度在24~48 h内达到平台期,然而[14N15N]-尿素的丰度在48~72 h内达到平台期;饲喂变动高蛋白质饲粮尿中[15N15N]-尿素和尿中[14N15N]-尿素在 0~26 h增长最快,在48~72 h增长减缓;饲喂变动低蛋白质饲粮尿中[15N15N]-尿素和尿中[14N15N]-尿素都呈增长趋势。从图3可见,粪中15N的丰度在3种不同条件下,连续灌注4 d内都呈逐渐增加趋势,无平台期。

表3 周期性变动饲粮蛋白质水平对山羊氮代谢的影响Table 3 Effects of oscillating dietary protein levels on nitrogen metabolites of goats
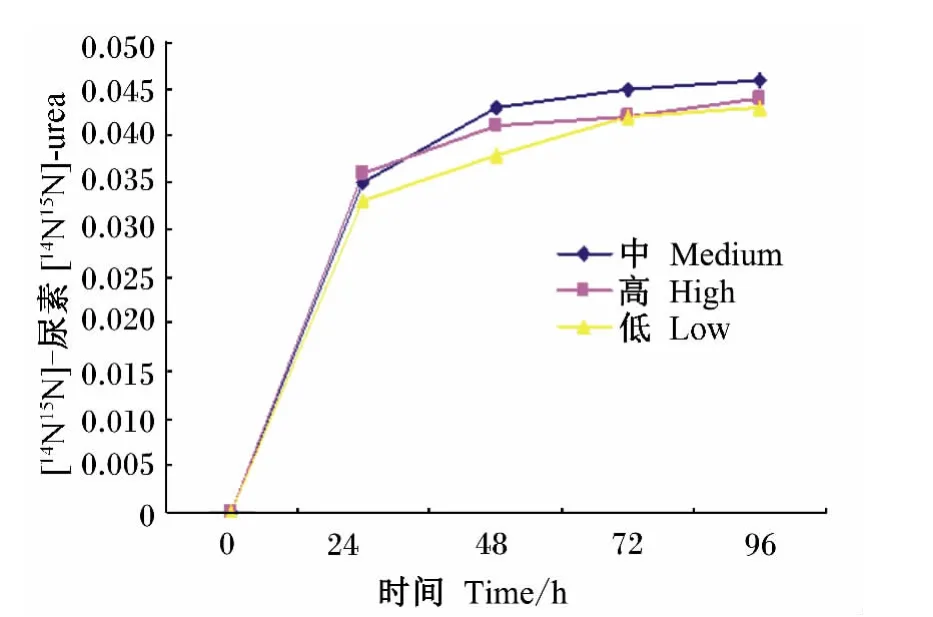
图1 尿中[14N15N]-尿素的丰度Fig.1 Abundance of[14N 15N]-urea in urine

图2 尿中[15 N15 N]-尿素的丰度Fig.2 Abundance of[15 N 15 N]-urea in urine

图3 粪中15 N的丰度Fig.3 Abundance of 15 N in feces
从表4可见,与中蛋白质饲粮组相比,饲喂变动蛋白质饲粮后,山羊 UER、GER、ROC和 UUE的含量显著减少(P<0.05),UFE的含量无显著变化(P>0.05),UUE/UER 和 ROC/GER 显著减少(P<0.05),UFE/GER 和 UUA/GER 显著增加(P<0.05)。与中蛋白质饲粮组相比,饲喂变动高蛋白质饲粮,UUA的含量无显著变化(P>0.05),饲喂变动低蛋白质饲粮UUA的含量显著减少(P<0.05),但饲喂2种变动蛋白质饲粮均使 UUA/GER 显著增加(P<0.05)。

表4 周期性变动饲粮蛋白质水平对山羊内源尿素氮循环的影响Table 4 Effects of oscillating dietary protein levels on endogenous urea nitrogen recycling of goats
2.4 微生物蛋白质合成量
从表5可见,中蛋白质饲粮组与变动蛋白质饲粮组比较,黄嘌呤+次黄嘌呤的排出量无显著差异(P>0.05),尿酸排出量显著增加(P<0.05),尿囊素、尿中嘌呤衍生物排出量和微生物蛋白质合成量显著降低(P<0.05)。然而变动低蛋白质饲粮组与变动高蛋白质饲粮组比较,以上指标均无显著差异(P>0.05)。
3 讨 论
3.1 饲喂变动蛋白质水平饲粮对内蒙古白绒山羊瘤胃发酵参数的影响
瘤胃液pH是综合反映瘤胃微生物、代谢产物、有机酸产生、吸收、排除及中和状况的一项综合指标。研究发现,瘤胃液pH的变化范围为5.0~7.5,变动的规律取决于饲粮性质和饲喂后的时间[14]。本试验中绒山羊瘤胃液pH变化范围为6.13~6.33,符合反刍动物瘤胃液pH 的变化规律,而且变动蛋白质饲粮组与中蛋白质饲粮组相比,瘤胃液pH更高一些。
瘤胃液NH3-N浓度是微生物蛋白质合成的一个关键因素。Satter等[15]通过体外试验发现在最适的瘤胃液NH3-N浓度下,微生物蛋白质的合成量达到最大,为5.0 mg/dL。已有研究显示,在广泛的饲粮下瘤胃液NH3-N浓度都大于5.0 mg/dL。需要指出的是,在动物采食4 h以后测定的瘤胃液NH3-N浓度最高,而且可能是1 d中最佳的值。但Firkins等[16]提出的瘤胃液NH3-N浓度与微生物蛋白质合成量的最大值和最佳值是矛盾的。瘤胃液NH3-N浓度增加能促进微生物蛋白质的合成,但是动物氮利用率会降低。所以,寻求一个最佳瘤胃液NH3-N浓度很重要。本试验中饲喂变动蛋白质水平饲粮后,绒山羊瘤胃液NH3-N浓度降低,微生物蛋白质的合成量增加。
VFA是饲粮中碳水化合物瘤胃发酵的终产物,是反刍动物主要的能量来源,约为反刍动物吸收能量的70%~80%。本试验中饲喂变动蛋白质水平饲粮后,绒山羊瘤胃液乙酸浓度增加,说明纤维素分解菌活性增加,与Colmenero等[17]研究得到的结果相似。本试验中,绒山羊瘤胃液丙酸和丁酸浓度增加,丙酸是葡萄糖的合成前体,90%的丙酸在肝脏中进行糖异生,其余则在肾脏中转变成葡萄糖。而丁酸浓度增加可能是来自高氮浓度饲粮的真蛋白质的氨基酸的氧化脱氨基作用和脱羧作用造成的,这与 Ipharraguerre等[18]在奶牛上得到的结果相似。
3.2 饲喂变动蛋白质水平饲粮对内蒙古白绒山羊机体氮代谢的影响
已有研究表明,影响反刍动物氮排出的主要因素是摄入氮的量[19-20]。Reynolds 等[21]研究发现降低摄入氮的量能够降低氮排出,但同时也可能降低动物体重和产奶量。而相比之下许多的研究发现改变饲粮的饲喂方式能够在保持反刍动物氮需求不变的基础上减少氮排出。在圈养牛[2,22]和绵羊[1]上都得到相似的结论。
本试验中饲喂变动蛋白质水平饲粮与稳定的饲粮蛋白质水平比较,绒山羊氮摄入量无显著差异,但粪氮、尿氮排出量降低,沉积氮增加,沉积氮/摄入氮提高。这与Cole等[2]得出的结果一致,特别是在饲喂中蛋白质饲粮时尿中尿素氮排出量较高。从环境的角度看,尿中尿素氮是最大的污染物,50%~90%在空气下迅速挥发。通过降低瘤胃液NH3-N浓度来降低尿中尿素氮含量,可提高牧场营养管理和环境管理[23-24]。
3.3 饲喂变动蛋白质水平饲粮对内蒙古白绒山羊内源尿素氮循环的影响
研究表明,如果饲粮氮水平的变动与肠道内消化物的存留时间是同步的,那么饲喂变动蛋白质水平饲粮就能实现沉积氮的增加[22,25]。已有研究显示,动物采食碎干草和压碎的大麦消化物在肠道存留的平均时间为47 h,说明间隔48 h变动1次饲粮氮水平的这种饲喂方式与消化物在肠道的存留时间是同步的。在阉羊上运用动静脉血插管技术测定门静脉回流内脏组织(portal drained discera,PDV)中流通的含氮化合物的量,发现当饲喂变动蛋白质水平饲粮时摄入氮的量和尿素在PDV的摄取量更大[26]。因此,在饲喂变动蛋白质水平饲粮时,不能决定性地把沉积氮的增加归于尿素氮在胃肠道的转运比例的增加。Kiran等[1]通过US灌注取瘤胃上皮模拟尿素转运来测定尿素在瘤胃的流通量,结果显示与变动高蛋白质饲粮和中蛋白质饲粮相比,饲喂2 d变动低蛋白质饲粮的羊屠宰后所得到的尿素在瘤胃上皮的流通量更大。由此可以看出,在2 d的低蛋白质饲粮期有大量的尿素氮回流到瘤胃,是变动蛋白质饲粮提高氮利用率的部分原因。Cole等[24]也提出在变动饲粮的低蛋白质期有较高的尿素氮从血液转运回到瘤胃,用于微生物蛋白质的合成。
Lapierre等[27]研究表明,绵羊和牛在采食静态氮水平饲粮时,肝脏中合成的尿素氮循环回胃肠道的比例为40%~80%,用于合成代谢的尿素氮为35%~55%。在本试验中,由于灌注量占绒山羊体内总氮量的比例很小,对氮平衡无显著的影响,可忽略不计。饲喂变动蛋白质水平的饲粮后,绒山羊UER、GER、ROC和 UUE的含量都减少,而UFE的含量并无显著变化,而GER/UER增加了2.91% ~3.49%,UUE/UER 和 ROC/GER 减 少,UUA/GER 增加了 3.55%~4.45%。
另外,当饲喂变动蛋白质水平饲粮时,除了尿素氮循环的增加之外,整个机体氮代谢也有改变。已有对绵羊的研究发现,绵羊被从饲喂正常饲粮转化为低蛋白质饲粮1~2 d内,给其胃内灌注营养物质,尿氮排出量、总机体蛋白质流通量以及蛋白质的合成量与降解量显著降低。原因是随着摄入氮的量改变,机体蛋白质周转会有激烈的反应。这说明饲喂变动蛋白质水平饲粮能够改变整个机体蛋白质代谢。
3.4 饲喂变动蛋白质水平饲粮对内蒙古白绒山羊微生物蛋白质合成量的影响
本试验研究结果显示,饲喂变动蛋白质水平饲粮同饲喂中蛋白质饲粮相比,绒山羊尿酸排出量增加,尿囊素、尿中嘌呤衍生物排出量和微生物蛋白质合成量显著增加。Doranalli等[28]研究发现,在饲喂周期性变动蛋白质饲粮后,绵羊尿中嘌呤衍生物排出量增加,微生物蛋白质合成量也增加。并据此得出结论认为,在变动饲粮周期中,饲喂2 d低氮饲粮后,可能是饲粮中氮缺乏引起尿素氮循环增加,从而增加了用于合成微生物蛋白质的尿素氮,最终导致尿中嘌呤衍生物排出量和微生物蛋白质合成量的量增加。
4 结论
①在本试验饲粮条件下,饲喂变动蛋白质水平的饲粮可降低绒山羊瘤胃液NH3-N浓度和粪氮、尿氮的排出量,而增加沉积氮/摄入氮,绒山羊机体氮利用率提高。
②在本试验饲粮条件下,饲喂变动蛋白质水平的饲粮可增加绒山羊GER/UER、UUA/GER,绒山羊微生物蛋白质合成量增加。
[1] KIRAN D,MUTSVANGWA T.Nitrogen utilization in growing lambs fed oscillating dietary protein concentrations[J].Animal Feed Science and Technology,2009,152(1/2):33-41.
[2] COLE N A,GREENE L W,MCCOLLUM F T,et al.Influence of oscillating dietary crude protein concentration on performance,acid-base balance,and nitrogen excretion of steers[J].Journal of Animal Science,2003,81(11):2660-2668.
[3] MUSCHER A S,SCHRÖDER B,BREVES G,et al.Dietary nitrogen reduction enhances urea transport across goat rumen epithelium[J].Journal of Animal Science,2010,88(10):3390-3398.
[4] ALDERMAN G,COTTRILL B R.Energy and protein requirements of ruminants[S].Wallingford:CAB International,1993.
[5] 李玫.美国 Feedstuffs饲料成分分析表(2007版)[J].饲料广角,2007(12):37-40.
[6] 杨胜.饲料分析及饲料质量检测技术[M].北京:北京农业大学出版社,1993.
[7] 杜建文.不同日粮对内蒙古白绒山羊消化道UT-B表达的影响研究[D].硕士学位论文.呼和浩特:内蒙古农业大学,2010.
[8] SARRASECA A,MILNE E,METCALF M J,et al.U-rea recycling in sheep:effects of intake[J].The British Journal of Nutrition,1998,79(1):79-88.
[9] LOBLEY G E,BREMNER D M,ZUUR G.Effects of diet quality on urea fates in sheep as assessed by refined,non-invasive[15N15N] urea kinetics[J].The British Journal of Nutrition,2000,84(4):459-468.
[10] CHEN X B,GOMES M J.Estimation of microbial protein supply to sheep and cattle based on urinary excretion of purine derivatives-an overview of the technical details[J].International Feed Resources Unit,1992:1-19.
[11] ORELLANA-BOERO P,SERADJA R,FONDEVILA M,et al.Modelling urinary purine derivatives excretion as a tool to estimate microbial rumen out?ow in alpacas(Vicugna pacos)[J].Small Ruminant Research,2012,107(2/3):101-104.
[12] CHEN X B,ØRSKOV E R.Research on urinary excretion of purine derivatives in ruminants:past,present and future[M]//Estimation of microbial protein supply in ruminants using urinary purine derivatives.Netherlands:Springer,2004:180-210.
[13] CARRO M D,CANTALAPIEDRA-HIJAR G,RANILLA M J,et al.Urinary excretion of purine derivatives,microbial protein synthesis,nitrogen use,and ruminal fermentation in sheep and goats fed diets of different quality[J].Journal of Animal Science,2012,90(11):3963-3972.
[14] 韩正康,陈杰.反刍动物瘤胃的消化和代谢[M].北京:科学出版社,1988.
[15] SATTER L D,SLYTER L L.Effect of ammonia concentration on rumen microbial protein production in vitro[J].The British Journal of Nutrition,1974,32(2):199-208.
[16] FIRKINS J L,YU Z,MORRISON M.Ruminal nitrogen metabolism:perspectives for integration of microbiology and nutrition for dairy[J].Journal of Dairy Science,2007,90(Suppl.1):E1-E16.
[17] COLMENERO JJO,BRODERIC G A.Effect of dietary crude protein concentration on milk production and nitrogen utilization in lactating dairy cows[J].Journal of Dairy Science,2006,89(5):1704-1712.
[18] IPHARRAGUERRE I R,CLARK J H,FREEMAN D E.Varying protein and starch in the diet of dairy cows.Ⅰ.Effects on ruminal fermentation and intestinal supply of nutrients[J].Journal of Dairy Science,2005,88(7):2537-2555.
[19] CASTILLO A R,KEBREAB E,BEEVER D E,et al.A review of efficiency of nitrogen utilisation in lactating dairy cows and its relationship with environmental pollution[J].Journal of Animal and Feed Sciences,2000,9:1-32.
[20] YAN T,FROST J P,AGNEW R E,et al.Relationships among manure nitrogen output and dietary and animal factors in lactating dairy cows[J].Journal of Dairy Science,2006,89(10):3981-3991.
[21] REYNOLDSC K,KRISTENSEN N B.Nitrogen recycling through the gut and the nitrogen economy of ruminants:an asynchronous symbiosis[J].Journal of Animal Science,2008,86(Suppl.14):E293-E305.
[22] LUDDEN P A,PAS,WECHTER T L,et al.Effects of oscillating dietary protein on growth,efficiency,and serum metabolites in growing beef steers[J].Professional Animal Scientist,2003,19(1):30-34.
[23] ERICKSON G E,KLOPFENSTEIN T J.Nutritional methods to decrease N losses from open-dirt feedlots in Nebraska[J].The Scientific World Journal,2001,1(S2):836-843.
[24] COLE N A,CLARK R N,TODD R W,et al.Influence of dietary crude protein concentration and source on potential ammonia emissions from beef cattle manure[J].Journal of Animal Science,2005,83(3):722-731.
[25] LUDDEN P A,WECHTER T L,HESS B W.Effects of oscillating dietary protein on nutrient digestibility,nitrogen metabolism,and gastrointestinal organ mass in sheep[J].Journal of Animal Science,2002,80(11):3021-3026.
[26] ARCHIBEQUE S L,FREETLY H C,FERRELL C L.Net portal and hepatic flux of nutrients in growing wethers fed high-concentrate diets with oscillating protein concentrations[J].Journal of Animal Science,2007,85(4):997-1005.
[27] LAPIERRE H,LOBLEY G E.Nitrogen recycling in the ruminant:a review[J].Journal of Dairy Science,2001,84(Suppl.):E223-E236.
[28] DORANALLI K,PENNER G B,MUTSVANGWA T.Feeding oscillating dietary crude protein concentrations increases nitrogen utilization in growing lambs and this response is partly attributable to increased urea transfer to the rumen[J].The Journal of Nutrition,2011,141(5):560-567.

