高棉籽粕饲料中补充赖氨酸和铁对青鱼幼鱼生长、免疫力及组织中游离棉酚含量的影响
胡 毅 张俊智 黄 云 肖调义 钟 蕾* 米海峰 彭慧珍
(1.湖南农业大学动物科学技术学院,长沙 410128;2.通威股份有限公司,成都 610041)
豆粕因蛋白质含量高、氨基酸组成相对平衡,被广泛用作水产饲料中的优质植物蛋白质源,然而,近几年豆粕价格持续高涨,使饲料的成本大幅提高。与豆粕相比,棉籽粕具有明显的价格优势,其价格不到豆粕的2/3,并且具有产量大、蛋白质含量高、氨基酸组成较平衡等优点。国际上棉籽粕产量仅次于豆粕,我国棉籽粕年产量达到650万t,是仅次于豆粕、菜籽粕的第三大植物蛋白质源。因此,利用相对廉价的棉籽粕部分或全部替代饲料中的豆粕具有较大的市场开发和应用前景。目前,关于棉籽粕部分或全部替代饲料中的豆粕已在虹鳟(Oncorhynchus mykiss)[1-2]和鲈鱼(Lateolabrax japonicus)[3]等鱼类上有相关研究。然而,由于棉籽粕中游离棉酚的存在,影响了棉籽粕在水产饲料中的应用和推广。棉籽粕中游离棉酚能同赖氨酸结合导致赖氨酸利用率降低,对动物生长产生不利影响[4],此外,游离棉酚能降低饲料中铁的吸收,引起动物红细胞数量下降[5],并且游离棉酚被吸收入体内存积于肝脏、肾脏和肌肉组织中,引起累积性中毒[6-7],以上不利因素均影响了其在水产饲料中的添加量。本实验室前期研究表明,高棉籽粕饲料会降低青鱼幼鱼的生长和免疫力,降低青鱼血液中红细胞(RBC)和白细胞(WBC)的数量,造成肝脏中游离棉酚累积,使肝功能受损[8]。鉴于此,本试验拟通过在高棉籽粕饲料中补充补充铁和赖氨酸,探讨在高棉籽粕饲料中补充铁和赖氨酸能否改善青鱼幼鱼的生长,降低游离棉酚的毒性,改善肝功能,降低肝脏和肌肉中游离棉酚含量,为提高饲料中棉籽粕的利用提供科学依据。
1 材料与方法
1.1 试验饲料
以商品饲料配方为基础,配制一种以鱼粉、豆粕(粗蛋白质含量为43%)为蛋白质源的实用饲料作为豆粕对照饲料,在上述饲料的基础上以棉籽粕(粗蛋白质含量为42%)等蛋白质替代100%的豆粕作为高棉籽粕饲料,并在高棉籽粕饲料中分别用 0.342%的晶体赖氨酸(有效含量 79%)、0.115%的七水硫酸亚铁以及0.342%的晶体赖氨酸+0.115%的七水硫酸亚铁等量替代面粉,分别作为高棉籽粕补充赖氨酸饲料、高棉籽粕补充铁饲料、高棉籽粕补充铁和赖氨酸饲料。试验所配制的5种试验饲料等氮等能,其中赖氨酸补充量以豆粕对照组为标准,铁补充量参照Barros等[9]的试验(游离棉酚与亚铁离子比例为1∶1),试验饲料组成及营养水平见表1。饲料原料经粉碎过40目筛,微量成分采取逐级扩大法混合均匀,采用双螺旋压条机挤压出2.0 mm粒径饲料颗粒,于阴凉处风干后置于-20℃冰柜中保存备用。
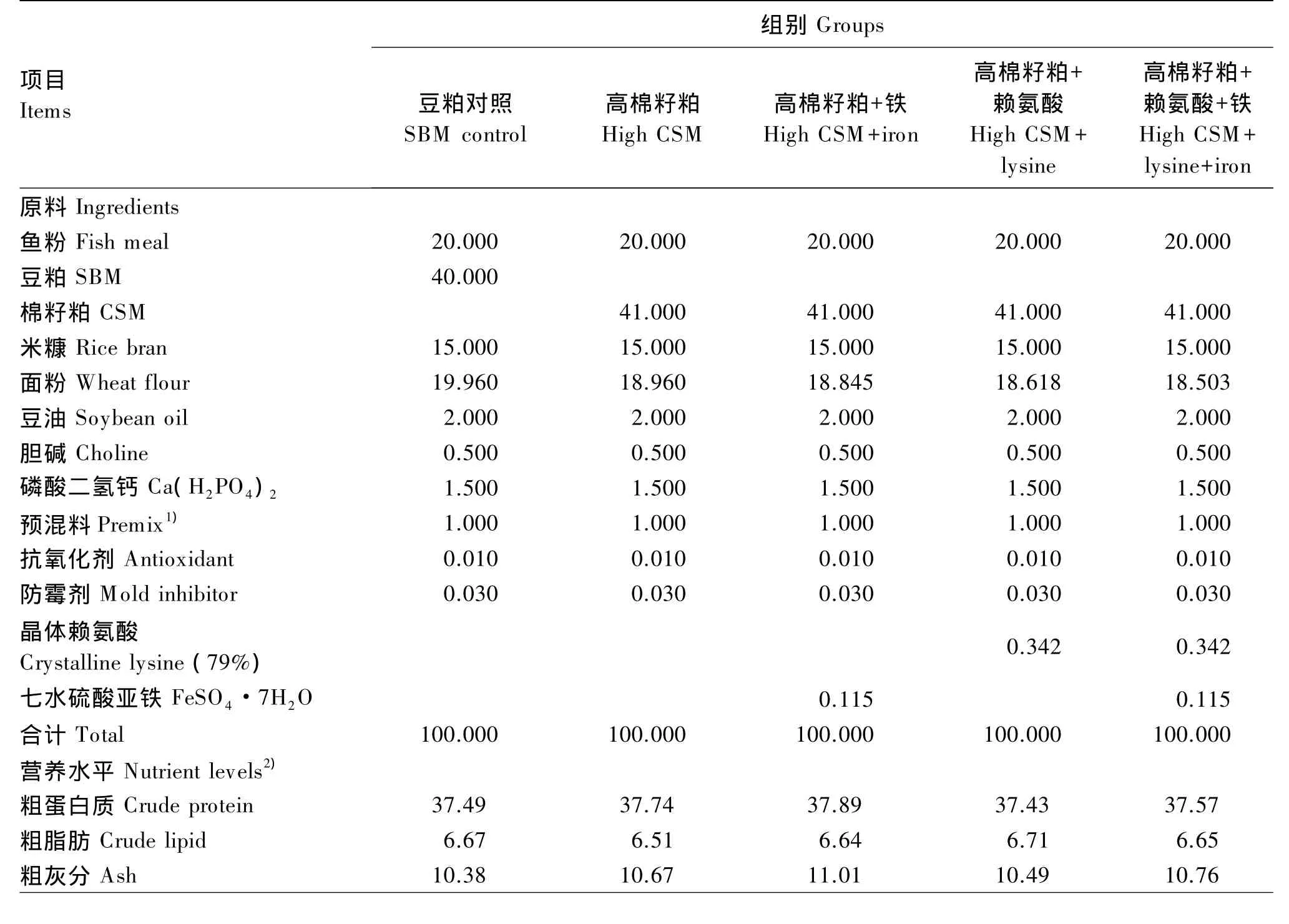
表1 试验饲料组成及营养水平(干物质基础)Table 1 Composition and nutrient levels of experimental diets(DM basis) %
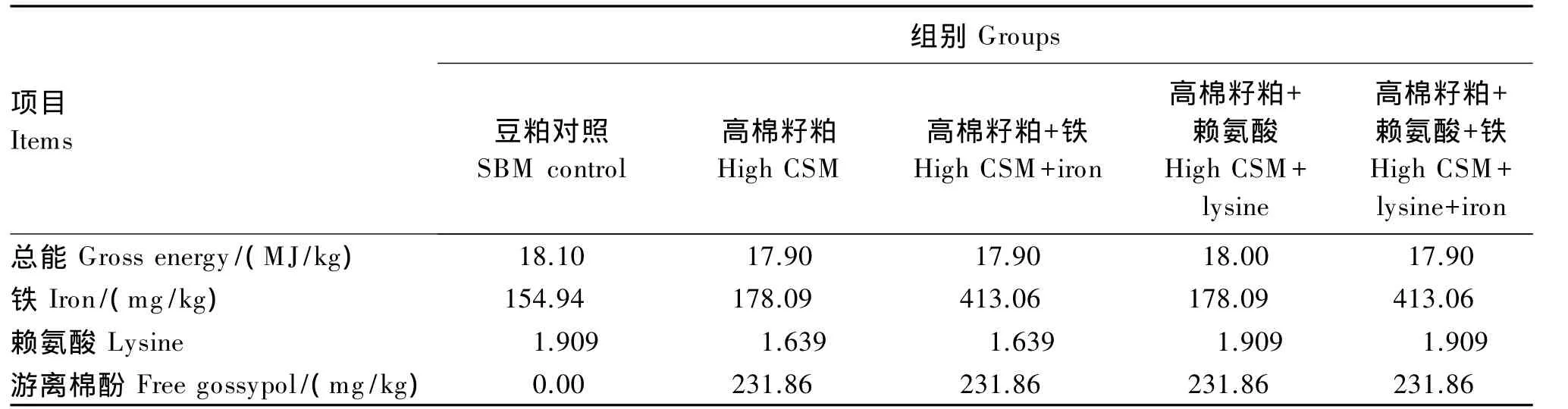
续表1
1.2 饲养管理
试验用青鱼由湖南省水产科学研究所鱼类原种场提供,为同批次人工孵化鱼苗,试验前在室外水泥池中投喂商品饲料暂养20 d后,挑选个体大小均匀、体格健壮青鱼于室内水族箱(容积300 L)中投喂豆粕对照饲料驯化1周,饥饿24 h后,挑选规格一致、初始平均体重为(7.01±0.05)g 的青鱼进行养殖试验。试验鱼随机分成6组,每组3个重复,每个重复30尾,以重复为单位放养于水族箱内。日投饵量为体重的3%~5%,分 3次投喂(08:00、12:00、16:00),每日换水 1 次,换水量占总体积的1/3并清除箱内粪便,每日充气12 h,保证溶氧浓度在5.0 mg/L以上,水温(28±3)℃,pH 7.32±0.42,养殖时间持续 8 周。
1.3 样品收集与指标测定
1.3.1 生长指标
试验开始和结束时分别对各水族箱中青鱼进行记数、称重,计算存活率和特定生长率。每个水族箱随机取5尾青鱼供内脏指数、肝胰指数和肥满度测定。各指标计算公式如下:
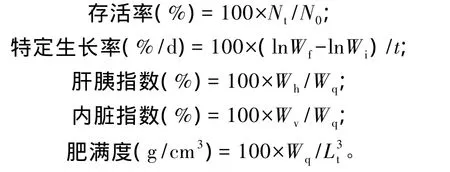
式中:N0为初始鱼数(尾);Nt为终末鱼数(尾);Wf为平均终末体重(g);Wi为平均初始体重(g);t为饲养时间(d);Wh为肝胰脏重(g);Wv为内脏重(g);Wq为鱼体重(g);Lt为鱼体长(cm)。
1.3.2 血液生理生化指标测定
试验结束后停食24 h,用1 mL无菌注射器尾静脉采血,用移液枪吸取部分血液,用RBC稀释液稀释200倍,Neubauer计数板计RBC数量,其余血液置于无菌离心管中,4℃静置12 h,3 500 r/min离心15 min,取上层血清置于-80℃超低温冰箱保存备用。
血清谷草转氨酶(glutamic oxaloacetic transaminase,GOT)、谷 丙 转 氨 酶 (glutamic pyruvic transaminase,GPT)、溶菌酶(lysozyme,LZM)、总超氧化物歧化酶(total superoxide dismutase,T-SOD)活力采用南京建成生物工程研究所生产的试剂盒测定;血清补体4(complement 4,C4)含量采用浙江伊利康生物技术有限公司生产的试剂盒测定。
1.3.3 饲料和鱼体中常规营养成分测定
试验结束后,每个水族箱随机取5尾青鱼,-20℃冰冻保存作为全鱼样品。饲料和鱼体样品中常规营养成分测定参照 AOAC(1995)[10]的方法。其中,水分含量的测定采用105℃烘箱干燥恒重法,粗蛋白质含量的测定采用凯氏定氮法,粗脂肪含量的测定采用索氏抽提法,粗灰分含量的测定采用550℃灼烧法,总能水平的测定采用氧弹式热量计法。
1.3.4 组织中游离棉酚含量测定
组织游离棉酚含量参照GB/T 17334—1998所述方法测定。取青鱼肌肉和肝脏组织,称鲜重,冷冻干燥后称干重,记算水分含量,磨碎。称取0.200 0 g左右干样,加入 5 mL无水乙醇,振荡2 min,静置分层,取上清,离心并过滤(0.45 μm 滤膜),得到试样。取试样10μL,用高效液相色谱仪测定游离棉酚含量。标准曲线制备:准确吸取1.00、2.00、5.00、8.00 mL 的 50 μg/mL 棉酚标准液于10.0 mL容量瓶中,用无水乙醇稀释至刻度,取10μL液相色谱测定,绘制标准曲线。组织中游离棉酚含量查标准曲线既得。
1.4 数据统计分析
试验结果以平均值±标准差表示,用 SPSS 17.0软件进行单因素方差分析,当差异显著(P<0.05)时,则采用Duncan氏法进行多重比较。
2 结果
2.1 高棉籽粕饲料补充赖氨酸和铁对青鱼幼鱼生长的影响
由表2可知,各组间青鱼的存活率无显著差异(P>0.05)。与豆粕对照组相比,高棉籽粕组青鱼的特定生长率显著降低(P<0.05);在高棉籽粕饲料中单一补充赖氨酸、铁及同时补充赖氨酸和铁均能一定程度提高青鱼的特定生长率,其中同时补充赖氨酸和铁组(高棉籽粕+赖氨酸+铁组)与高棉籽粕组差异显著(P<0.05),与豆粕对照组差异不显著(P>0.05)。各组间青鱼的内脏指数和肝胰指数无显著差异(P>0.05)。与豆粕对照组比,高棉籽粕组青鱼的肥满度显著降低(P<0.05),在高棉籽粕饲料中单一补充赖氨酸、铁及同时补充赖氨酸和铁均能一定程度提高青鱼的肥满度,但仍显著低于豆粕对照组(P<0.05)。
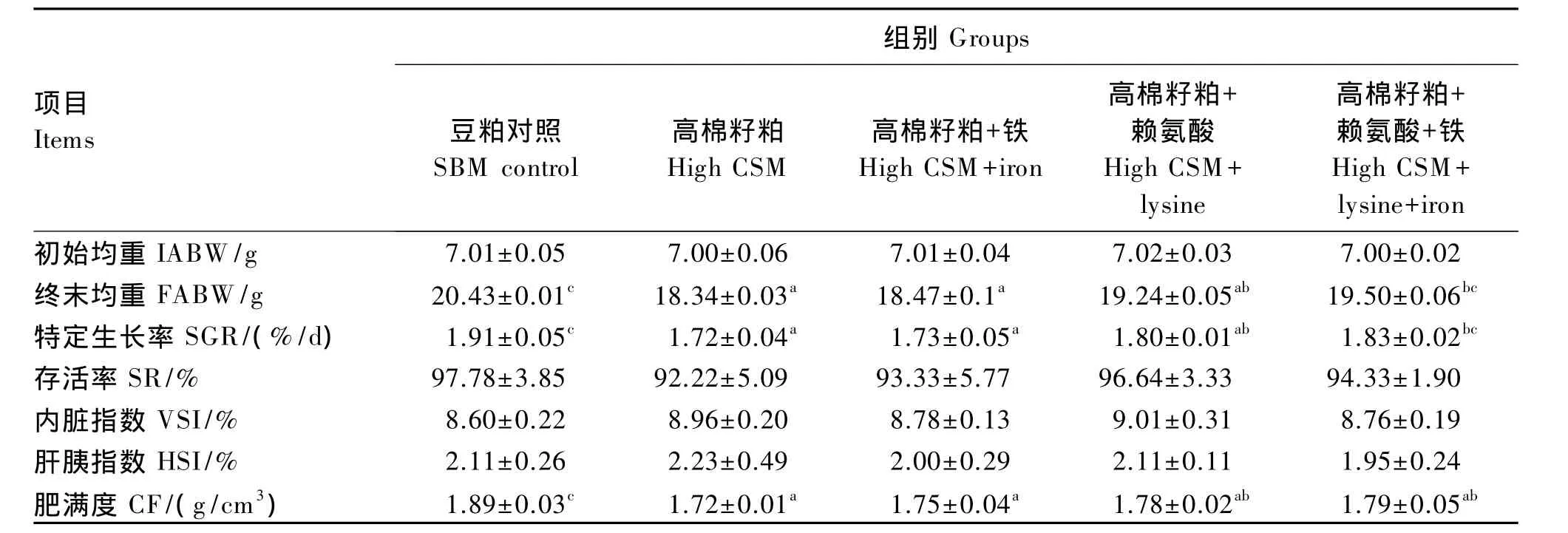
表2 高棉籽粕饲料中补充赖氨酸和铁对青鱼幼鱼生长的影响Table 2 Effects of high cottonseed meal diet supplemented with lysine and iron on growth of juvenile black carp
2.2 高棉籽粕饲料中补充赖氨酸和铁对青鱼幼鱼血液生理生化指标的影响
由表3可知,与豆粕对照组相比,高棉籽粕饲料显著降低了血液RBC数量(P<0.05),在高棉籽粕饲料中补充铁能一定程度提高血液RBC数量,且高棉籽粕+赖氨酸+铁组血液RBC数量与豆粕对照组无显著差异(P>0.05)。棉籽粕替代豆粕显著降低了青鱼血清 C4含量(P<0.05),而在高棉籽粕饲料中补充铁能显著提高血清C4含量(P<0.05),且单一补充铁组(高棉籽粕+铁组)血清C4含量与豆粕对照组无显著差异(P>0.05)。与豆粕对照组相比,高棉籽粕饲料显著降低了青鱼血清T-SOD活力(P<0.05),高棉籽粕饲料中补充赖氨酸后其活力显著高于高棉籽粕组(P<0.05),且与豆粕对照组无显著差异(P>0.05)。棉籽粕替代豆粕显著降低了青鱼血清LZM 活力(P<0.05),与高棉籽粕组相比,高棉籽粕饲料中单一补充赖氨酸、铁及同时补充赖氨酸和铁均显著提高了血清LZM活力(P<0.05),但仍都显著低于豆粕对照组(P<0.05)。棉籽粕替代豆粕显著提高了青鱼血清GOT和GPT活力(P<0.05),与高棉籽粕饲料组相比,高棉籽粕饲料中补充铁和赖氨酸后显著降低了血清GOT和GPT活力(P<0.05),且单一补充铁组血清GOT、GPT活力与豆粕对照组无显著差异(P>0.05)。
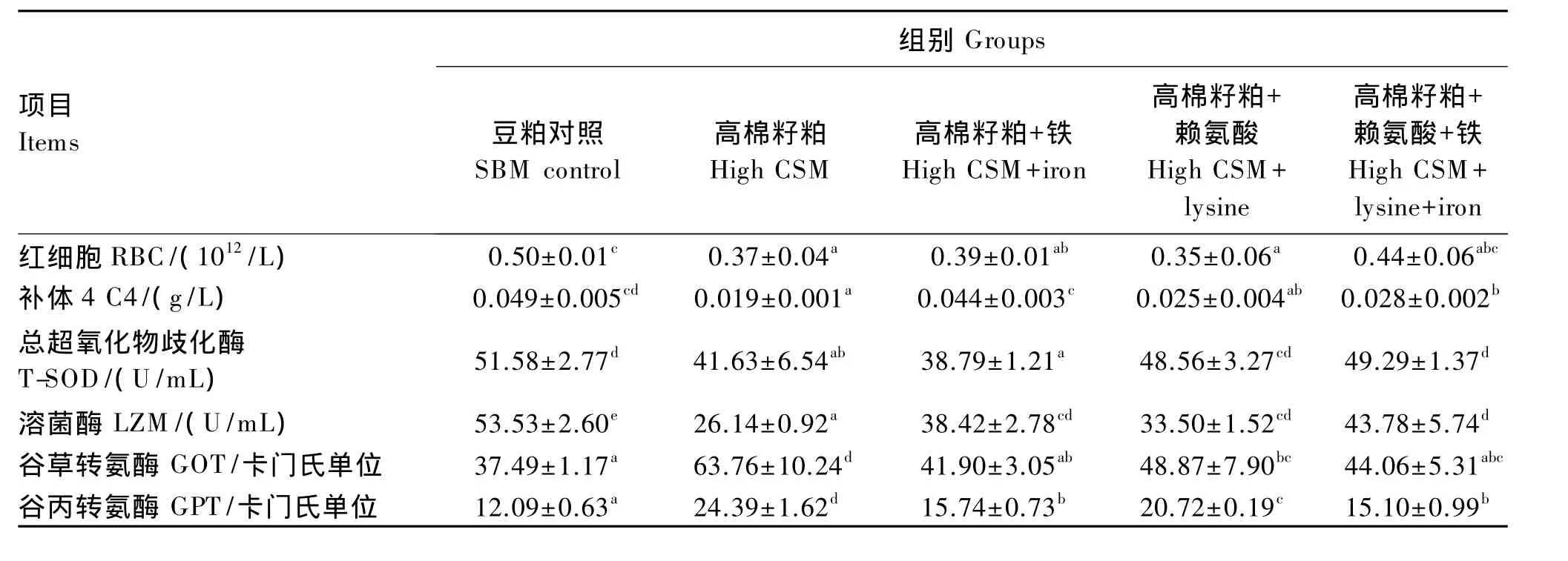
表3 高棉籽粕饲料中补充赖氨酸和铁对青鱼幼鱼血液生理生化指标的影响Table 3 Effects of high cottonseed meal diet supplemented with lysine and iron on blood physiological-biochemical indexes of juvenile black carp
2.3 高棉籽粕饲料中补充赖氨酸和铁对青鱼幼鱼体成分及组织中游离棉酚含量的影响
由表4可知,各组间鱼体水分和粗灰分含量差异不显著(P>0.05),而棉籽粕替代豆粕影响了鱼体粗蛋白质和粗脂肪含量,使鱼体粗脂肪含量显著提高(P<0.05),粗蛋白质含量显著降低(P<0.05);与高棉籽粕饲料组相比,高棉籽粕饲料中单一补充铁和赖氨酸对鱼体粗脂肪和粗蛋白质含量无显著影响(P>0.05),但同时补充铁与赖氨酸能显著降低鱼体粗脂肪含量(P<0.05),显著提高鱼体粗蛋白质含量(P<0.05),且与豆粕对照组无显著差异(P>0.05)。与高棉籽粕饲料组相比,高棉籽粕饲料中补充铁显著降低了肌肉和肝脏中游离棉酚含量(P<0.05),而单一补充赖氨酸对肝脏中游离棉酚含量无显著影响(P>0.05)。
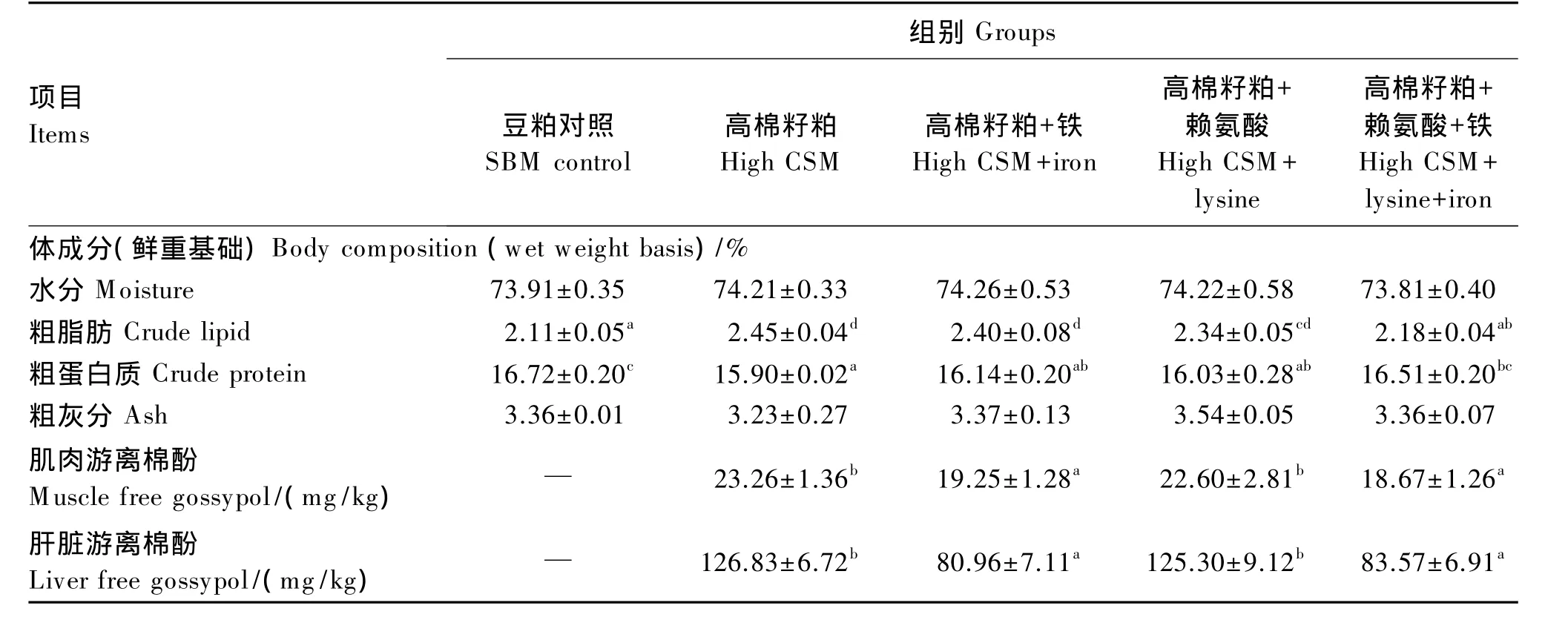
表4 高棉籽粕饲料中补充赖氨酸和铁对青鱼体成分及组织中游离棉酚含量的影响Table 4 Effects of high cottonseed meal diet supplemented with lysine and iron on body composition and tissue free gossypol content of juvenile black carp
3 讨论
3.1 高棉籽粕饲料中补充赖氨酸和铁对青鱼幼鱼生长的影响
本研究结果表明,棉籽粕替代豆粕显著降低了青鱼特定生长率,与本实验室前期研究结果一致[11]。高棉籽粕饲料降低青鱼的生长性能与棉籽粕中游离棉酚相关,研究表明,饲料中高含量的游离棉酚能降低尼罗罗非鱼(Oreochromis niloticus)[12]和鹦鹉鱼(Amphilophus)[13]的生长和饲料利用率。游离棉酚主要通过以下2个方面来影响鱼类的生长和饲料利用率:1)游离棉酚在肠道能与铁结合降低饲料中铁的利用率[14];2)游离棉酚能结合饲料中的赖氨酸,降低饲料中赖氨酸的利用率[15]。本试验结果表明,在高棉籽粕饲料中同时补充铁和赖氨酸能显著提高青鱼的特定生长率,与 Barros 等[9]和 Robinson[16]在 斑 点 叉 尾(Ictalurus punctatus)、Ei-Saidy 等[12]在尼罗罗非鱼上的研究结果相似,其原因一方面可能与添加的外源晶体赖氨酸与棉籽粕中游离棉酚结合,减少了游离棉酚与内源赖氨酸的结合,从而提高了饲料中赖氨酸的利用率有关[16],另一方面可能与添加的外源铁与游离棉酚在肠道内结合减少了游离棉酚的吸收,降低了游离棉酚对机体的毒性有关[17-18]。高棉籽粕饲料显著降低青鱼的肥满度,补充铁和赖氨酸后能一定程度提高肥满度,可能是因为游离棉酚与赖氨酸结合后抑制了与蛋白质及脂肪代谢相关酶的合成,补充外源铁和赖氨酸缓解了游离棉酚与赖氨酸的结合,促进了与蛋白质代谢和脂肪代谢相关酶的合成。
3.2 高棉籽粕饲料中补充赖氨酸和铁对青鱼幼鱼免疫力的影响
鱼类血液指标能反映鱼类机体健康和生理状态,RBC具有识别、黏附和杀伤抗原、清除免疫复合物和参与机体免疫调控的作用,是机体免疫系统的重要组成部分。铁是RBC的重要组成成分,铁的缺乏会引起机体RBC数量的下降,吞噬细胞活性受损,使免疫力下降等症状[19]。本试验结果显示,高棉籽粕饲料能使青鱼血液RBC数量显著下降,与 Blom 等[6]等对虹鳟和 Yildirim 等[20]对斑点叉尾 的研究结果相似,但在高棉籽粕饲料中补充铁后青鱼血液中RBC数量有所增加,与Rojas 等[21]、Wedegaertner[22]、Jones[23]和 Martin[24]的研究结果相同,高棉籽粕饲料降低血液RBC数量可能与棉籽粕中游离棉酚在肠道内与铁结合,降低铁的吸收利用有关,补充铁后可缓解由于游离棉酚结合铁而引起RBC数量降低症状[25]。
C4和LZM是重要的非特异性免疫指标,棉籽粕替代豆粕后使青鱼血清LZM活力和C4含量显著下降,与本实验室前期研究结果一致[11],而在高棉籽粕饲料中同时补充赖氨酸和铁可显著提高血清LZM活力和C4含量,可能与补充的铁和赖氨酸与游离棉酚结合形成无毒的结合棉酚,降低了游离棉酚对机体的毒性作用有关。
GOT和GPT是反映肝功能的重要指标,当组织中毒、发生病变或者受损伤后,大量的GOT和GPT从细胞进入血液中,使血清中这2种酶的活力升高。本试验结果表明,棉籽粕替代豆粕后使青鱼血清GOT和GPT活力显著升高,可能与高棉籽粕饲料中游离棉酚使肝功能受损有关,与本实验前期研究结果一致[11]。同时,与高棉籽粕饲料组相比,高棉籽粕饲料中补充赖氨酸和铁后显著降低了青鱼血清GOT和GPT活力,说明高棉籽粕饲料中补充赖氨酸和铁可以有效降低棉籽粕中游离棉酚的毒性,改善肝功能,与Braham等[25]等在小鼠(Mus musculus)上的研究结果相同。
3.3 高棉籽粕饲料中补充赖氨酸和铁对青鱼幼鱼组织中游离棉酚含量的影响
肝脏是游离棉酚累积的主要器官[14,26]。本研究结果表明,高棉籽粕饲料中补充铁可使肌肉和肝脏中游离棉酚的含量显著降低,与在尼罗罗非鱼[9]、斑点叉尾[13]上得出的结果相似,可能与高棉籽粕饲料中补充的铁和游离棉酚结合有关[15-16]。
此外,本试验结果还表明,棉籽粕替代豆粕后使鱼体粗脂肪含量升高,粗蛋白质含量下降,而补充铁和赖氨酸后鱼体粗脂肪含量下降,粗蛋白质含量升高,这可能与高棉籽粕饲料中的游离棉酚降低饲料中铁和赖氨酸的利用,从而影响了机体的脂肪代谢和蛋白质代谢有关。
4 结论
高棉籽粕饲料中同时补充赖氨酸和铁能促进青鱼生长,提高机体免疫力,降低肌肉和肝脏中游离棉酚含量,降低对肝脏的损伤,可有效提高饲料中棉籽粕的使用量。
[1] DABROWSKI K,RINCHARD J,LEE K J,et al.Effects of diets containing gossypol on reproductive capacity of rainbow trout(Oncorhynchus mykiss)[J].Biology of Reproduction,2000,62:227-234.
[2] CHENG Z J,HARDY R W.Apparent digestibility coefficients and nutritional value of cottonseed meal for rainbow trout(Oncorhynchus mykiss)[J].Aquaculture,2002,212:361-372.
[3] RAWLES SD,GATLIN D M.Nutrient digestibility of common feedstuffs in extruded diets for sunshine bass,Morone chrysops♀×M.saxatilis [J].Journal of the World Aquaculture Society,2000,31:570-579.
[4] DORSA W J,ROBINETTE H R,ROBINSON E H,et al.Effects of dietary cottonseed meal and gossypol on growth of young channel catfish[J].Transaction of the American Fisheries Society,1982,111:651-655.
[5] COLIN-NEGRETE J,KIESLING H E,ROSS T T,et al.Effect of whole cottonseed on serum constituents,fragility of erythrocyte cells,and reproduction of growing Holstein heifers[J].Journal of Dairy Science,1996,79:2016-2023.
[6] BLOM J H,LEE K J,RINCHARD J,et al.Reproductive efficiency and maternal-offspring transfer of gossypol in rainbow trout(Oncorhynchus mykiss)fed diets containing cottonseed meal[J].Journal of Animal Science,2001,79:1533-1539.
[7] HERMAN R L.Effects of gossypol on rainbow trout Salmo guirdneri Richardson[J].Journal of Fish Biology,1970,2:293-303.
[8] HU Y,HUANG Y,FENG F X,et al.Effect of soybean meal replacement by cottonseed meal on growth,feed utilization and some blood physiological/biochemical indices of juvenile black carp,Mylopharyngodon piceus[J].Aquaculture Research,2014,doi:10.1111/are.12409.
[9] BARROS M M,LIM C,KLESIUSP H.Effect of soybean meal replacement by cottonseed meal and iron supplementation on growth,immune response and resistance of Channel Catfish(Ictalurus puctatus)to Edwardsiella ictaluri challenge[J].Aquaculture,2002,207:263-279.
[10] AOAC.Official methods of analysis of AOAC International[S].16th ed.Arlington,VA:AOAC International,1995.
[11] HU Y,HUANG Y,FENG F X,et al.Effect of soybean meal replacement by cottonseed meal on growth,feed utilization and some blood physiological/biochemical indices of juvenile black carp,Mylopharyngodon piceus[J].Aquaculture Research,2014.
[12] EI-SAIDY D M S D,SAAD A S.Effects of partial and complete replacement of soybean meal with cottonseed meal on growth,feed utilization and haematological indexes for mono-sex male Nile tilapia,Oreochromis niloticus(L.)fingerlings[J].Aquaculture Research,2011,42(3):351-359.
[13] LIM S J,LEE K J.Supplemental iron and phosphorus increase dietary inclusion of cottonseed and soybean meal in olive flounder(Paralichthys olivaceus)[J].Aquaculture Nutrition,2008,14(5):423-430.
[14] EI-SAIDY D M SD,GABER M M.Use of cottonseed meal supplemented with iron for detoxification of gossypol as a total replacement of fish meal in Nile tilapia,Oreochromis niloticus(L.)diets[J].Aquaculture Research,2004,35:859-865.
[15] LEE K J,DABROWSKI K.Gossypol and gossypolone enantiomers in tissues of rainbow trout fed low and high levels of dietary cottonseed meal[J].Journal of Agricultural and Food Chemical,2002,50(10):3056- 3061.
[16] ROBINSON E H.Improvement of cottonseed meal protein with supplemental lysine in feeds for channel catfish[J].Journal of Applied Aquaculture,1991,1(2):1-14.
[17] ROBINSON E H,LI M H.Use of plant proteins in catfish feeds:replacement of soybean meal with cottonseed meal and replacement of fish meal with soybean meal and cottonseed meal[J].Journal of the World Aquaculture Society,1994,25:271-276.
[18] LEE K J,RINCHARD J,DABROWSKI K,et al.Long-term effects of dietary cottonseed meal on growth and reproductive performance of rainbow trout:three-year study[J].Animal Feed Science and Technology,2006,126:93-106.
[19] WATANABE T,KIRON V,SATOH S.Trace minerals in fish nutrition[J].Aquaculture,1997,151(1/2/3/4):185-207.
[20] YILDIRIM M,LIM C,WAN P J,et al.Growth performance and immune response of channel catfish(Ictalurus punctatus)fed diets containing graded levels of gossypol-acetic acid[J].Aquaculture,2003,219:751-768.
[21] ROJAS S W,SCOTT M L.Factor affecting the nutritive value of cottonseed meal as protein source in chick diets[J].Poultry Science,1969,48:819-835.
[22] WEDEGAERTNER T C.Making the most of cottonseed meal[J].Feed Management Magazine,1981,32:1-3.
[23] JONES L A.Recent advances in using cottonseed products[C]//Processing of the Florida Nutrition Conference.Daytona Beach,FL:[s.n.],1987:119-138.
[24] MARTIN S D.Gossypol effects in animal feeding can be controlled[J].Feedstuffs,1990,62:14-17.
[25] BRAHAM J E,BRESSANI R.Effect of different levels of gossypol on transaminase activity,on nonessential to essential amino acid ratio,and on iron and nitrogen retention in rats[J].The Journal of Nutrition,1975,105(3):348-355.
[26] GAMBOA D A,CALHOUN M C,KUHLMANN S W,et al.Tissue distribution of gossypol enantiomers in broilers fed various cottonseed meals[J].Poultry Science,2001,80:920-925.
——全棉籽的加工与利用

