陈香茶菌及枯草芽孢杆菌复合发酵豆粕的研究
姚勇芳 赵祥杰 廖延智 陈小凤 李平凡*
(1.广东轻工职业技术学院食品系,广州 510300;2.广东省农业科学院蚕业与农产品加工研究所,广州 510610;3.韶关市粤凰生态科技有限公司,韶关 512026)
蛋白质原料是饲料工业发展的基础,我国蛋白质原料的紧缺和价格高涨已经成为发展畜牧业和水产业的瓶颈之一。对饲料蛋白质进行体外消化,提供易消化、高吸收、高利用的蛋白质原料是未来提高蛋白质利用率和降低饲料成本的必然选择。发酵豆粕作为植物蛋白质源和微生物蛋白质源的交叉部分,兼有2种蛋白质源的优势,正成为关注的热点,优良的发酵豆粕具有以下优点[1]:1)提高了豆粕蛋白质的溶解度,利于消化;2)减小了豆粕蛋白质的分子质量,其中的一部分已达到小肽水平甚至氨基酸水平,可以直接被动物吸收;3)具有一定的芳香气味和鲜味,适口性较好。菌种的优良与否是成功生产生物蛋白质饲料的关键。发酵豆粕常用的菌种有霉菌、酵母菌、枯草菌、乳酸菌等。单一菌种的作用效果不稳定,目前市场主要是多种菌纯培养物之间混合发酵,但存在兼容性不一定协调问题,因此,优良的发酵菌种和适宜的发酵条件还有待进一步研究和摸索。
陈香茶是指鲜叶经杀青、揉捻、晒干(烘干)后经长时间自然发酵或毛茶经渥堆而加工成的茶类。渥堆过程中,乳酸菌的数量不断增加[2]。酵母菌类主要是产酒精和产酯等生香酵母,如鲁氏酵母(Zygosaccharomyces rouxii)、酿酒酵母(Saccharomyces cerevisiae)、酒香酵母属(Brettanomyces sp)、假丝酵母属(Candida rkhout)等。陈香茶在后期发酵很复杂,由于茶中的蛋白质含量少,使得有害菌很难生存,大多数是有益菌,同时,茶叶中的多酚类物质会抑制有害菌的生长,陈香茶的安全性很高。枯草芽孢杆菌(Bacillus subtilis)是我国农业部允许作为饲料添加剂的2种芽孢杆菌之一,具有很强的蛋白酶、脂肪酶、淀粉酶等活性,能产生抗菌素,在动物肠道内具有较强生物夺氧能力,这些特性对促进动物营养的消化吸收、提高动物的饲料转化率、防病及促进生长起到重要作用[3]。本试验通过陈香茶自然发酵成熟过程中形成良好补强性的曲种,在枯草芽孢杆菌协同下,进行豆粕发酵研究,为陈香茶菌发酵饲料工业化生产起基础研究作用。
1 材料与方法
1.1 试验材料与仪器
1.1.1 原料
陈香茶购自广东省农业科学院植物研究所;糖蜜、豆粕、麸皮自市场购买;枯草芽孢杆菌由广东高校特色调味品工程技术开发中心提供。
1.1.2 培养基
马铃薯葡萄糖培养基:马铃薯削皮切片→称100 g于500 mL烧杯中→加入500 g水→加热煮沸30 min→8层纱布过滤→10 g葡萄糖→加水定容至500 mL,121℃灭菌15 min,备用。
液体培养基(用于枯草芽孢杆菌培养):1%蛋白胨,0.5%NaCl,0.5% 酵 母 粉,121 ℃ 灭 菌15 min,备用。
1.1.3 试剂
氢氧化钠、盐酸、pH计校正缓冲溶液、甲醛溶液、硼酸、葡萄糖标准溶液、氧化镁、无水硫酸铜、硫酸钾、浓硫酸、三氯乙酸,以上试剂均为分析纯。
1.1.4 仪器
YX系列手提式压力蒸汽灭菌锅,上海涵今仪器仪表公司;电子天平,上海涵今仪器仪表公司;PHB-3便携式pH计,安徽赛科环保科技有限公司;超净工作台,苏州苏洁净设备公司;HPX-9162MBE数显电热培养箱,上海楚柏实验室设备有限公司;恒温摇床,常州冠军仪器制造有限公司;离心机,上海化工机械厂;电热恒温水浴锅,天津市泰斯特仪器有限公司。
1.2 试验方法
1.2.1 试验流程
陈香茶粉→马铃薯葡萄糖培养基→培养条件研究→陈香茶菌培养液+枯草芽孢杆菌发酵液→豆粕固态发酵条件研究。
1.2.2 陈香茶培养条件对固态发酵的影响研究
1.2.2.1 转速对陈香茶菌培养的影响
称取0.2 g陈香茶粉分别接入5瓶装有100 mL马铃薯葡萄糖培养基三角瓶中,胶塞封口。摇床转速分别为 0、50、100、150、200 r/min,37 ℃培养24 h。
分别取10%培养液+2%糖蜜+23%水+65%豆粕,28℃固态发酵培养3 d。以酸溶性蛋白含量为指标,选取最优转速。
1.2.2.2 温度对陈香茶菌培养的影响
称取0.2 g陈香茶粉分别接入4瓶装有100 mL马铃薯葡萄糖培养基三角瓶中,胶塞封口。温度分别为 24、28、32、37 ℃。静置培养 24 h。
固态发酵同 1.2.2.1,以酸溶性蛋白含量为指标,选取最适培养温度。
1.2.2.3 添加量对陈香茶菌培养的影响
分别称取 0.2、0.5、0.8、1.1 g 陈香茶粉接入 4瓶装有100 mL马铃薯葡萄糖培养基三角瓶中,胶塞封口。28℃静置培养24 h。
固态发酵同 1.2.2.1,以酸溶性蛋白含量为指标,选取最适陈香茶粉添加量。
1.2.2.4 时间对陈香茶菌培养的影响
称取0.5 g陈香茶粉分别接入5瓶装有100 mL马铃薯葡萄糖培养基三角瓶中,胶塞封口。分别 28 ℃静置培养 16、20、24、28、32 h。
固态发酵同 1.2.2.1,以酸溶性蛋白含量为指标,选取最适时间。
1.2.3 豆粕固态发酵条件研究
1.2.3.1 固态发酵条件关键因素的确定
1.2.3.1.1 糖蜜与麸皮对陈香茶菌豆粕发酵效果的对比研究 称取0.5 g陈香茶粉分别接入5瓶装有100 mL马铃薯葡萄糖培养基三角瓶中,胶塞封口。37℃静置培养24 h。
1)取10%培养液+4%糖蜜+21%水+65%豆粕;2)取10%培养液+4%麸皮+31%水+65%豆粕。28℃固态发酵分别培养3 d。测定酸溶性蛋白、氨基酸态氮含量及pH。
1.2.3.1.2 枯草芽孢杆菌添加对陈香茶菌豆粕发酵影响的研究 称取0.5 g陈香茶粉分别接入5瓶装有100 mL马铃薯葡萄糖培养基三角瓶中,胶塞封口。28℃静置培养24 h。
1)取10%陈香茶菌培养液+10%枯草芽孢杆菌发酵液(取新制枯草芽孢杆菌斜面2环于100 mL液体培养基中,37℃,24 h)+6%糖蜜+9%水+65%豆粕;2)取10%陈香茶菌培养液+6%糖蜜+19%水+65%豆粕,28℃固态发酵分别培养3 d。测定酸溶性蛋白、氨基酸态氮含量及pH。
1.2.3.2 固态发酵正交试验研究
按照陈香茶菌培养液量、枯草芽孢杆菌发酵液量、糖蜜量、培养温度,设计4因素3水平试验(表 1),豆粕含量为 55%,添加水分,总量为100%,进行固态发酵3 d,测定酸溶性蛋白含量, 确定最适发酵因素条件。

表1 正交试验设计Table 1 The orthogonal experimental design
1.2.3.3 豆粕最适固态发酵时间研究
称取0.5 g陈香茶粉分别接入5瓶装有100 mL马铃薯葡萄糖培养基三角瓶中,胶塞封口。28℃静置培养24 h。
利用 1.2.3.2 优化固态发酵条件,分别培养 3、4、5、6 d。以酸溶性蛋白、氨基酸态氮含量及 pH为指标,选取最适发酵天数。
1.2.4 指标测定
1.2.4.1 酸溶性蛋白含量的测定
称取 1.5 g样品(精确至 0.000 1 g)至离心管中,加入15 mL 15%三氯乙酸溶液,混合均匀,再加入5 mL 15%三氯乙酸溶液,静置沉降5 min(静置前先进行离心平衡)后转到离心管中,在4 000 r/min下离心10 min,取上清液并转到50 mL比色管中定容。取10 mL该溶液进行消化,按凯氏定氮法测定酸溶性蛋白含量[4]。
1.2.4.2 氨基酸态氮含量的测定
精确称量5 g左右的样品,加入45 mL水溶解后在磁力搅拌器上搅拌20 min,过滤后取5 mL滤液于250 mL烧杯中,加入 150 mL蒸馏水与10 mL甲醛,在磁力搅拌器的搅拌下,用0.05 mol/L氢氧化钠溶液滴定至 pH 9.2。按魏炳栋等[5]方法计算氨基酸态氮含量。
1.2.4.3 pH 测定
精确称量5 g左右的样品,加入45 mL水溶解后在磁力搅拌器上搅拌20 min,过滤后用酸度计直接测定溶液的pH。
2 结果
2.1 陈香茶菌培养条件对豆粕发酵影响的研究
2.1.1 陈香茶菌培养转速对豆粕发酵影响
由图1可知,在摇床0~200 r/min内,酸溶性蛋白含量随着转速的增加而降低,当转速为0 r/min,即静置培养时,酸溶性蛋白含量达到最高,为 5.37%。
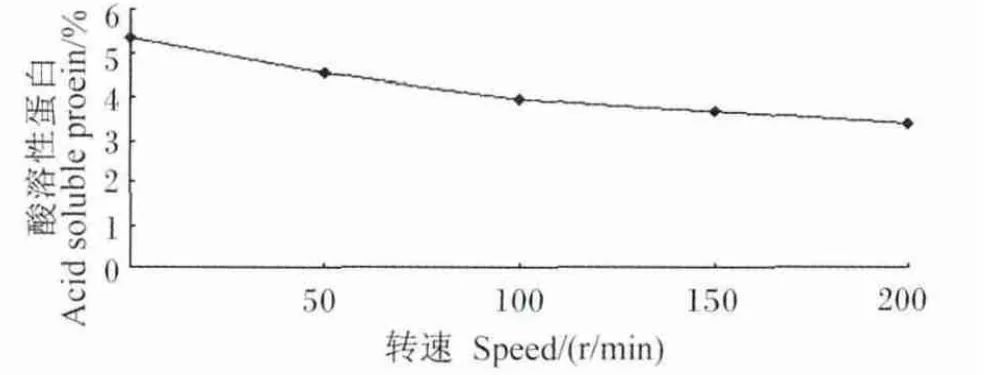
图1 陈香茶菌培养转速对豆粕发酵影响Fig.1 Effects of culture speed of the complex flora from crusted tea on fermentation of soybean meal
2.1.2 陈香茶菌培养温度对豆粕发酵影响
由图2可知,陈香茶菌在28℃下培养效果最好,酸溶性蛋白含量达到5.91%。

图2 陈香茶菌培养温度对豆粕发酵影响Fig.2 Effects of culture temperature of the complex flora from crusted tea on fermentation of soybean meal
2.1.3 陈香茶菌培养添加量对豆粕发酵影响
由图3可知,添加0.5 g陈香茶菌于葡萄糖马铃薯培养基中培养,得到的陈香茶菌培养液与枯草芽孢杆菌发酵液联合发酵豆粕,酸溶性蛋白含量最高达到6.27%。

图3 陈香茶菌培养添加量对豆粕发酵影响Fig.3 Effects of culture adding quantity of the complex flora from crusted tea on fermentation of soybean meal
2.1.4 陈香茶菌培养时间对豆粕发酵影响
由图4可知,陈香茶菌在24 h培养后进行豆粕固态发酵,酸溶性蛋白含量为 6.29%,效果最好。

图4 陈香茶菌培养时间对豆粕发酵影响Fig.4 Effects of culture time of the complex flora from crusted tea on fermentation of soybean meal
2.2 豆粕固态发酵条件研究
2.2.1 固态发酵条件关键因素的确定
2.2.1.1 糖蜜与麸皮对豆粕发酵效果的对比
由图5可知,陈香茶菌培养液分别接种糖蜜固态发酵培养基与麸皮发酵培养基固态发酵,培养3 d,含糖蜜培养基发酵酸溶性蛋白含量为7.28%,氨基酸态氮含量为 1.43%,pH 为 5.09,发酵效果优于含麸皮固态发酵培养基。
2.2.1.2 枯草芽孢杆菌添加对陈香茶菌豆粕发酵效果影响研究
由图6可知,固态发酵阶段,添加枯草芽孢杆菌液组(10%)较对照组(0)理想,酸溶性蛋白含量达到7.54%,提高了1.36%;氨基酸态氮含量达到2.76%,pH 为 4.06,说明产生酸性物质较对照多。

图5 糖蜜与麸皮对豆粕发酵效果的对比Fig.5 Comparison of fermentation effects of molasses and bran on soybean meal

图6 枯草芽孢杆菌对陈香茶菌豆粕发酵效果的影响Fig.6 Effects of Bacillus subtilis on soybean meal fermented by the complex flora from crusted tea
2.2.2 固态发酵正交试验研究
由表2和图7可知,影响因素的主次为:C(糖蜜)>D(温度)>B(陈香茶菌培养液)>A(枯草芽孢杆菌发酵液);对表2的结果进行分析,得到优化组合为:A2B1C3D3,即枯草芽孢杆菌发酵液10%,陈香茶菌发酵液 10%,糖蜜 10%,温度37℃,即豆粕固态发酵为:枯草芽孢杆菌发酵液10%+陈香茶菌培养液10%+糖蜜10%+水10%+豆粕55%,在37℃无氧条件下培养3 d。
2.2.3 豆粕最适固态发酵时间研究
由图8可知,随着发酵天数的延长,发酵豆粕的酸溶性蛋白含量逐渐增加,由发酵第3天的7.82%到第6天的8.85%,酸溶性蛋白含量提升了1.03%;氨基酸态氮含量和pH随着发酵时间的延长有明显的变化,pH降低1.11,氨基酸态氮含量提高 0.87%。

表2 正交试验结果Table 2 The result of orthogonal experiment

图7 因素与指标间的关系示意图Fig.7 Schematic diagram of the relationship between factors and index
3 讨论
3.1 陈香茶菌培养条件对豆粕发酵影响
目前市场发酵饲料以固态厌氧发酵的方式进行,相对于好氧发酵,厌氧发酵的能耗低,微生物代谢产生的热量小,生产过程不需要翻拌散热。另外,发酵产品只要密封得当,即使长期存放也不会腐败变质。生产菌种常以乳酸菌、芽孢杆菌和酵母菌为主。普遍认为,发酵豆粕菌种使用,单菌不如多菌,纯培养(多菌种的纯培养物之间的相容性不一定协调)不如曲种(曲种中的微生物是天然组合的,相互之间互补性强)[6]。陈香茶中陈香菌群主要包括霉菌类(黑曲霉、灰绿曲霉等)、酵母类、细菌类(乳酸菌等),其中酵母菌为兼性厌氧菌,乳酸菌为需氧和兼性厌氧菌,其他为耗氧菌。通过陈香茶菌不同培养方式,改变菌项关系,再通过密闭式生料豆粕固态发酵,培养基内氧气被需氧菌逐渐消耗完后,酵母菌及乳酸菌转为优势菌[7]。
酸溶性蛋白是较低分子质量的蛋白质水解物,包括小肽和游离氨基酸,因可以溶于酸性溶液而得名。以酸溶性蛋白为检测指标,能够很真实地反映豆粕经微生物降解的情况,具有实际意义。Agar等[8]研究表明,肠道能完整地吸收转运双甘肽。Chung等[9]证实了肽可以被完整转运吸收的观点。Fei等[10]克隆了小肽载体,证明了寡肽尤其是小肽可不被消化成游离氨基酸,而是直接以肽的形式由载体转运进入体循环。Hara等[11]试验结果表明,蛋白质在消化道中的消化终产物往往大部分是小肽而不是游离氨基酸。当转速为0 r/min,即静置培养时,培养液溶氧量最少,不适于陈香茶需氧菌生长,通过培养液固态发酵豆粕,酸溶性蛋白含量达到5.37%。

图8 豆粕最适固态发酵时间Fig.8 The optimal time of solid state fermentation of soybean meal
陈香茶菌群培养温度28℃左右时,适合陈香茶真菌(霉菌、酵母菌)生长,霉菌需氧生长,繁殖速度较慢,有利于酵母菌增殖。陈香茶培养液固态发酵豆粕过程中,酵母菌进行糖酵解,产生一些代谢活性物质,促进乳酸菌在后期的繁殖[12]。发酵过程中pH的变化会影响到微生物多样性的变化,通过影响微生物群落结构的变化最终影响发酵产物的分布,进而影响到发酵品质。因此发酵豆粕有机酸含量和pH能够直观地反映发酵饲料的品质,其中乳酸含量越高,乙酸、丙酸和丁酸含量越低,发酵品质越好。pH一方面可反映发酵的进程,并对发酵过程产生重要的影响;另一方面使用pH低的饲料配制饲粮也可促进饲粮酸化,饲粮酸化可改善饲粮品质,可提高饲粮适口性和消化率,饲粮中的酸能直接刺激口腔内的味蕾细胞,使唾液分泌增多而增进食欲,而且有机酸具有独特的芳香,可掩盖饲料中的不适气味。这一点对断奶仔猪尤为重要[13]。利用28℃培养陈香茶培养液进行豆粕固态发酵,酸溶性蛋白含量较高,产生的发酵豆粕带有酸香味。陈香茶菌培养过程中,在有限氧气和营养条件下,低于0.5 g茶粉添加量,其菌体增殖整体数量较少;高于0.5 g茶粉添加量,因菌群中微生物对营养物质的利用能力不同,菌体数量过多造成营养物质无规律消耗,固态发酵酸溶性蛋白含量反而出现降低。陈香茶菌群16~24 h培养过程中,随着氧气逐渐消耗,需氧菌生长受限,酵母菌及乳酸菌成为优势菌,协同增殖。24~32 h培养过程中,养料逐渐消耗,pH逐渐上升,酵母菌出现自溶,乳酸菌抑制生长,导致培养液进行豆粕固态发酵,酸溶性蛋白含量降低。
3.2 固态发酵条件关键因素的确定
麸皮主要是由粗纤维和淀粉类等大分子物质组成,难被酵母和乳酸菌直接利用;糖蜜含有大量可溶性糖(主要是蔗糖),是制糖业的副产品之一,含有众多微量元素和维生素,成本低廉,为理想的发酵辅料[14]。酵母菌在有氧条件下消耗氧气,在厌氧条件下进行糖酵解,产生酒精和有机酸。主要利用饲料中的单糖和双糖,基本不能利用淀粉和纤维素类多糖。乳酸菌基本上是厌氧菌,单糖和双糖是其能量来源,可以把六碳糖转化成乳酸和乙酸等有机酸。
枯草芽孢杆菌生长能力较强,可产淀粉酶、蛋白酶、脂肪酶、纤维素酶等活性较高的酶;在饲料干燥过程中产生芽孢,存活率较高;同时能产生抗菌素,在动物肠道内具有较强生物夺氧能力。这些特性对促进动物营养的消化吸收、提高动物的饲料转化率、防病及促进生长起到重要作用[15-16]。在发酵过程中,芽孢杆菌消耗氧气为乳酸菌创造厌氧环境,发酵环境很快处于厌氧状态,霉菌及耗氧细菌无法生长,而此时酵母菌、乳酸菌代谢能力加强。但是当发酵体系中氧气过多时会引起发酵产品产生很重的氨味,从而影响饲料适口性和可消耗化性能,同时也浪费蛋白质资源,因此,在发酵过程中,控制密闭环境的间隙度十分重要。
3.3 豆粕固态发酵条件研究
固态发酵阶段需氧菌利用有限氧气生长,枯草芽孢杆菌夺氧强,密闭条件下,加快处于厌氧状态,霉菌及耗氧细菌无法生长,而此时酵母菌、乳酸菌代谢加强。在酶参与下,厌氧菌代谢降低抗营养因子含量,提高有机酸及酸溶性蛋白含量,形成优质发酵豆粕。
陈香茶菌培养液接种量在10%左右时,发酵产品中酸溶性蛋白含量最高。接种量太小,菌体需要较长时间才能大量生长;接种量太大,造成基质中含水量增加,影响豆粕颗粒之间存在的合适疏松度,不利于有限氧的溶入和CO2的排出,抑制微生物菌体生长,从而使发酵产品中酸溶性蛋白含量降低。
糖蜜含量为10%时,酸溶性蛋白含量最高,有较淡的醇香味。过多或过少糖蜜含量可能会改变碳氮比(C/N),影响发酵品质。微生物生长要经过停滞期、对数生长期、稳定期和衰退期4个阶段。不同的微生物对原料的利用情况和分解速度不同,对于较容易利用的原料,微生物可以很快经过停滞期而进入生长繁殖期,即停滞期较短;而对于一些较难分解利用的原料(如纤维素等结构复杂的碳水化合物),微生物的停滞期会相应延长。发酵原料中含有较大比例糖蜜等含糖量高的农副产品时,乳酸菌就能顺利完成发酵,产生大量有机酸[17]。
豆粕发酵3~6 d能够都能满足市场要求[18]。正交试验涉及菌种主要有乳酸菌、芽孢杆菌和酵母菌。3种菌对温度的敏感性和最适生长温度有所不同,其中乳酸菌主要对碳水化合物进行发酵产生乳酸,对发酵品质有重要的影响,在20~43℃均可生长,但大多数乳酸菌发酵的适宜温度是30~40℃。酵母菌和芽孢杆菌属于需氧菌,可通过其繁殖为乳酸菌的发酵创造有利条件。
4 结 论
①陈香茶菌适宜培养条件为:称取0.5 g陈香茶粉接入装有100 mL马铃薯葡萄糖培养基三角瓶中,28℃静置培养24 h。
②豆粕固态发酵最佳工艺为:10%枯草芽孢杆菌培养液+10%陈香茶菌培养液+10%糖蜜+10%水+55%豆粕,在37℃密闭条件下培养3~6 d。
[1] 马文强,冯杰,刘欣.微生物发酵豆粕营养特性研究[J].中国粮油时报,2008,23(1):121-124.
[2] 雷晓燕.普洱茶中主要微生物的研究[J].沈阳化工学院学报,2009,23(2):134-137.
[3] 陆熹,李霞,仲小兰,等.微生物发酵在我国饲料工业中的应用及发展探讨[J].现代科技农业,2008,42(1):156-160.
[4] 吴胜华,李吕木,张邦辉,等.多菌种固态发酵豆粕生产小肽饲料[J].食品与发酵工业,2008,34(10):113-115.
[5] 魏炳栋,陈群,刘海燕,等.乳酸菌固态发酵对豆粕蛋白质含量、体外消化率及游离氨基酸含量的影响[J].饲料博览:技术版,2010,42(3):3-5.
[6] HU J K,LU W Q,WANG C L,et al.Characteristics of solid-state fermented feed and its effects on performance and nutrient digestibility in growing-finishing pigs[J].Asian-Australasian Journal of Animal Sciences,2008,21(11):1635-1641.
[7] 周静,肖嫩群.酵母菌与乳酸菌混合培养条件研究[J].安徽农业科学,2011,39(15):8824-8825.
[8] AGAR W T,HIRD F JR,SIDHU G S.The active absorption of amino acids by the intestine[J].The Journal of Physiology,1953,121(2):255-263.
[9] CHUNG SY,SWAISGOOD H E,CATIGNANI G L.Effects of alkali treatment and treatment in the prence of fructose on digestibility of food proteins asdetermined by and immobilized digestive enzyme assay(IDEA)[J].Journal of Agricultural and Food Chemistry,1986,34(3):579-584.
[10] FEI Y J,KANAI Y,NUSSBERGER S,et al.Expression cloning of a mammalian proton-coupled oligopeptide transporter[J].Nature,1994,368(6471):563 -566.
[11] HARA H,FUNABIKI R,IWATA M,et al.Portal absorption of small peptides in rats under unrestrained conditions[J].The Journal of Nutrition,1984,114(6):1122-1129.
[12] 贺月林,郭照辉,谭周进,等.酵母菌与乳酸菌混合培养中试研究[J].现代农业科技,2010,20(2):29-31.
[13] GABERT V M,SAUER W C,SCHMITZ M,et al.The effect of formic acid and buffering capacity on the ileal digestibilities of amino acids and bacterial populations and metabolites in the small intestine of weanling pigs fed semipurified fish meal diets[J].Canadian Journal of Animal Science,1995,75(4):615-623.
[14] BRODERICK G A,RADLOFF W J.Effect of molasses supplementation on the production of lactating dairy cows fed diets based on alfalfa and corn silage[J].Journal of Dairy Science,2004,87(9):2997-3009.
[15] 周伏忠,贾藴丽,陈国参,等.豆粕发酵适宜菌株筛选及其发酵技术研究[J].河南科学,2007,25(3):409-412.
[16] 莫重文,黄岗.固态发酵法生产发酵豆粕的研究[J].中国油脂,2007,32(7):38-40.
[17] 陆文清.发酵饲料生产与应用技术[M].北京:中国轻工业出版社,2011:99-100.
[18] 王金斌,马海乐,段玉清,等.混菌固态发酵豆粕生产优质高蛋白饲料研究[J].中国粮油学报,2011,24(2):120-124.

