饲粮铜水平对冬毛期银狐铜表观生物学利用率及组织器官铜沉积量的影响
钟 伟 鲍 坤 张 婷 刘凤华 杨雅涵 张海华 李光玉
(中国农业科学院特产研究所,吉林省特种经济动物分子生物学省部共建实验室,长春 130112)
铜在促进毛皮动物生长和毛色沉积方面发挥着重要作用,是毛皮动物生长必需的微量元素之一[1-2]。高铜能促进仔猪的快速增长,然而高铜在促进毛皮动物生长方面不及猪明显。吴学壮等[3]研究报道,添加30 mg/kg硫酸铜组比添加高水平铜组水貂的生长更快。Zhong等[4]研究报道,添加高水平柠檬酸铜组银狐的生长性能与低水平柠檬酸铜组差异不显著,添加30 mg/kg柠檬酸铜组银狐的毛皮性能较佳。在仔猪养殖生产中,在研究高铜对生产带来巨大效益的同时,开始关注高铜对猪组织器官铜沉积量增加引起的肉品质的安全隐患及高铜排泄对环境、土壤的严重污染等带来的负面效应。大量研究表明,高铜增加了生长猪组织中铜的沉积量[5-6],增加了粪铜排出量[7],同时高铜导致了组织器官的一些病变[8]。李宏等[9]研究报道,高铜增加了毛兔肝铜的沉积量并增加了粪铜和尿铜的排出量。然而在银狐上尚无相关研究报道,因此,本试验旨在研究饲粮铜水平对银狐铜表观生物学利用率及组织器官铜沉积量的影响,进而为银狐养殖生产中适宜的铜添加水平提供理论数据参考。
1 材料与方法
1.1 试验饲粮与试验设计
基础饲粮配制参考NRC(1982)[10]狐貂营养需求标准,其组成及营养水平见表1。各组分别在基础饲粮中添加6(Ⅰ组)、30(Ⅱ组)、60(Ⅲ组)、90(Ⅳ组)和150 mg/kg(Ⅴ组)的柠檬酸铜配制5组铜饲粮,5组饲粮中的铜含量分别近似是11、35、65、95和155 mg/kg。柠檬酸铜是有机形式,铜含量≥34%,购自上海华亭化工厂有限公司。

表1 基础饲粮组成及营养水平(风干基础)Table 1 Composition and nutrient levels of the basal diet(air-dry basis) %
1.2 试验动物与饲养管理
试验选取50只120日龄、平均体重为(5 134±540)g的健康雌性银狐,随机分成5组,每组设10个重复,每个重复1只银狐。试验在中国农业科学院特产研究所毛皮动物实验基地完成。试验动物单笼饲养。试验从2011年10月15日开始至2011年12月13日结束,预试期7 d,正试期51 d,每天早、晚各饲喂1次,自由饮水。
1.3 消化代谢试验
预试期每天准确称量、记录饲喂量和剩余料量,计算采食量,观察动物健康和采食状况。试验开始第30天后,于2011年11月15—18日进行消化代谢试验,每组选择8只采食和排便正常、体况接近的银狐进行消化代谢试验。消化代谢试验共进行4 d,利用自制的粪盘进行全粪收集,65℃烘干,粉碎后过40目筛保存用于粪样中铜含量测定。
1.4 样品采集
银狐取皮后,剪下尾部的部分毛样产品;从取皮后的银狐屠体中摘取肝脏、心脏和肾脏存于-20℃冰箱,用于毛铜及组织铜含量的检测分析。
1.5 测定指标及方法
基础饲粮、粪样、毛样及组织中铜含量采用奥地利安东帕Mlultiwave 3000微波消解仪进行前处理,利用德国耶拿Nov AA 400原子吸收光谱仪火焰法测定。
1.6 计算公式

1.7 数据整理与统计分析
试验数据采用Excel 2003进行整理,结果以平均值±标准差表示。采用SAS 8.0软件中GLM程序对数据进行统计分析,多重比较采用Duncan氏法,其中 P<0.01 为差异极显著,P<0.05 为差异显著,P>0.05 为差异不显著。
2 结果
2.1 饲粮铜水平对冬毛期银狐铜表观生物学利用率的影响
由表2可知,饲粮铜水平对银狐平均日采食量和粪排出量均无显著影响(P>0.05)。饲粮铜水平对银狐铜摄入量有极显著影响(P<0.01),随着饲粮铜水平的增加,铜摄入量极显著升高(P<0.01),Ⅴ组最高;粪铜排出量变化趋势与铜摄入量相同,随着饲粮铜水平的增加,粪铜排出量极显著升高(P<0.01),Ⅴ组最高。饲粮铜水平对铜表观生物学利用率无显著影响(P>0.05)。
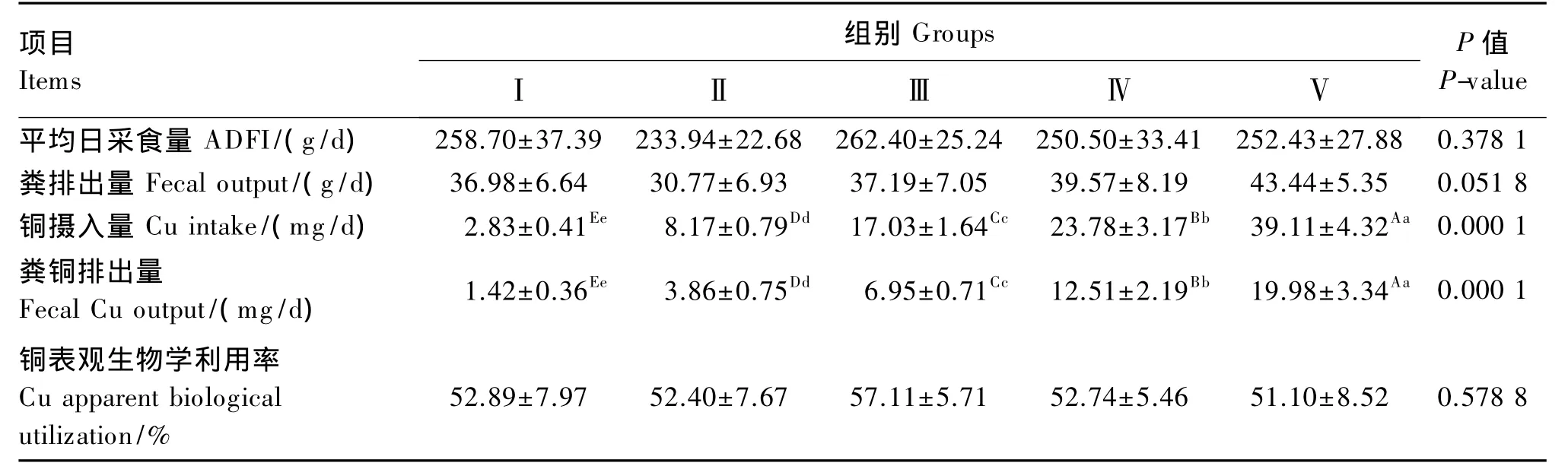
表2 饲粮铜水平对冬毛期银狐铜表观生物学利用率的影响Table 2 Effects of dietary copper level on copper apparent biological utilization of silver foxes during the winter hair period
2.2 饲粮铜水平对冬毛期银狐组织器官铜沉积量的影响
由表3可知,饲粮铜水平对银狐毛铜沉积量有极显著影响(P<0.01),高铜组(Ⅴ组)毛铜沉积量最高,然后依次是Ⅲ组、Ⅳ组、Ⅰ组和Ⅱ组。饲粮铜水平对肝铜沉积量有极显著影响(P<0.01),Ⅱ、Ⅳ组肝铜沉积量极显著高于Ⅰ、Ⅲ组(P<0.01),但与Ⅴ组均差异不显著(P>0.05),Ⅰ、Ⅲ组之间差异不显著(P>0.05),Ⅱ、Ⅳ组之间差异不显著(P>0.05)。饲粮铜水平对心铜沉积量有极显著影响(P<0.01),Ⅲ组极显著高于其他组(P<0.01);Ⅰ组极显著高于Ⅱ、Ⅴ组(P<0.01),与Ⅳ组差异不显著(P>0.05);Ⅱ、Ⅳ和Ⅴ组之间差异不显著(P>0.05)。饲粮铜水平对肾铜沉积量有极显著影响(P<0.01),Ⅰ组极显著高于Ⅲ、Ⅳ和Ⅴ组(P<0.01),与Ⅱ组差异不显著(P>0.05);Ⅱ组极显著高于Ⅳ、Ⅴ组(P<0.01),与Ⅲ组差异不显著(P>0.05);Ⅲ组极显著高于Ⅳ、Ⅴ组(P<0.01),Ⅳ、Ⅴ组之间差异不显著(P>0.05)。

表3 饲粮铜水平对冬毛期银狐组织器官铜沉积量的影响Table 3 Effects of dietary copper level on copper deposition in tissue and organ of silver foxes during the winter hair period mg/kg
2.3 饲粮铜水平对冬毛期银狐组织器官发育的影响
由表4可知,饲粮铜水平对银狐心脏重有显著影响(P<0.05),Ⅱ组显著重于Ⅰ、Ⅴ组(P<0.05),与Ⅲ、Ⅳ组之间差异不显著(P>0.05);Ⅲ、Ⅳ组之间差异不显著(P>0.05),Ⅰ、Ⅴ组之间差异不显著(P>0.05)。饲粮铜水平对银狐脾脏重、肝 脏重和肾脏重无显著影响(P>0.05)。

表4 饲粮铜水平对冬毛期银狐组织器官发育影响Table 4 Effects of dietary copper level on tissue and organ development of silver foxes during the winter hair period g
3 讨论
3.1 饲粮铜水平对冬毛期银狐铜消化利用的影响
高铜增加了铜摄入量和粪铜排出量,但对铜表观生物学利用率未产生影响,这个结果与李宏等[9]在兔上和郑春田等[7]在猪上研究报道相一致,动物对外源添加的高铜会自身调节,吸收利用满足机体需要的用量,多余的铜大部分会通过粪便的形式排出体外,但长期饲喂高铜会增加动物组织器官中铜的沉积量,并对周围的土壤和环境造成严重污染,建议在动物养殖生产中谨慎控制铜添加量。
3.2 饲粮铜水平对冬毛期银狐组织铜沉积量的影响
高铜促进了银狐毛铜的沉积,最高铜组(Ⅴ组)是低铜组(Ⅱ组)毛铜沉积量的2.25倍,与李宏等[9]在兔上的报道不一致,可能由于铜在兔和银狐毛皮上的沉积机制差异造成,具体原因还有待于进一步研究。铜对毛色沉积发挥重要作用,毛皮中铜沉积量也能反映出毛皮的颜色,研究报道高铜饲粮能增加水貂皮的着色度[11]。本试验随饲粮铜添加水平增加,毛铜沉积量未呈规律性升高趋势,Ⅴ组毛铜沉积量最高,其次是Ⅲ组、Ⅳ组、Ⅰ组和Ⅱ组。肝脏是动物存储铜的重要器官,是铜代谢的主要场所,本试验得出随着饲粮铜水平增加,肝铜沉积量有升高趋势,这与多数研究报道一致[5,12]。本试验得出随着饲粮铜水平增加,心铜和肾铜沉积量产生无规律变化,这与张力等[5]在猪上研究报道一致,但与有些研究报道不一致[6,8,13],可能是由于银狐与猪、鸡在铜代谢方面存在一些差异。此外,添加的铜源形式及水平也可能是导致沉积量呈不同的变化规律的原因,具体的差异还有待于深入研究。本试验得出银狐组织器官铜沉积量从高到低分别为肝铜、毛铜、心铜和肾铜,与兔研究报道相一致[9]。
3.3 饲粮铜水平对冬毛期银狐组织器官发育的影响
饲粮铜水平虽然对母银狐心脏重产生显著影响,但高铜并未致心脏变大,从Ⅱ组(30 mg/kg铜)至Ⅴ组(150 mg/kg铜),心脏重呈降低趋势,表明饲粮添加高铜会影响心脏的发育。袁施彬等[8]研究报道,高铜会导致大量的铜在组织中蓄积,抑制了多种酶的活性,引起了组织器官发生炎性反应,进而能导致各组织器官毛细血管红细胞破裂,在生长肥育猪上研究发现,添加200 mg/kg铜组猪心脏肌间出血。但本试验未对各组织器官进行病理分析检测,所以高铜影响心脏发育的具体原因还有待进一步研究。本试验心铜沉积量与心脏重间未呈现出较强的正或负相关性,但Ⅰ组(6 mg/kg铜)至Ⅱ组(30 mg/kg铜),心脏重随心铜沉积量的减少而升高,而从Ⅲ组(60 mg/kg铜)至Ⅴ组(150 mg/kg铜),心脏重随心铜沉积量的减少而降低,高铜并未导致银狐心铜沉积量增加,而出现先降低后升高再降低的变化趋势,心脏重出现先升高后降低的变化趋势,这一结果说明适宜的铜水平有利于银狐机体对铜的吸收利用来促进其心脏的发育。然而高铜对肝脏重、肾脏重和脾脏重未产生显著影响。
4 结论
在本试验条件下,银狐冬毛期基础饲粮中添加60 mg/kg柠檬酸铜(饲粮中铜含量约65 mg/kg)时,有利于银狐对铜的消化利用。
[1] BUSH C R,RESTUM J C,BURSIAN S J,et al.Responses of growing mink to supplemental dietary copper and biotin[J].Scientifur,1995,19(2):141-147.
[2] AULERICH R J,RINGER R K.Feeding copper sulfate.Could it have benefits in nutrition of mink[J].U.S.Fur Rancher,1976,56(12):4-9.
[3] 吴学壮,张铁涛,崔虎,等.饲粮添加铜水平对育成期水貂生长性能、营养物质消化率及氮代谢的影响[J].动物营养学报,2012,24(6):1078-1084.
[4] ZHONG W,LIU H L,LUO G L,et al.Dietary copper supplementation improves pelt characteristics of female silver fox(Vulpes fulva)during the winter furgrowing season[J].Animal Science Journal,2014,85(7):757-762.
[5] 张力,柳树青.日粮不同铜水平对生长猪组织器官矿物元素和血液生化指标的影响[J].福建农业大学学报:自然科学版,1994,23(2):196-198.
[6] 高凤仙,田科雄,方热军,等.不同铜源和水平对生长猪组织铜含量和含铜酶的影响[J].中国畜牧兽医,2008,35(3):13-17.
[7] 郑春田,蒋宗勇,林映才,等.铜的来源和水平对生长猪生长性能和粪铜排出量的影响[J].中国畜牧杂志,2007,43(13):24-27.
[8] 袁施彬,陈代文,彭西,等.添加高铜对生长肥育猪组织铜残留量及病理学变化影响的研究[J].四川农业大学学报,2006,24(2):222-227.
[9] 李宏,郑中朝,郭天芬,等.日粮铜水平对兔组织器官中铜沉积量及铜代谢的影响[J].中国草食动物,2000,2(4):11-13.
[10] NRC.Nutrient requirements of mink and foxes[S].2nd ed.Washington,D.C.:National Academy Press,1982.
[11] AULERICH R J,RINGER R K,BLEAVINS M R,et al.Effects of supplemental dietary copper on growth,reproductive performance and kit survival of standard dark mink and acute toxicity of copper in minks[J].Journal of Animal Science,1982,55(2):337-343.
[12] 刘英丽,赵云焕.饲料铜水平对雏鸡组织器官中铜、铁、锌含量的影响[J].中国饲料,2009(23):42-43.
[13] 谭芳,胡坚.日粮铜水平对肉鸡组织中矿物质元素含量的影响[J].兽医大学学报,1990,10(1):67-72.

