应用酵母双杂交系统筛选与TRF1相互作用的蛋白质*
王伟琼,王 冲,刘延方,郝倩倩,马 杰
郑州大学第一附属医院血液科 郑州450052
#通讯作者,男,1962年5月生,教授,主任医师,研究方向:血液系统恶性肿瘤的基础及临床,E-mail:liuyanfang@zzu.edu.cn
端粒重复序列结合蛋白1(telomeric repeat binding factor 1,TRF1)是第一个被鉴定出来的端粒结合蛋白。TRF1 由439 个氨基酸组成,通过抑制端粒酶和端粒末端的接近程度负向调控端粒的长度。在端粒酶阳性细胞中,过表达TRF1 将导致端粒长度的缩短,而TRF1 的功能缺失突变体则会导致端粒长度不正常的增加[1]。作者的前期研究[2]发现:在有丝分裂期,TRF1 能够定位于中心体且用siRNA 沉默TRF1 能够导致多极纺锤体的出现,但TRF1 通过何种作用机制参与细胞周期的调控尚不清楚。该研究中,作者采用酵母双杂交方法寻找与TRF1 相互作用的蛋白,为探讨TRF1 在细胞有丝分裂期的调控机制提供依据。
1 材料与方法
1.1 细胞和主要试剂 人宫颈癌HeLa 细胞株由郑州大学血液病研究所保存。含有Flag 标记的p3XFLAG-myc-TRF1 真核表达质粒由洛克菲勒大学Tetia de Lange 教授惠赠。胎牛血清购自Hyclone 公司,青、链霉素,DMEM 培养基及蛋白A 和蛋白G 琼脂凝胶珠购自Invitrogen 公司,胰蛋白酶购自华美(SABC)公司。鼠抗Myc 单克隆抗体、鼠抗GST 单克隆抗体购自Cell Signaling 公司,鼠抗TRF1 单克隆抗体购自Abnova 公司,鼠抗SAM68 单克隆抗体购自Abcam 公司,罗丹明偶联羊抗鼠IgG 抗体购自Jackson Immunoresearch 公司。AH109 酵母菌种以及pGBKT7、pEGST-C3 质粒均由郑州大学血液病研究所保存。人HeLa 细胞cDNA 文库、MatchmakerTMGAL4 Two-Hybrid System 3 试剂盒购自Clontech 公司,限制性内切酶EcoRⅠ、SalⅠ、T4 DNA 连接酶、pyrobest 酶及相关缓冲液购自TaKaRa 公司,LipofectamineTM2000 购自Invitrogen 公司。
1.2 TRF1 诱饵蛋白表达载体的构建及鉴定 以含有TRF1 全长的p3XFLAG-myc-TRF1 真核表达质粒为模板扩增TRF1 基因序列全长,测序后将TRF1全长片段亚克隆到酵母表达载体pGBKT7,少量提取质粒;EcoRⅠ和SalⅠ酶切鉴定并测序证实。同法获得pGBKT7-TRF1 和pEGST-TRF1 重组质粒。将pGBKT7(阳性对照)和pGBKT7-TRF1 分别转化AH109感受态酵母菌,接种于SDP/-Leu 培养板,30℃培养观察,免疫印迹实验检测TRF1 蛋白的表达。
1.3 酵母双杂交[3]实验 以pGBKT7-TRF1 为诱饵质粒筛选人HeLa 细胞cDNA 文库,共筛选1×108个cDNA,经β-半乳糖苷酶活性测定以及2 轮SD/-Trp/-Leu/X-α-gal 培 养 板 和2 轮SD/-Trp/-Leu/-His/-Ade/ X-α-gal 培养板筛选后,将阳性克隆提取质粒,进行PCR 反应,将PCR 产物大小一致的质粒行酶切以排除重复质粒,进一步经核苷酸序列测定,并与GenBank 数据库进行同源性比较。
1.4 免疫共沉淀实验 收集HeLa 细胞,加入RIPA缓冲液进行裂解,取2%的细胞裂解液作为样品对照,剩余部分均分为2 份,1 份加入正常小鼠血清及蛋白A 和蛋白G 琼脂凝胶珠(空白对照),1 份加入正常小鼠血清、蛋白A 和蛋白G 琼脂凝胶珠及1 μg鼠抗TRF1 单克隆抗体(免疫共沉淀组),摇床上4℃旋转过夜孵育以捕获目的蛋白。将蛋白裂解物及免疫共沉淀复合物用上样缓冲液加热变性,SDS-PAGE凝胶电泳分离后转移至硝酸纤维素膜上,以鼠抗TRF1 单克隆抗体和鼠抗SAM68 单克隆抗体检测,再以相应二抗孵育后,用ECL 发光底物压片显影。
1.5 体外沉降实验 GST 融合蛋白及GST-TRF1融合蛋白的体外表达及纯化参照Qiagen 公司重组GST 蛋白纯化树脂说明书操作。体外沉降实验操作步骤参照文献[3]进行,共分为3组进行检测:HeLa细胞裂解液经RIPA 缓冲液预清除后,首先取20 μL裂解液作为内参对照(内参对照组),再分别与GST对照蛋白(GST 对照蛋白组)和GST-TRF1 融合蛋白(GST-TRF1 融合蛋白组)共同孵育,随后以SDSPAGE 电泳分离产物后,以抗GST 单克隆抗体及抗SAM68 单克隆抗体进行免疫印迹分析。
2 结果
2.1 TRF1 诱饵蛋白表达载体的构建 pGBKT7-TRF1 双酶切结果见图1。pGBKT7-TRF1 转化菌株生长良好,与pGBKT7 转化菌株生长速度无明显差异,表明TRF1 蛋白对AH109 酵母菌没有毒性。免疫印迹实验证实pGBKT7-TRF1 能在AH109 酵母菌中正确表达,见图2。
2.2 酵母双杂交筛选结果 经酵母双杂交最终筛选出5 个与人TRF1 相互作用的蛋白,分别是人SAM68 蛋白、Cullin1 蛋白、Polo-like kinase 1(Plk1)蛋白、Hsp70 以及activating transcription factor/cAMP responsive element binding protein(ATF5 蛋白)。
2.3 SAM68 与TRF1 的免疫共沉淀和体外沉降实验结果 在HeLa 细胞株中,内源性TRF1 能够与SAM68 抗体发生共沉淀反应,形成复合物,而与空白对照血清无结合(图3),表明TRF1 与SAM68 可能在细胞内相互结合。GST-TRF1 能够与SAM68 相结合,形成复合物,而GST 蛋白则不能将SAM68 沉淀下来(图4),提示TRF1 与SAM68 能够在体外相互结合。
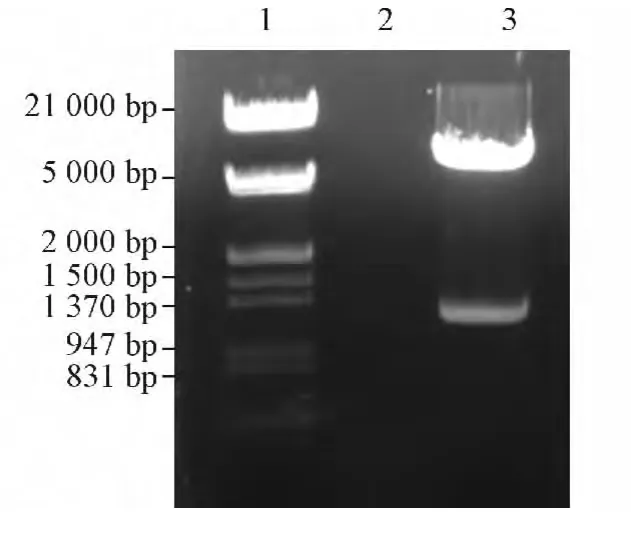
图1 重组质粒pGBKT7-TRF1 的鉴定
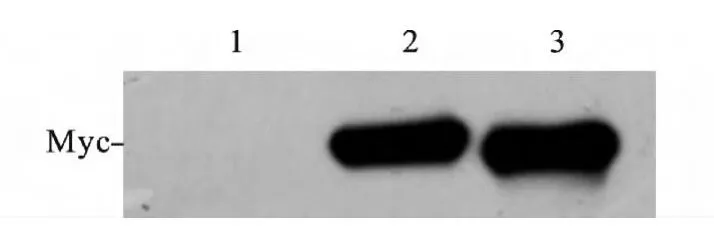
图2 pGBKT7-TRF1 在酵母菌AH109 中的表达
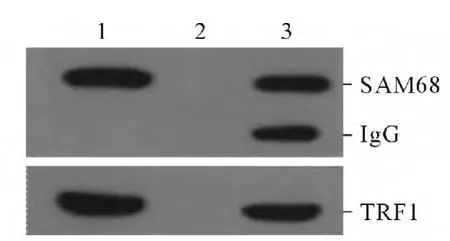
图3 SAM68 与TRF1 结合的免疫共沉淀结果
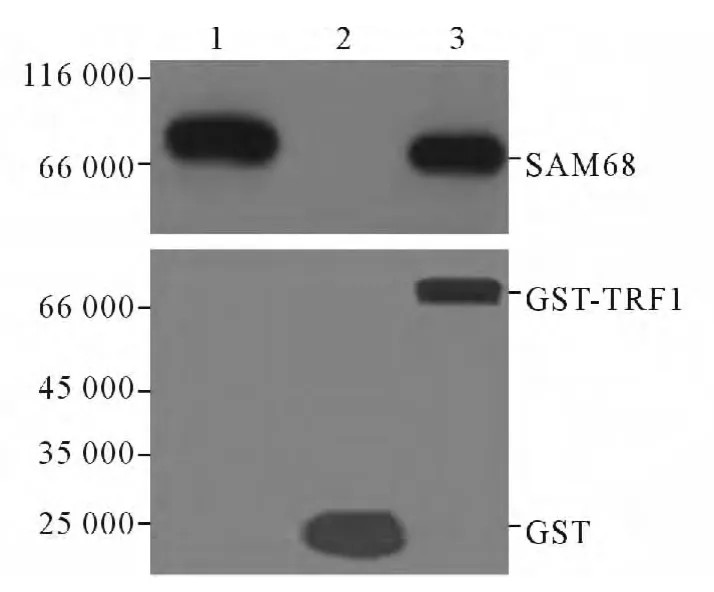
图4 TRF1 与SAM68 的体外沉降实验
3 讨论
酵母双杂交系统是以酵母遗传系统为基础,研究反式作用因子之间的相互作用对真核基因转录调控影响的一种技术。其最有价值的应用是用BD-X筛选由AD-Y 构成的cDNA 文库,从而发现新的蛋白质之间的相互作用。该技术不仅可用于鉴定新的蛋白质相互作用,证实可疑相互作用,确定相互作用的结构域,而且可直接获得编码相互作用蛋白质的基因。
端粒是存在于真核生物线性染色体末端由核酸DNA 重复序列和蛋白质组成的特殊保护性结构,对于维持染色体的完整性和基因组的稳定性具有极其重要的生物学意义。端粒异常将导致染色体不稳定,而染色体的不稳定性与细胞衰老及肿瘤发生密切相关。端粒长度和结构的维持受端粒结合蛋白的调控。TRF1 是以端粒序列(TTAGGG)27 为探针,从HeLa 细胞核裂解产物中分离纯化获得的第一个人端粒双链结合蛋白[1],它以同源二聚体的形式直接与端粒双链DNA 结合,通过调控端粒酶的活性以及端粒酶和端粒DNA 的接近程度,起到维持端粒长度与结构稳定的作用[4-5]。已有研究[6]显示,TRF1在包括急性白血病在内的多种肿瘤中表达下调,而过量表达外源性TRF1 将促使细胞提前进入有丝分裂期并发生凋亡。另有研究[7]表明,TRF1 能够参与细胞有丝分裂期的调控,在中心体形成的调控过程中发挥重要作用,但其具体作用机制及修饰途径目前仍不清楚。
该研究中,作者采用酵母双杂交系统,以pGBKT7-TRF1 为诱饵筛选人HeLa 细胞cDNA 文库,成功筛选出一批TRF1 的新的结合蛋白,并首次发现SAM68 可以与TRF1 在体内和体外相互作用。SAM68 是一个RNA 结合蛋白,在RNA 的剪切和转运过程中起调控作用[8];此外,SAM68 在细胞有丝分裂调节以及肿瘤的转移过程中亦起到重要的调节作用[9]。该项研究首次表明端粒结合蛋白TRF1 能够与RNA 结合蛋白SAM68 发生相互作用,这为进一步研究端粒结合蛋白在细胞有丝分裂时相的调节及RNA 在调控和转运过程中的功能提供了新的研究线索,也为进一步研究TRF1 对细胞周期和凋亡调控的影响提供了新的实验证据。
综上所述,作者鉴定出了5 个新的与TRF1 相互作用的蛋白质;通过体内及体外结合实验证实了SAM68 是一个新的TRF1 结合蛋白。TRF1 有可能是一个新的连接端粒和细胞有丝分裂调控的通路蛋白,其可能通过与SAM68 的结合参与RNA 剪切及转运过程的调控;选择TRF1 作为基因治疗的靶点,可能为肿瘤的靶向治疗提供新的线索。
[1]van Steensel B,de Lange T.Control of telomere length by the human telomeric protein TRF1[J].Nature,1997,385(6618):740
[2]Zhu Y,Wang C,Lan J,et al.Phosphorylation of Tara by Plk1 is essential for faithful chromosome segregation in mitosis[J].Exp Cell Res,2012,318(18):2344
[3]王冲,余建,黄河.Plk1 磷酸化修饰PinX1 对宫颈癌He-La 细胞有丝分裂及凋亡的影响[J].郑州大学学报:医学版,2013,48(3):323
[4]Chong L,van Steensel B,Broccoli D,et al.A human telomeric protein[J].Science,1995,270(5242):1663
[5]Poulet A,Pisano S,Faivre-Moskalenko C,et al.The N-terminal domains of TRF1 and TRF2 regulate their ability to condense telomeric DNA[J].Nucleic Acids Res,2012,40(6):2566
[6]Zhou XZ,Lu KP.The Pin2/TRF1-interacting protein PinX1 is a potent telomerase inhibitor[J].Cell,2001,107(3):347
[7]Zhu Q,Meng L,Hsu JK,et al.GNL3L stabilizes the TRF1 complex and promotes mitotic transition[J].J Cell Biol,2009,185(5):827
[8]Itoh M,Haga I,Li QH,et al.Identification of cellular mRNA targets for RNA-binding protein Sam68[J].Nucleic Acids Res,2002,30(24):5452
[9]Li Z,Yu CP,Zhong Y,et al.Sam68 expression and cytoplasmic localization is correlated with lymph node metastasis as well as prognosis in patients with early-stage cervical cancer[J].Ann Oncol,2012,23(3):638