物理法处理对香蕉秸秆沼气发酵能力影响分析*
裴培,张成明,李纪红,姜立,付晓芬,黄辉金,查瑞涛,李十中
1(清华大学 核能与新能源技术研究院,北京,100084)
2(北京市生物燃料工程技术研究中心,北京,100084)
3(天津科技大学,材料科学与化学工程学院,天津,300457)
香蕉秸秆(香蕉假茎,香蕉树)是香蕉生产过程中的主要副产物,由香蕉叶鞘交叠构成,具有含水率高、植株高和硬度大等特点[1]。主要分布于我国海南、广东、广西及福建等地。通常,在香蕉收获后需要对即将枯萎的母株进行砍伐,以使新的幼苗取代母株从而进行下一代的香蕉生产。因此,在收获香蕉时会产生数量巨大的香蕉秸秆[1],其产量约为120~165 t/hm2[2]。传统的香蕉秸秆利用方式包括堆肥、造纸、制作绳索、制作包袋、制作饲料等[1-2],然而这些方式均具有一定的局限性。由于香蕉秸秆中的纤维类物质不易降解,使其自然堆积腐化的周期较长,堆肥效率较低。用于造纸时,每获得1 t纸,需要耗费132 t香蕉秸秆[1],生产效率较低,且生产成本高昂。香蕉秸秆中含有的单宁等物质使其在用作饲料时具有一定的局限性,易造成动物不适口的问题[2]。在无合适处理方式的情况下,目前最常见的处理方式是将香蕉秸秆直接粉碎后还田,或作为农业废弃物在田间地头大量堆积,任其自然腐化。这种处理方式不仅会产生大量的温室气体及有害气体如硫化氢、氨气等[1],污染种植地环境,还极易诱发香蕉植物病害如黄叶病的爆发[3-4]。因此,寻找一种可以大规模合理利用香蕉秸秆的方案具有重要的现实意义。在众多备选方案中,利用厌氧发酵技术将香蕉秸秆转换为沼气的前景最为广阔。
利用微生物在厌氧条件下可消耗有机物的自然特性,将生物质原料转变成为清洁的可再生能源——沼气[5-9],可以达到保护环境以及缓解日益紧张的能源供应危机的双重目的[5-6]。有研究称,废弃香蕉(烘干后)的甲烷产量高达(398 ±20)L/kg VS[10],香蕉皮的甲烷产量为190~266 L/kg TS[10-11]。但是,利用香蕉秸秆进行沼气发酵的研究较少[12]。有研究表明,香蕉秸秆渣在常温下的沼气产量为273 L/kg TS[13]。Kalia[14]等人报道,香蕉秸秆渣在常温(37 ~40℃)发酵57 d后,其沼气产量为267~271 L/kg TS,而高温(50~55℃)发酵24 d后,沼气产量为212~229 L/kg TS。沼气中的甲烷含量为59% ~79%,且高温发酵比常温发酵的速率高2.4倍。
物理预处理(粉碎)是处理新鲜香蕉秸秆的第一步,可以降低物料粒径的大小,利于物料输送和提高物料的生物转化速率及转化率[1]。目前并未见到物理处理对新鲜香蕉秸秆沼气发酵性能影响的研究。本文采用机械磨浆方法处理香蕉秸秆,通过调整盘磨的机械间隙和次数来控制香蕉秸秆纤维的切断程度和纤维束离解程度,获得4种纤维长度不同的样品,利用沼气潜力分析仪对样品的沼气发酵能力进行考察,并检测和研究沼气中甲烷含量及发酵前后纤维组分的利用情况。本文还比较香蕉秸秆与其他常见秸秆类原料的沼气发酵潜力,分析了香蕉秸秆沼气发酵资源化利用的可行性。
1 材料与方法
1.1 材料
1.1.1 香蕉秸秆及样品制备
新鲜香蕉秸秆由海南澄迈神州车用沼气有限公司提供。经初步切断处理后,采用盘磨机(BR30-300CB KRK,Kogyo)粗磨,并调整盘磨的间隙和样品浓度,得到纤维长度不等的样品,制备流程见图1。样品于4℃保存备用。
将物理处理后的香蕉秸秆作为沼气潜力分析的发酵底物,其基本性质如表1所示。
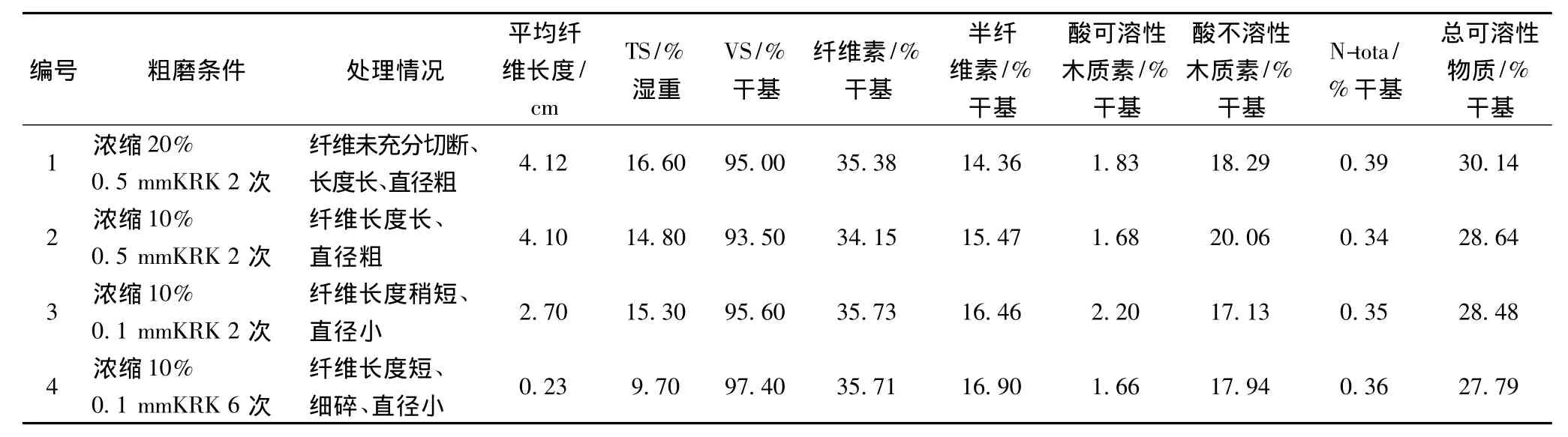
表1 香蕉秸秆样品的基本性质Table 1 Basic properties of banana pseudo stem sample
1.1.2 种泥
厌氧活性污泥取自北京高碑店污水处理厂,种泥基本性质如表2所示。

表2 种泥基本性质Table 2 Basic properties of seed sludge
1.2 沼气发酵
种泥与香蕉秸秆的 VS比例为1∶1[15-17],充分混合样品与种泥。采用沼气潜力分析仪(AMPTSⅡ,碧普,见图2)进行香蕉秸秆产沼气能力测试。沼气潜力分析仪A单元反应瓶体积为500 mL,体系总质量为400 g,发酵起始时体系底物固体浓度为6%(TS浓度),pH7.5,发酵温度(37±1)℃,所有样品设置3个平行样,发酵过程中适当搅拌(搅拌40%)。B单元添加饱和食盐水,可用作安全瓶。C单元可纪录沼气日产量及累积产量,并转换成标准温度和压力下(0℃,101.325 kPa)对应的数值。发酵启动前需在A、B单元中通入N2,以保证厌氧环境。空白底物为干燥玻璃珠,所有样品的发酵结果均扣除种泥的影响。

图2 沼气潜力分析仪Fig.2 Automatic methane potential test system
1.3 分析方法
总固体质量(Total solid,TS)与挥发性固体(Volatile solid,VS)采用重量法测定[18];半纤维素、纤维素、木质素等组分测定采用 NREL方法测定[19-20];pH采用pH计(METER 6219)测定;沼气成分用气相色谱仪(SP-6890,山东鲁南瑞虹化工仪器有限公司)检测,气相色谱条件:填充柱为ProParkQ,0.3 cm ×200 cm,50~80目(大连中汇达科学仪器有限公司),柱温为100℃,检测器为TCD,检测器温度为90℃,进样口温度为60℃,载气为氦气,电流为80 mA;标准气体的组成成分为20%H2,60%CH4和20%CO2;气相色谱测定结果采用N2000软件分析,积分方法为外标法;发酵过程中的沼气累积产量及日产气量可用沼气潜力分析仪在线记录。
2 结果与讨论
2.1 厌氧发酵结果比较
2.1.1 物理处理程度对香蕉秸秆产气速率及累积产气量的影响
物理处理后的新鲜香蕉秸秆在沼气发酵过程中的沼气累积产气量及日产气量如图3所示。

图3 沼气发酵过程中香蕉秸秆的沼气累积产气量及日产气量Fig.3 Cumulative and daily biogas production from banana pseudo stem during biogas fermentation
经物理盘磨处理后,不同香蕉秸秆样品在组成成分上差异很小,仅在纤维长度和直径上呈现差异(表1)。1号和2号样品物理处理程度较轻,纤维长度接近,平均长度分别为4.12和4.10 cm。随着处理强度的增加,样品的纤维长度显著降低,3号和4号样品的平均纤维长度为2.70和0.23 cm。如图3所示,物理处理强度的增强可以提高底物的沼气累积产量及日产量。1~4号样品(物理处理强度依次增强)发酵28 d的沼气累积产量分别为2 022.10、2 024.75、2 388.35和2 207.90 mL,除去空白影响后,产沼气能力分别为 281.09、282.75、340.13和 306.49 mL/gVSadded。其中,3号、4号样品的累积产气量比1号、2号样品高8.29%和17.36%。4号样品的物理处理强度最大,纤维长度最短,直径最小,但其产气能力则略低于3号样品。该现象表明,纤维物理处理程度达到一定程度后,不会进一步提高底物的产气能力。而且,过于复杂的处理流程可能会造成部分生物质的流失,进而造成累积沼气产量的下降。与常见的秸秆相比,如玉米秸秆、水稻秸秆、小麦秸秆等,新鲜香蕉秸秆中水分含量高达95%左右。采用多次磨浆操作会造成香蕉秸秆中液体组分的流失。实验中发现,香蕉杆液体的COD可以达到6 000 mg/L以上(未发表的数据)。因此,磨浆过程造成的生物质流失是由于高COD浓度的液体的流失造成的。考虑发酵效率、纤维离解程度、能耗和操作步骤等因素,可以将3号样品的盘磨方式作为后续研究的物理处理方式。
从沼气日产量上看,3号、4号样品的最高沼气日产量分别可达319.8和333.6 mL/d(图3b),比1号、2号样品的日产气量高32.11% ~34.92%。物理预处理对沼气发酵性能的改善可能是由于处理过程破坏了纤维质底物中木质素、纤维素和半纤维素组成的复杂包裹结构,促进了底物与微生物及酶的接触,进而促进了底物的水解和发酵,并最终改善了底物的沼气发酵性能。从发酵趋势上看,体系接种后可以迅速启动发酵过程,在发酵开始的第3天即可达到产气高峰(图3b),这是由于香蕉秸秆中存在的可溶性物质及易被厌氧微生物利用的有机质首先被利用、转化所致。发酵约12 d后,累积沼气气量可达最终累积气量的80%(图3a),说明香蕉杆的沼气转化速率较为迅速,具有良好的应用前景。
2.1.2 气体组成成分
物理处理后的香蕉秸秆在沼气发酵过程中的CH4和CO2含量变化如图4所示。
在沼气发酵过程中,纤维水解形成的多糖在产酸细菌作用下形成小分子有机酸,再在产甲烷菌作用下转化成为CH4和 CO2[9,21]。以香蕉秸秆为底物发酵获得的沼气中,主要组分为CH4和CO2。相对于其他常用的沼气发酵原料,如人畜粪便和餐厨垃圾而言,其沼气成分简单,无有毒气体产生。不同物料进行沼气发酵时,沼气的组分构成主要由原料的组成成分决定[22]。本研究仅通过物理处理,并不会显著改变底物的组分比例。因此,从4种样品获得的沼气中,气体组分含量差异不大(图4)。CO2含量在发酵前3 d持续增长,此后稳定下降至30%左右。CH4含量在发酵第2天显著提高,表明接种后很快能进入产甲烷过程。CH4含量在发酵第9天后维持稳定在55.54% ~63.88%。
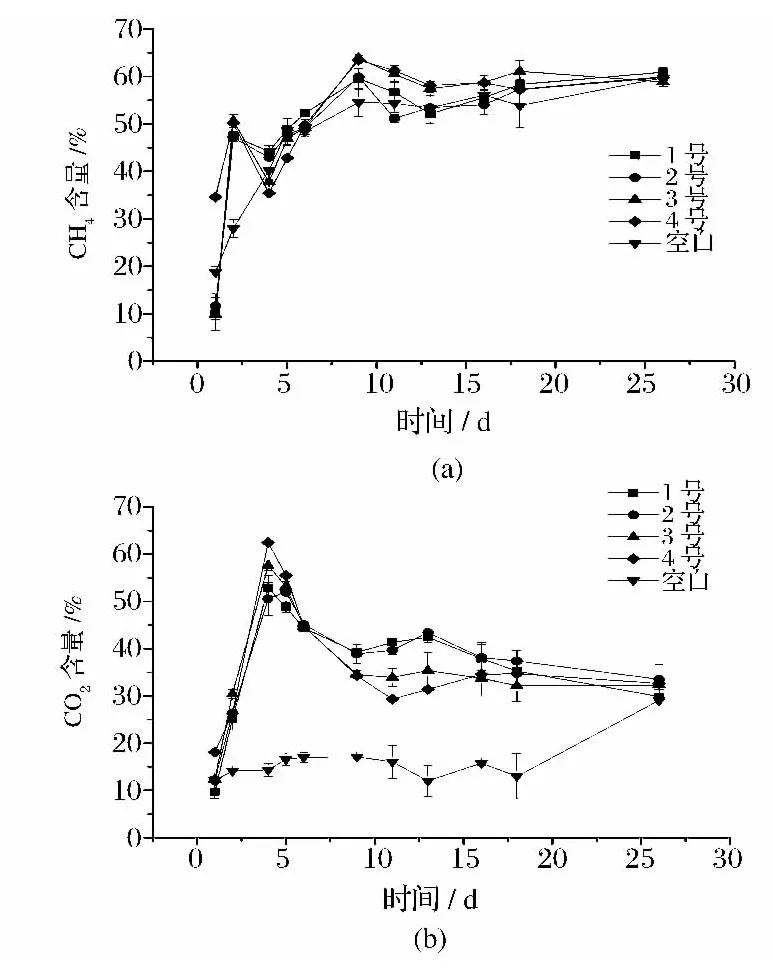
图4 香蕉秸秆厌氧消化过程中沼气中CH4和CO2含量的变化Fig.4 Variation of the CH 4and CO2 concentrations in the biogas during the anaerobic digestion from banana pseudo stem
2.2 发酵前后样品降解情况比较
2.2.1 体系基本性质变化
发酵前后体系基本性质的变化,如TS、VS、pH等,如表3所示。
经沼气发酵后,1号和2号样品的TS降解率较为接近,3号和4号样品的TS降解率则相对较高。物理磨浆处理可以缩短纤维长度,增加纤维与微生物或酶的接触,从而造成样品降解率的提升。其中,3号样品的TS降解率最高,与沼气发酵情况一致。4种样品的 VS降解率较为接近,均在27.87%~28.30%之间。此外,本试验中4种样品体系的pH在发酵前后稳定在7.5~8.0,维持在大多数产甲烷微生物最适宜的 pH 7 ~8[8]。
2.2.2 纤维降解率
本文对发酵产气能力较高的3号样品发酵前后香蕉秸秆纤维的利用情况进行了分析,结果图5。
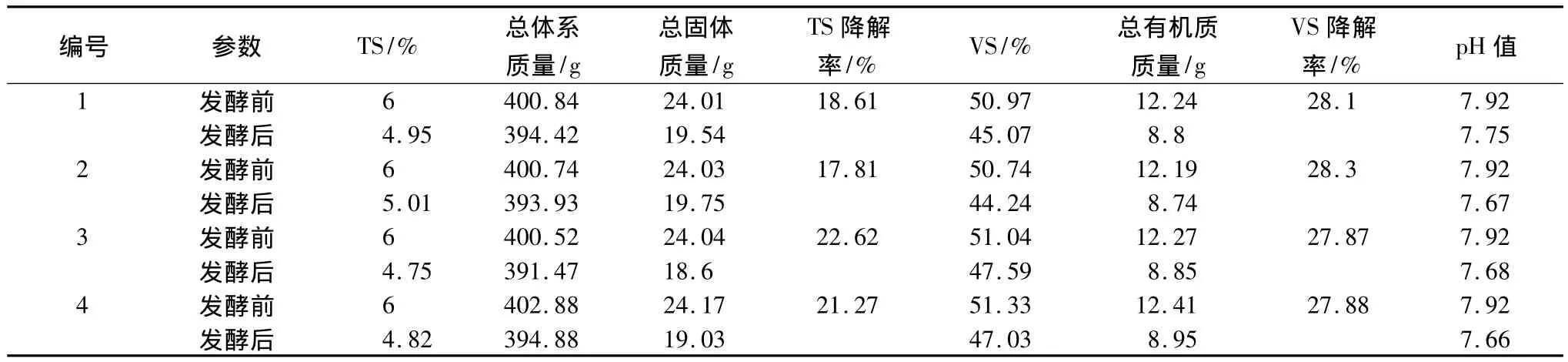
表3 沼气发酵前后的底物基本性质变化Table 3 Basic propertiesof the substrate before and after biogas fermentation
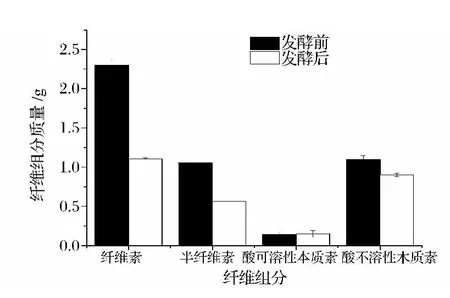
图5 沼气发酵后香蕉秸秆主要成分的利用情况Fig.5 Utilizations of main compositions for banana pseudo stem after the biogas fermentation
香蕉秸秆中的纤维组分在发酵过程中可以缓慢降解,与木质素相比,半纤维素和纤维素较容易被微生物利用。沼气发酵前香蕉秸秆中纤维素、半纤维素、可溶性木质素及不可溶性木质素的含量分别为35.73%、16.46%、2.20%和17.13%(表1)。由图5可知,3号样品体系在发酵后纤维素、半纤维素及不可溶性木质素的降解率分别为51.74%、46.82%和18.02%。体系中的可溶性木质素在发酵后有少量提高,这是由于发酵过程中微生物对香蕉秸秆中的纤维类物质进行了降解,从而提高了可溶性木质素的相对含量。
2.3 香蕉秸秆沼气发酵资源化利用的可行性及前景分析
香蕉秸秆年产量约为2 400万t[12],低于小麦秸秆和玉米秸秆的产量(分别为10 718.95万 t[23]和16 723.80万 t[23]),与甘蔗渣产量相近(2 079.31 万t[23])。在香蕉集中种植的地区利用香蕉秸秆进行沼气发酵,可以保证一定的原料供应,同时可以获得清洁的可再生能源及生物质肥料[14],并减轻香蕉秸秆自然堆放腐烂时所造成的土壤、空气及病原污染。根据文献报道,未经复杂预处理时,香蕉秸秆的产甲烷能力(204.03 mL CH4/gVSadded)与玉米秸秆(196 233 mL CH4/gVSadded[16])、小麦秸秆(204 270 mL CH4/gVSadded[23])及甘蔗渣(278 mL CH4/gVSadded[24])的产甲烷能力相当。同时,沼气发酵周期也相对较短[24-26]。与其它秸秆相比,香蕉秸秆干物质中有机质含量最高(表4),在沼气发酵方面具有一定优势。

表4 几种秸秆类原料的组成成分Table 4 Composition of different straw materials
本研究中,采用盘磨物理处理获得香蕉秸秆样品过程的能耗很低,每1 kg(干重)香蕉秸秆盘磨的能耗仅为1.35 kW/h,可作为预处理的第步,其后续处理可以借鉴现有的碱处理、微波处理等方式[29-30],以进一步增加纤维的离解程度,提高转化率和发酵效率。在工业化应用方面,需要从原料收集运输方案的建立、原料预处理与储藏、厌氧反应器的开发等方面展开研究。此外,目前还没有专门针对香蕉秸秆进行收集和处理的机械设备,在这方面展开研究工作也是十分必要的。
3 结论
在37℃条件下,物理预处理强度的增强可以改善香蕉秸秆的沼气发酵性能,但对沼气中甲烷含量没有显著影响,所有样品的甲烷含量在发酵9 d后稳定在55.54%~63.88%。纤维长度为0.23和2.70 cm时,最高日产气量分别为333.6和319.8 mL/d,比4.10和4.12 cm的样品高32.11% ~34.92%;沼气产气率分别为 306.49和 340.13 mL/g VSadded,比4.10 cm和4.12 cm的样品高8.29%17.36%。综合考虑沼气发酵效率、预处理能耗和操作步骤的繁易程度等因素,可以将3号样品(纤维长度2.70 cm)对应的盘磨方式作为后续研究的处理方式。
[1] Jing Yan Tock,Chin Lin Lai,Keat Teong Lee,et al.Banana biomass as potential renewable energy resource:A Malaysian case study[J].Renewable and Sustainable Energy Reviews,2010,14(2):798-805.
[2] 韦英明,邹隆树.香蕉茎叶饲喂泌乳牛试验[J].广西农业生物科学,2001,20(1):34-36.
[3] 曹卫东,王斌斌,洪兰华.1XHJ系列香蕉假茎还田机的研究[J].现代农业装备,2007(6):54-56.
[4] Ulloaa J B,van Weerdb J H,Huismanb E A,et al.Tropical agricultural residues and their potential uses in fish feeds:the Costa Rican situation[J].Waste Management,2004,24(1):87-97.
[5] Nallathambi Gunaseelan V.Regression models of ultimate methane yields of fruits and vegetable solid wastes,sorghum and napiergrass on chemical composition[J].Bioresource Technology,2007,98(6):1 270-1 277.
[6] 周孟津,张榕林,蔺金印.沼气实用技术[M].北京:化学工业出版社,2004.
[7] Sebastian Jaenicke1,Christina Ander,Thomas Bekel1,et al.Comparative and Joint Analysis of Two Metagenomic Datasets from a Biogas Fermenter Obtained by 454-Pyrosequencing[J].www.plosone.org,2011,6(1):1-15.
[8] Raposo F,De la Rubia M A,Fernández-Cegrí V,et al.Anaerobic digestion of solid organic substrates in batch mode:An overview relating to methane yields and experimental procedures[J].Renewable and Sustainable Energy Reviews,2011,16(1):861-877.
[9] Jean-Claude Frigon,Punita Mehta,Serge R Guiot.Impact of mechanical,chemical and enzymatic pre-treatments on the methane yield from the anaerobic digestion of switchgrass[J].Biomass and Bio-energy,2012,36:1-11.
[10] Clarke W P,Radnidge P,Lai TE,et al.Digestion of waste bananas to generate energy in Australia[J].Waste Management,2008,28(3):527-533.
[11] Bardiya N,Somayaji D,Khanna S.Bio-methanation of banana peel and pineapple waste[J].Bioresource Technology,1996,58(1):73-76.
[12] 刘国欢,邝继云,李超,等.香蕉秸秆资源化利用的研究进展[J].可再生能源,2012(5):64-68;74.
[13] 欧忠庆,张劲,邓干然,等.香蕉茎秆渣制作沼气试验[J].中国热带农业,2006(5):39-40.
[14] Kalia V C,Sonakya V,Raizada N.Anaerobic digestion of banana stem waste[J].Bioresource Technology,2000,73(2):191-193.
[15] Jin MTriolo,Sven G Sommer,Henrik B Moller.A new algorithm to characterize biodegradability of biomass during anaerobic digestion:Influence of lignin concentration on methane production potential[J].Bioresource Technology,2011,102(20):9 395-9 402.
[16] Raposo F,Banks C J,Siegert I,et al.Influence of inoculum to substrate ratio on the biochemical methane potential of maize in batch tests[J].Process Biochemistry,2006,41(6):1 444-1 450.
[17] Li L,Yang X,Li X,et al.The Influence of Inoculum Sources on Anaerobic Biogasification of NaOH-treated Corn Stover[J].Energy Sources,2010,33(2):138-144.
[18] 中国科学院成都生物研究所.沼气发酵常规分析[M].北京:中国科学技术出版社,1984:17-20.
[19] 张红漫,郑荣平,陈敬文,等.NREL法测定木质纤维素原料组分的含量[J].分析试验室,2010,29(11):15-18.
[20] Sluiter A,Hames B,Ruiz R,et al.Determination of Structural Carbohydrates and Lignin in Biomass[J].NREL Laboratory Analytical Procedure(LAP),2011,07.
[21] Chanakya H N,Isha Sharma,Ramachandra T V.Microscale anaerobic digestion of point source components of organic fraction of municipal solid waste[J].Waste Management,2009,29(4):1 306-1 312.
[22] 田梦,刘晓玲,李十中,等.香蕉秸秆与牲畜粪便固体联合厌氧发酵产沼气的特性[J].农业工程学报,2013,29(07):177-184.
[23] 毕于运,高春雨,王亚静,等.中国秸秆资源数量估算[J]. 农业工程学报,2009,25(12):211-217.
[24] Stanmore B R.Generation of Energy from Sugarcane Bagasse by Thermal Treatment[J].Waste Biomass Valor,2010,1(1):77-89.
[25] Jackowiak D,Bassard D,Pauss A,et al.Optimisation of a microwave pretreatment of wheat straw for methane production[J].Bioresource Technology,2011,102(12):6 750-6 756.
[26] Zehra Sapci.The effect of microwave pretreatment on biogas production from agricultural straws[J].Bioresource Technology,2013(128):487-494.
[27] Zhong Weizhang,Zhang Zhongzhi,Luo Yijing,et al.Effect of biological pretreatments in enhancing corn straw biogas production[J].Bioresource Technology,2011,102(24):11 177-11 182.
[28] Sambusiti C,Monlau F,Ficara E,et al.A comparison of different pre-treatments to increase methane production from two agricultural substrates[J].Applied Energy,2013(104):62-70.
[29] Parameswaran Binod,Raveendran Sindhu,Reeta Rani Singhania,et al.Bioethanol production from rice straw:An overview[J].Bioresource Technology,2010,101(13):4 767-4 774.
[30] Chandra R,Takeuchi H,Hasegawa T.Methane production from lignocellulosic agricultural crop wastes:A review in context to second generation of biofuel production[J].Renewable and Sustainable Energy Reviews,2012,16(3):1 462-1 476.

