吡格列酮对肥胖型多囊卵巢综合征患者脂肪细胞因子的影响
肖园园,曾朝阳,朱武飞,邹雪琴(三峡大学第一临床学院,宜昌市中心人民医院内分泌科,宜昌 443003;通讯作者:E-mail:zengzhaoyang68@163.com)
多囊卵巢综合征(polycystic ovary syndrome,PCOS)是育龄妇女常见的内分泌及生殖功能障碍性疾病,其主要表现为高雄激素、月经异常、不孕以及卵巢多囊化改变。同时可伴有肥胖、胰岛素抵抗、血脂异常等代谢异常。研究表明,胰岛素抵抗及其伴随的高胰岛素血症是PCOS发生发展的主要因素。其中肥胖型PCOS患者的高胰岛素血症发生率高达75%[1]。脂肪组织能分泌大量脂肪细胞因子和激素,这些物质通过内分泌、旁分泌和自分泌途径参与维持机体众多生理功能。其中,内脂素(visfatin,VF)、瘦素(leptin,LEP)、脂联素(adiponectin,APN)是目前研究肥胖、胰岛素抵抗的热点。研究表明,这三种脂肪因子与多种代谢性疾病有关,如2型糖尿病(type 2 diabetes,T2DM)、心血管疾病和PCOS等。新一代噻唑烷二酮类(thiazolidinediones,TZDs)药物吡格列酮,是一种胰岛素增敏剂,关于其治疗PCOS的研究国内报道不多。本研究通过将吡格列酮用于肥胖型PCOS患者的治疗,观察治疗前后PCOS患者脂肪因子的改变,以初步探讨TZD治疗PCOS可能的作用机制。
1 对象与方法
1.1 研究对象
选择2009-06~2012-12在宜昌市中心人民医院内分泌科和妇科就诊的肥胖型PCOS患者34例,均未接受相关药物治疗。平均年龄(26.48±2.24)岁。PCOS诊断参照2003年在荷兰鹿特丹PCOS会议上的标准[2]。肥胖的诊断标准为体重指数(BMI)≥25 kg/m2。并排除患有肝肾疾病、先天性肾上腺皮质增生症、雄激素分泌肿瘤、库欣综合征、心血管、糖尿病、甲状腺等慢性疾病。治疗前后均征得所有入选患者的同意。
1.2 干预方法
病例均在控制饮食和运动量的基础上,口服吡格列酮15 mg/d,连续服用12周,服药期间建议患者注意避孕,一旦发现妊娠立即停药。
1.3 观察指标
所有指标服药前后分别检测一次。
1.3.1 一般指标 测量患者身高、体重、腰围、臀围,计算体重指数BMI(BMI=体重/身高2)及腰臀比(WHR=腰围/臀围)。记录患者年龄、治疗前后月经情况(月经周期≥35 d为月经稀发,停经≥6个月为闭经)、多毛(采用F-G评分[3],≥7分为多毛)等情况。
1.3.2 临床内分泌指标 所有受试者于月经周期第2-4天晨9:00-11:00空腹抽肘静脉血(闭经者则不限时间),分别测定治疗前后卵泡雌激素(FSH)、黄体生成素(LH)、睾酮(T)、总胆固醇(TC)、甘油三脂(TG)、、低密度脂蛋白胆固醇(LDLC),高密度脂蛋白胆固醇(HDL-C)、空腹血糖(FPG)及空腹血清胰岛素(FINS)水平,用稳态模型(HOMA model)计算胰岛素抵抗指数(HOMA-IR),公式为:HOMA-IR=FPG ×FINS/22.5。测定 VF、APN和LEP。
1.3.3 检测方法 血糖采用葡萄糖氧化酶法测定,TC、LDL-C、TG、HDL-C 采用沉淀法测定,检测设备采用日立7600-020全自动生化分析仪。利用化学发光法测定血清FINS、FSH、LH、T(试剂盒由北京原子高科技术应用股份有限公司提供)。血清VF采用酶联免疫吸附法(ELISA)测定,试剂盒由上海研晶实业科技有限公司提供;LEP和APN采用放射免疫法检测,试剂盒由深圳晶美生物公司提供,操作按试剂盒说明书进行,均在同一批次内检测。
1.3.4 基础体温(BBT)及卵巢检测 睡眠6-8 h后,未起床、进食或谈话前,每天测定BBT。月经中期B超观察卵巢体积及监测卵泡数。
1.4 统计学方法
2 结果
2.1 吡格列酮干预前后月经及排卵情况
经BBT测定及B超检查情况表明,卵泡总数及卵巢体积显著降低(P<0.01,见表1);1例在吡格列酮治疗第10周获得妊娠,4例治疗前闭经患者,于治疗后出现自发月经,基础体温单相。
表1 治疗前后一般情况的变化(±s)Table 1 Comparison of clinical data before and after treatment(±s)

表1 治疗前后一般情况的变化(±s)Table 1 Comparison of clinical data before and after treatment(±s)
时间 BMI/(kg/m2) WHR F-G 评分 卵巢体积/cm3卵泡数/个左侧 右侧 左侧 右侧治疗前 28.52 ±3.1 0.97 ±0.08 8.04 ±2.57 15.23 ±3.08 14.93 ±2.84 16.02 ±3.46 15.83 ±3.21治疗后 27.15 ±2.9 0.82 ±0.05 6.04 ±2.48 10.75 ±2.78 10.89 ±2.67 10.13 ±2.95 10.74 ±2.83 t 1.843 1.112 2.214 3.378 3.345 6.152 5.874 P 0.078 0.271 0.045 0.001 0.001 0.000 0.000
2.2 吡格列酮干预前后代谢指标及性激素变化
与治疗前比较,BMI、WHR有下降趋势,但无显著性差异(P>0.05)。治疗12周后,FSH无显著变化,但F-G评分、LH、LH/FSH、T较治疗前有显著下降(P <0.05,见表1、表2)。
2.3 吡格列酮干预前后血糖、血脂变化
表2 治疗前后性激素水平的变化(±s)Table 2 Comparison of sex hormone before and after treatment(±s)
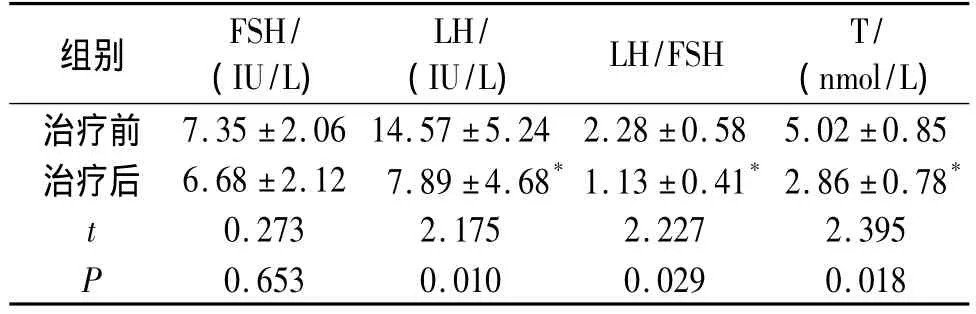
表2 治疗前后性激素水平的变化(±s)Table 2 Comparison of sex hormone before and after treatment(±s)
组别 FSH/(IU/L)LH/(IU/L) LH/FSH T/(nmol/L)治疗前7.35 ±2.06 14.57 ±5.24 2.28 ±0.58 5.02 ±0.85治疗后 6.68 ±2.12 7.89 ±4.68*1.13 ±0.41*2.86 ±0.78*t 0.273 2.175 2.227 2.395 P 0.653 0.010 0.029 0.018
治疗12周后,FPG、FINS、HOMA-IR、TC、TG、LDL-C较治疗前均有下降,差异有统计学意义(P<0.05,P <0.01);HDL-C 较治疗前有显著上升(P <0.01,见表3)。
2.4 吡格列酮干预前后脂肪因子的变化
治疗12周后,VF和LEP较治疗前有显著下降(P <0.01),APN 较治疗前有显著上升(P <0.05,见表4)。
表3 治疗前后血糖、血脂及胰岛素相关指标的变化(±s)Table 3 Com parison of serum glucose,lipids and related index of insulin before and after treatm ent(±s)

表3 治疗前后血糖、血脂及胰岛素相关指标的变化(±s)Table 3 Com parison of serum glucose,lipids and related index of insulin before and after treatm ent(±s)
时间 FPG/(mmol/L)FINS/(mmol/L) HOMA-IR TC/(mmol/L)TG/(mmol/L)HDL-C/(mmol/L)LDL-C/(mmol/L)治疗前 5.63 ±0.51 23.58 ±7.45 5.48 ±0.43 6.32 ±1.45 2.13 ±0.86 1.73 ±0.42 3.53 ±0.46治疗后 4.82 ±0.32 13.78 ±5.59 2.31 ±0.29 4.89 ±0.97 1.04 ±0.54 1.98 ±0.51 2.18 ±0.48 t 2.212 7.725 3.378 5.548 5.721 2.192 4.346 P 0.039 0.000 0.000 0.018 0.000 0.049 0.000
表4 治疗前后脂肪因子的变化(±s)Table 4 Comparison of adipocytokines before and after treatm ent(±s)
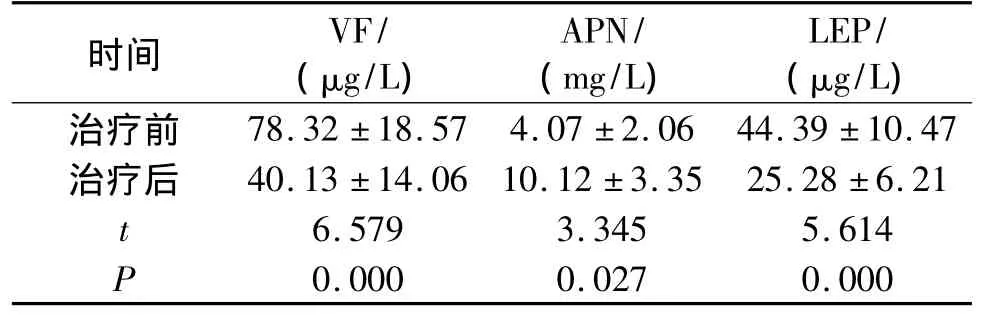
表4 治疗前后脂肪因子的变化(±s)Table 4 Comparison of adipocytokines before and after treatm ent(±s)
时间 VF/(μg/L)APN/(mg/L)LEP/(μg/L)治疗前78.32 ±18.57 4.07 ±2.06 44.39 ±10.47治疗后 40.13 ±14.06 10.12 ±3.35 25.28 ±6.21 t 6.579 3.345 5.614 P 0.000 0.027 0.000
3 讨论
PCOS病因复杂,是遗传因素和环境因素相互作用的结果,涉及神经内分泌、糖代谢、脂肪代谢、蛋白质代谢以及卵巢局部调控因素等多方面的异常变化。目前对PCOS的确切发病机制尚不清楚,对PCOS的治疗学的研究也仍处探索之中。胰岛素抵抗(IR)是PCOS的一个重要生化特点,PCOS患者中约50%-70%存在IR,IR成为联系PCOS生殖障碍和代谢综合征的纽带[4]。近来随着对脂肪细胞功能的进一步研究发现,脂肪组织是连接肥胖、IR和代谢综合征的重要桥梁,其分泌的VP、LEP和APN是参与或加重IR发生的重要机制,这也为PCOS的病因学和治疗学提供了新的视点。
盐酸吡格列酮(pioglitazone)是2001年在我国上市的新一代噻唑烷二酮类药物,是一种胰岛素增敏剂,能高选择性地激动脂肪、骨骼肌和肝脏等Ins所作用组织的增殖激活受体γ(PPARγ),从而调节Ins应答基因的转录,能改善肝脏及外周组织对胰岛素的敏感性,增强外周组织对葡萄糖的转运、改善胰岛B细胞功能及调控脂肪细胞以影响脂源性细胞因子的表达和分泌而达到消除IR和降低血糖的作用。本研究结果显示,34例肥胖的PCOS患者服用吡格列酮12周后,多毛症状得到明显改善,卵泡总数和卵巢体积显著下降,BMI、WHR有所下降,但无统计学差异。治疗后,LH、LH/FSH、T显著降低,空腹血糖、空腹胰岛素及HOMA-IR较治疗前明显下降,与国内外研究报道一致[5,6]。说明吡格列酮能提高肥胖型PCOS患者全身的胰岛素敏感性,降低胰岛素水平,改善糖脂代谢异常,进而改善卵巢的微环境。
VF是2005年由日本学者 Fukuhara等[7]从人和小鼠的内脏脂肪中提取出的一种新的脂肪细胞因子。它有类胰岛素样作用,能降低血糖,并促进脂肪组织的分化。另外,VF具有调节炎症反应和免疫反应的作用。新近发现其在内脏脂肪中特异性高表达,且与肥胖相关。体外研究显示VF在3T3-L1脂肪细胞和L6肌肉细胞内影响葡萄糖的代谢,同时也影响着脂肪细胞的分化,与内脏脂肪聚集紧密相关[8]。PCOS通常与肥胖、胰岛素抵抗、糖耐量受损(IGT)、T2DM相关联,并且增加IGT和T2DM的发病风险[9]。根据目前研究,VF与PCOS关系尚未清楚。多数资料显示PCOS妇女表现出比正常妇女更高的血浆VF水平,血浆VF水平和BMI有一定的相关性,且不直接受 FSH、LH 等激素的调节[10,11]。本研究结果显示治疗12周后血清VF水平显著下降,表明吡格列酮可能抑制了体内VF分泌。
LEP是肥胖基因编码的蛋白质,近年来研究认为其具有调节生殖和糖脂代谢等广泛的生物学作用,与肥胖、IR、不孕等密切相关[12]。因此在 PCOS的研究中备受关注。Atamer等[13]研究显示,在PCOS患者中,无论肥胖与否,其血清LEP浓度显著高于相同BMI的正常排卵周期妇女。本研究观察到吡格列酮能降低血清LEP水平,但BMI下降无显著性差异,这与国内学者的研究结果相似[14]。肥胖者的体脂分布可能是瘦素水平的独立影响因素[15],吡格列酮正是通过改善PCOS患者的脂肪分布模式,进而影响LEP水平。目前普遍研究认为,PCOS患者可能同时存在胰岛素抵抗和瘦素抵抗[16]。Maliqueo等[17]报道,LEP通过与下丘脑中LEP-R结合能刺激下丘脑及垂体释放促性腺激素释放激素(GnRH)与LH,调节LH的峰位分泌,从而导致PCOS性不排卵和月经紊乱。本研究显示吡格列酮治疗肥胖PCOS患者改善IR的同时能降低LEP水平,从而促进排卵周期的恢复和妊娠。
APN是由脂肪细胞分泌的一种的糖蛋白,是目前发现脂肪组织分泌最多的具有保护性的脂肪细胞激素,其具有调节糖脂代谢、增强胰岛素敏感性、抗炎及抗动脉粥样硬化的作用。有研究提出,在肥胖和非肥胖PCOS患者中明显存在低APN血症,同时存在不同程度的 IR[18]。APN主要通过活化 AMP活化蛋白激酶(AMPK)信号途径,增加葡萄糖的利用及游离脂肪酸氧化,提高胰岛素敏感性,抑制TNF-α 信号,改善 IR[19]。动物研究发现 TZDs治疗使ob/ob小鼠及高脂饮食所致IR小鼠APN RNA表达增加,循环APN水平升高[20]。本研究观察到吡格列酮治疗12周后患者HOMA-IR下降,血APN水平增高,提示吡格列酮可改善IR,并能增加血APN水平。同时推断吡格列酮对APN表达水平影响可能与PPAR受体激活及改变体脂分布有关。
本研究中,应用盐酸吡格列酮治疗肥胖型PCOS患者,可改善生殖环境,提高排卵功能,同时纠正高雄激素血症和IR。血清APN水平升高,而VF及LEP水平降低,表明其参与IR及肥胖的发生发展。提示吡格列酮通过激活PPARγ,不仅改善糖脂代谢,而且调控脂肪因子表达,改善能量代谢及卵巢功能,从而治疗PCOS。
[1]韩晓芬,钟雪梅.多囊卵巢综合征胰岛素抵抗的研究进展[J].西南军医,2009,11(1):76-78.
[2]The Rotterdam ESH RE/ASRM Sponsored PCOS Consensus Workshop Group.Revised 2003 consensus on diagnostic criteria and long-term health risked related to polycystic ovary syndrome[J].Fertil Steril,2004,81(1):19-25.
[4]Ovalle F,Azziz R.Insulin resistance,polycystic ovary syndrome and type 2 diabetes mellitus[J].Fertil Steril,2002,77(6):1095-1105.
[5]Narsing R L,Jacob JJ,Paul TV,et al.Effects o f pioglitazoneonm enstrual frequency,hyperandrogenism and insulin resistance in adoloscents and young adults with polycystic ovary syndrome[J].J Pediatr Adolesc Gynecol,2009,22:91-95.
[6]宋青,苟文丽.吡格列酮治疗肥胖型多囊卵巢综合征前后血清抵抗素和脂联素的变化[J].现代妇产科进展,2010,19(2):129-132.
[7]Fukuhara A,Matsuda M,Nishizawa M,et al.Visfatin:a protein secreted by visceral fat thatmimics the effects of insulin[J].Science,2005,307(5708):426-430.
[8]Ognjanovic S,Bryant-Greenwood GD.Pre-B cell colony-enhancing factor,a novel cytok-ine of human fetalm embranes[J].Am J Obstet Gynecol,2002,187:1051-1058.
[9]C henMP,Chung FM,Chang DM,et al.Elevated plasma level of visfatin/pre-b cell colony-enhancing factor in patients with type 2 diabetes mellitus[J].J Clin Endocrinol Metab,2007,76:24-29.
[10]李昌周,于新艳.血浆内脂素和多囊卵巢综合征关系的研究进展[J].生殖与避孕,2008,28(4):232-235.
[11]Panidis D,Farmakiotis D,Rousso D,et al.Plasma visfatin levels in normal weight women with polycystic ovary syndrome[J].Eur J Inter Med,2008,19:406-412.
[12]Satoh N,Ogawa Y,Katsuura G,et al.Sympathetic activation of leptin via the ventromedial hypothalamus:leptin-induced increase in catecholamine secretion[J].Diabetes,1999,48:1787-1793.
[13]Atamer A,Demir B,Bayhan G,et al.Serumlevel s of leptin and homocysteine in women with polycystic ovary syndrome and its relat ion ship to endocrine,clinical and metabolic parameters[J].J Int Med Res,2008,36(1):96-105.
[14]王炼炼,丘彦,桂文武,等.瘦素在胰岛素增敏剂治疗多囊卵巢综合征中的相关研究[J].重庆医科大学学报,2007,32(2):147-153.
[15]Vicennati V,Gambineri A,Calzoni F,et al.Serumleptin in obese women with polycystic ovary syndrome is correlated with body weight and fat distribution but not with androgen and insulin levels[J].Metabolism,1998,47(8):988-992.
[16]朱临萍.多囊卵巢综合征患者瘦素、脂联素、肿瘤坏死因子-α与胰岛素抵抗的相关性[J].中国妇幼保健,2008,23(18):2570-2571.
[17]Maliqueo M,Piwonka V,Perez-Bravo F,et al.Evaluation of acute effect of GnRH administra-tion on leptin secretion in normal and hyperandrogenic women[J].Rev Med Chil,2000,128(5):460-466.
[18]张宁,石玉华,陈子江,等.血清脂联素水平测定在多囊卵巢综合征中的意义[J].实用妇产科杂志,2007,23(3):154-156.
[19]Yamauchi T,Kamon J,Minokoshi Y,et al.Adiponectin stimulates glucose utilization and fatty-acid oxidation by activating AMP-actived protein Kinase[J].Nature Med,2002,8(11):1288-1295.
[20]Combs TP,Wagner JA,Berger J,et al.Induction of adipocyte complement related protein of 30 kilodaltons by PPARgamma agonists:apotential mechanism of insulin sensitization[J].Endocrinology,2002,143(3):998-1007.

