乳白蚁属Coptotermes 分子分类研究进展
丁俊杰,喻 敏,刘志文,权永兵,庞正平,平正明,王建国*
(1.江西农业大学农学院,南昌 330045;2.江苏常州市武进区白蚁防治所,江苏常州 213159;3.广东省昆虫研究所,广州 510260;4.江苏无锡江阴市白蚁防治所,无锡 214400)
乳白蚁属Coptotermes 隶属等翅目Isoptera 鼻白蚁科Rhinotermitidae,主要分布在热带和亚热带地区,其生活隐蔽,繁殖迅速,破坏力极强,危害范围十分广泛,在世界上引起许多国家的广泛关注(李桂祥,1988;平正明,1996;黄复生,2000)。Rust & Su(2012)描述了世界乳白蚁主要危害种的分布及防治策略。乳白蚁不仅危害农林作物,蛀食多种坚硬的木材,甚至为害含纤维素的木材加工品如纸、棉布、皮革制品等,还能危害地下通讯电缆等的塑料保护层,更重要的是它在传入或输出后能在新的地域快速建群、繁殖、扩散,给新的地域造成损失和危害。目前,在世界主要白蚁分布区中,中国共有乳白蚁22种(黄复生,2000;Li,2011),印度-马来西亚19种,澳洲10种,泰国5种,马来西亚5种,印度尼西亚和西伊朗3种,巴布亚新几内亚等太平洋岛屿8种,非洲6种(马达加斯加1种),中、南美洲3种(Kambhampati and Eggleton,2000)。
1 乳白蚁属传统分类鉴定的难度及存在的问题
乳白蚁种类的形态鉴定比较困难,这与白蚁自身的形态结构和特性是密切相关的。白蚁是典型的多形态社会性巢居昆虫,蚁巢结构精密,在同一个群体中同时存在不同品级和多种虫态,促使白蚁的形态有着各种各样复杂的变化。同一个种、同一个巢群,不同个体由于分工不同,其形态特征截然不同(李桂祥,2002);其次,白蚁寿命长,个体从低龄到高龄,体形大小上有明显差异,直至蚁巢成熟才趋于稳定;再次,由于白蚁多在地下或被害物内等隐蔽场所活动,一生中大部分时间在黑暗的隐蔽环境中活动,产生了强烈的趋同现象,造成白蚁的外部形态特征相似,体壁柔软,骨化程度低,能够用于分类鉴定的性状非常少。此外白蚁的生殖隔离机制主要不是通过生殖器官的结构来完成的,白蚁有翅繁殖蚁生殖器,无论雌、雄均为几块简单的骨片,分类鉴定时无法采用生殖器的特征。目前白蚁主要形态特征分类依据是兵蚁和有翅成虫个体的度量数据,这需要对大量个体的测量数据进行统计分析,而且严重易受人为因素的干扰。同时,受环境和地理条件的影响也相当大,不同地理种群的白蚁在形态数据的测量上也不尽一致,难以可靠地分析和鉴别近似种间存在的差异,导致实际鉴定过程中可靠性低,准确性差。因此白蚁种类识别困难,人为分类现象严重,同物异名现象普遍(Kambhampati and Eggleton,2000),这一定程度上阻碍了白蚁分类学的发展。世界著名的白蚁分类学家Holmgren(1913)就认为,乳白蚁属下各种,彼此特征极相类似,鉴定工作非常困难。
2 分子分类的优势
传统形态分类学的局限性导致乳白蚁分类混乱的现象长久以来都没有彻底解决,而基于分子生物技术对乳白蚁进行分类鉴定的研究取得了很好的进展。
传统的形态分类累积了很多如同物异名、鉴定错误等问题。随着生物技术的发展,从分子生物领域对无法界定和界定模糊的乳白蚁种类重新鉴定和分类,对白蚁分类学具有非常重要的推动作用。由于各虫态子代白蚁的基因来自相同母体,故基因的变异概率很低,同一巢群的任何品级和各种虫态所获得的DNA 序列均可代表该群体的遗传信息。因此利用分子生物学技术进行白蚁鉴定,对白蚁虫态、品级没有太多要求。分子生物学技术对样品数量要求也非常少,单头白蚁只需部分腹部体壁即可提取到足够的DNA 模板,达到了非损伤性取样目的,而剩余的白蚁标本并不会影响形态特征的核定。
应用分子生物学技术进行白蚁分类也使得鉴别种类容易、准确和快速;鉴定白蚁种类分子标记的使用增加了样品中鉴定的敏感性,加快了鉴定的速度;生物技术直接检测白蚁的基因组,排除了环境变化的影响,从而达到了快速准确地鉴定白蚁种类的目的。需要强调的是,现代分子技术虽然为白蚁的快速准确鉴定提供了可能,但在进行白蚁鉴定研究时仍然需要以传统的形态分类作为研究的基础,两种方法相互印证才能达到较好效果。
3 乳白蚁属分子分类进展
分子生物学技术的发展对乳白蚁属Coptotermes系统发育和分类鉴定研究提供了新的思路并且取得良好进展。DNA 测序、微卫星标记(SSR)等PCR 及其相关技术已应用到白蚁的近似种鉴定上(王建国,2004;Hussendeder et al.,2005;杨嘉理,2010;丁俊杰,2013)。这些分子生物技术在白蚁分类鉴定方面取得探索性的研究成果。
3.1 微卫星标记
Thompson 等(2000)利用微卫星技术对C.lacteus 进行了研究。Vargo 等(2000)对台湾乳白蚁17个地理种群进行微卫星多态位点鉴定,找到15个微卫星标记,为调查本地种和入侵种的遗传结构提供了敏感的工具。利用微卫星标记研究了入侵日本九州,福江两岛的台湾乳白蚁种群遗传结构,结果和最近的遗传瓶颈并无明显差异,说明两地白蚁入侵已有超过300年的历史(Vargo et al.,2003)。Yeap 等(2009)开发了11个微卫星位点的引物,并用于对亚洲格斯特乳白蚁28个种群的鉴定分析,为种群内和种群间遗传结构分析提供了有利帮助。利用微卫星标记对采自美国,台湾地区,东南亚5 国的85个格斯特乳白蚁种群进行遗传多样性研究。结果表明85个种群分为四个大支,台湾地区格斯特乳白蚁由菲律宾引入(Yeap et al.,2011)。
3.2 序列系统发育分析方法
乳白蚁作为对人类生活环境和自然环境危害最严重的一类白蚁,其起源分析和全球范围的传播扩散路径分析,对乳白蚁的预防控制具有重要的意义。而基于分子生物信息的乳白蚁系统发育分析和分类研究的基础工作尤为重要,历来受到学者的广泛关注。
3.2.1 线粒体基因
线粒体DNA(mitochondrial DNA,mtDNA)具有相对分子质量小,严格母性遗传,世代间不发生重组,易于提纯和遗传标记丰富等特点,被广泛应用于动物起源、分类、系统进化、群体遗传结构和育种等方面的研究(Simon,1994)。其包含的基因诸如细胞色素氧化酶亚基I,Ⅱ(COI,COⅡ),16S 核糖体RNA(16S rRNA)基因,12S核糖体RNA(12S rRNA)基因等被许多专家应用于乳白蚁分子鉴定和系统发育分析。
Jenkins 等(2002)利用COⅡ基因序列推断台湾乳白蚁入侵危害的来源。揭示了台湾乳白蚁14个地理种群的8个特殊支系,其中中国广东新会种群和夏威夷种群接近。Austin 等(2006)利用COⅡ基因,结合地理系统学对台湾乳白蚁从中国、日本等东南亚地区传入夏威夷和美国本土的路径,进行了详细的研究,研究首次证实了台湾乳白蚁传入美国本土的路径有两条。Lo 等(2006)根据线粒体COⅡ基因对澳大利亚的乳白蚁属种类进行系统发育分析,发现澳洲乳白蚁 C.lacteus Froggatt、大唇乳 蚁 C.frenchi Hill 和 C.michaelseni Silvestri 各自形成紧密关系的单系群,而短刀乳白蚁C.acinaciformis Froggatt 则没有,该种C.acinaciformis 可能是复合种。某些澳大利亚的种类和某些亚洲种类的关系更紧密。Gentz 等(2008)利用COⅡ基因标记对美国本土及夏威夷的台湾乳白蚁种群进行系统发育分析,结果表明均源自亚洲。Long 等(2009)利用微卫星标记和COⅡ基因,对包括台湾乳白蚁在内的中国东部5种白蚁进行系统发育分析,所有样本形成两个分支。Zhu 等(2010)对密西西比州南部地区台湾乳白蚁COⅡ基因片段的碱基组成和含量进行了分析,结果显示台湾乳白蚁至少两次传入美国。Martins 等(2010)基于COⅡ基因对巴西格斯特乳白蚁的起源进行推论,并且报道了三个新的分布地,扩展了格斯特乳白蚁的分布。王新国等(2012)基于不同兵蚁形态和COI 基因对台湾乳白蚁进行比较研究,COI 数据佐证了形态学研究结果。Scheffrahn 等(2004)利用16S rRNA 标记证明来自西非的乳白蚁Coptotermes sjostedti 通过海上运输贸易入侵到法属瓜德罗普岛。Li 等(2009)利用COⅡ,12S rRNA 和16S rRNA 研究了台湾地区格斯特乳白蚁和台湾乳白蚁的谱系地理学,结果表明台湾有可能是台湾乳白蚁的起源中心,格斯特乳白蚁是外来引进的。张卫东等(2010)针对6种乳白蚁16S rRNA 构建系统发育树,结果显示塞庞乳白蚁C.sepangensis 与曲颚乳白蚁C.curvignathus 关系最近,台湾乳白蚁C.formosanus与广州乳白蚁C.guangzhouensis 遗传距离为0.000,存在同物异名的可能。同时明确了乳白蚁不同种之间的亲缘关系和变异程度,以及在系统进化中的地位。
王建国(2004)利用COⅡ基因和16S rRNA基因分别构建系统发育树,分析中国广东8个台湾乳白蚁种群和美国夏威夷、泰国的台湾乳白蚁,结果显示序列完全一致,另外三个美国种群(新奥尔良、佐治亚州和德克萨斯州)单独构成一枝,但与其他种群的遗传距离很小,说明美国三地的台湾乳白蚁种群在当地建群后,适应生态环境,在遗传上发生了一定的变异。又利用这两个基因对来自巴布亚新几内亚的端明乳白蚁C.elisae 和马来西亚的曲颚乳白蚁C.curvignathus 进行分析,构建系统进化树,发现他们聚合形成一个单系群,4个进化枝间的遗传距离非常接近,支持端明乳白蚁与曲颚乳白蚁为同一物种。Yeap 等(2007)对来自东南亚地区的9个格斯特乳白蚁C.gestroi种群和4个菲岛乳白蚁C.vastator种群的COⅡ、12S rDNA 和16S rDNA 基因序列进行了系统发育分析,结果发现所有的C.gestroi 和C.vastator种群的基因没有任何差别,确定后者为前者的一个同物异名。Ghesini 等(2011)利用COⅡ和16S rDNA 基因鉴定并首次报道了在意大利发现格斯特乳白蚁。Hausberger 等(2011)结合传统形态学分类,利用COI,COⅡ,28S rDNA 标记基因对西非大草原白蚁多样性进行鉴定研究(包括乳白蚁属)。他指出传统分类方法并不可靠,亟需可靠的现代生物技术解决。
3.2.2 核内标记ITS
编码核糖体RNA 的基因(rDNA-ITS)是真核生物中最为保守的结构基因。ITS 标记在种内的稳定性及种间的差异,使得该标记成为近年来用于乳白蚁遗传变异、系统进化及分子鉴定研究的一个热点。
王建国(2004)基于ITS1 序列对中国台湾乳白蚁五个地理种群进行比较,结果序列完全相同,暗示ITS1 序列可用于白蚁种类的分子鉴定。张卫东等(2012)证实,大家白蚁、台湾乳白蚁和黄胸散白蚁不同品级间的ITS 序列并无差异,排除了标记基因本身在不同种群和虫态之间存在差异而导致对遗传分析准确性的干扰。利用口岸截获的5种乳白蚁核基因ITS 序列构建系统发育树,结果显示曲颚乳白蚁C.curvignathus 和塞庞乳白蚁C.sepangensis 关系最近,婆罗乳白蚁C.borneemsis 与其他种进化距离最远。权永兵(2012)扩增得到7种乳白蚁ITS 序列,通过构建系统发育树明确其亲缘关系,并指出ITS 区基因可成为乳白蚁属内种类分类鉴定的理想目标基因,但不适用于不同地理种群间的系统进化分析。
3.2.3 线粒体基因与核内标记联合使用
Jenkins 等(2007)通过16S rRNA,COⅡ和ITS 标记明确了波多黎各、美国俄亥俄州、佛罗里达和澳大利亚的布里斯班新发现的C.gestroi 的来源,新加坡和马来西亚极有可能分别是俄亥俄州和澳大利亚的格斯特白蚁种群的发源地。丁俊杰(2013)基于COI,COⅡ,16S rRNA 和ITS 四种标记对中国10种乳白蚁进行研究,结果显示10种乳白蚁最终应合并为两种,即台湾乳白蚁和格斯特乳白蚁,并推测中国乳白蚁属仅有两个复合种,并无亚属之分。
4 乳白蚁属现有核苷酸序列信息
美国国家生物技术信息中心NCBI(National Center for Biotechnology Information),旨在建立关于分子生物学、生物化学、和遗传学知识存储和分析的自动系统。全球学者皆可将所得生物分子信息上传共享,因而其收录了世界上最全的生物分子信息,包括乳白蚁属最全的基因序列信息。截止2014年4月2 日,网站共收录34个上传的乳白蚁属分类单位,24个为定名种类,10个为未定名种。用于乳白蚁分子鉴定及系统发育分析的核苷酸序列837 条(如表1 所示),这其中序列数量最多的种类依次是台湾乳白蚁C.formosanus 384条,格斯特乳白蚁C.gestroi 181 条,短刀乳白蚁C.acinaciformis 49 条,印巴乳白蚁C.heimi 45 条,澳洲乳白蚁C.lacteus 43 条,曲颚乳白蚁C.curvignathus 19 条。所有标记基因中又以CO Ⅱ,16S rRNA,COI 和12S rRNA 基因标记的数量最多(如图1 所示)。
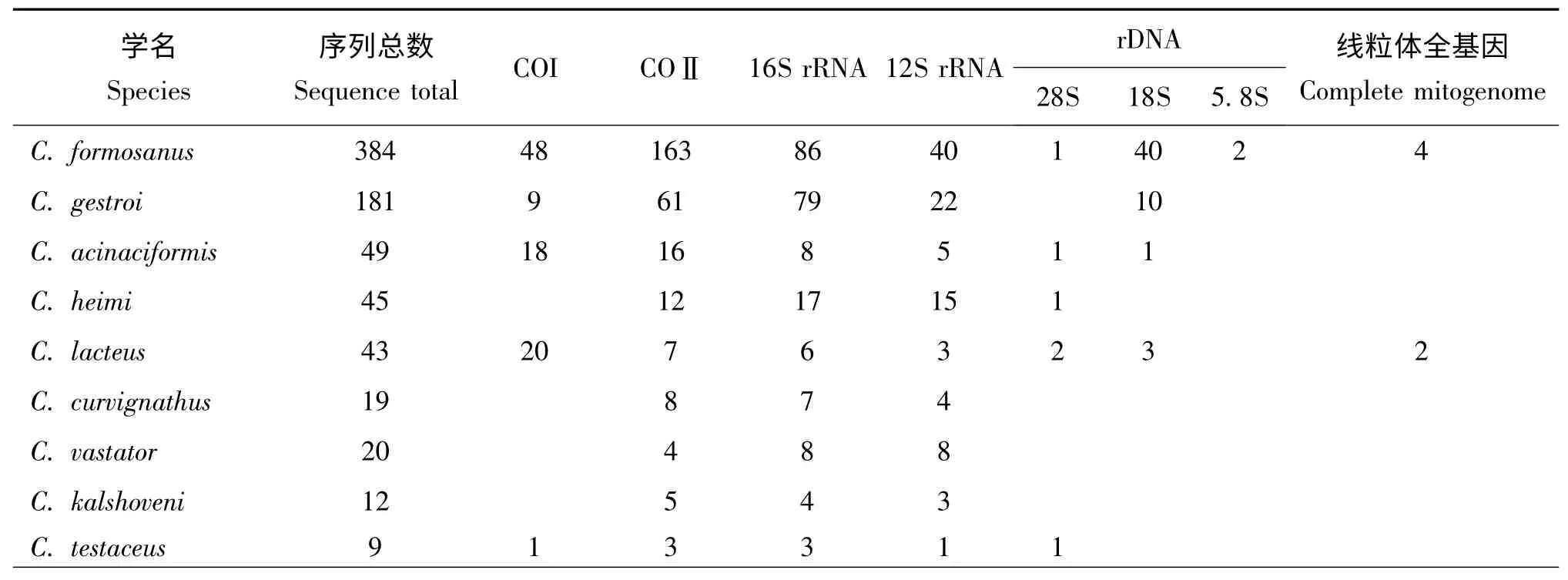
表1 乳白蚁属Coptotermes 现有序列信息表Table 1 Sequences of the genus Coptotermes in NCBI before Feb.26,2014

(续上表)
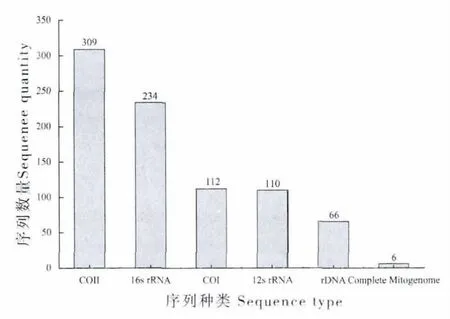
图1 乳白蚁分子分类和系统发育分析所用主要遗传标记Fig.1 Genetic markers used in Coptotermes classification and systematic analysis
5 展望
5.1 DNA 条形码技术在乳白蚁属分类中的应用
利用分子生物学技术对昆虫进行分类鉴定是形态分类的重要补充手段,可弥补形态鉴定之不足,实现快速、准确鉴定。Hebert 等(2003a)提出用线粒体细胞色素氧化酶亚基I(COI)基因作为DNA 条形码运用于生物分类研究。此后以COI基因作为DNA 条形码的应用研究已逐步深入。DNA 条形码技术在鳞翅目(Hajibabaei et al.,2006;Burns et al.,2007;2008)、鞘翅目(Monaghan et al.,2005)、蜉蝣目(Ball et al.,2005;Alexander et al.,2009)、半翅目(Ball and Armstrong,2007)、双翅目(范京安等,2009)等昆虫鉴定中得到了很好的应用,而且该技术在种间亲缘关系,隐存种发现等研究中有很大的作用,得到了许多学者的肯定和支持(Hebert,2003b;Schindel and Miller,2005;Aravind et al.,2007;Hollongsworth,2007),但也有一些学者持反对意见(Lipscomb,2003;Seberg,2003;Will and Rubinof,2004;Ebach and Holdrege,2005;Malte and Craig,2005;Marshall,2005)。DNA 条形码技术是否适用于乳白蚁属种类鉴定及系统发育分析未见报道。NCBI 中目前收录乳白蚁COI 序列数量为112 条,数量及种类都比较少,还需要充实COI数据量。
Mallet 和Willmott(2003)建议最好应用多个基因片段区分形态相似的物种,而不是单一的基因,而且有研究认为,COI 基因不适合有些类群的鉴定(Hebert,2003;Vences,2005)。由此可见,针对不同的生物类群,选择不同的基因片段或者增加多个片段也是十分必要的。要找到决定不同白蚁种间差异的目标基因,进行白蚁各种间分化的分子机制研究,具有很大的挑战性。目前NCBI中收录的乳白蚁分子信息仍然较少,分子信息集中于某个种或某个基因,亟需扩充其他种类的分子信息数据。
5.2 线粒体全基因组用于乳白蚁分类
线粒体全基因组包含基因多,信息量大,可使白蚁种类鉴定及系统发育分析更准确。Tokuda等(2011)上传了台湾乳白蚁C.formosanus 线粒体全基因序列并建议进行线粒体全基因组测序用于乳白蚁种类鉴定。Cameron 等(2012)获得澳洲乳白蚁C.lacteus 线粒体全基因序列。这为乳白蚁属基于分子信息学对近似种进行修订以及发掘隐含种提供了坚实基础。
本团队基于传统形态学方法,通过研究中国乳白蚁种类的线粒体细胞色素氧化酶I(COI)基因、线粒体细胞色素氧化酶Ⅱ(CO Ⅱ)基因、16S rRNA 基因以及核糖体转录间隔区(ITS)等标记,分别进行同源性分析,分子系统学分析,以期对中国乳白蚁属疑似的同物异名种进行重新厘定,明确其分类地位,为中国乳白蚁属在分子水平上的分类和近缘种的鉴别提供理论依据和技术支持。目前获得乳白蚁COI 基因序列8种37 条(GeneBank 登录号 KC887191-KC887227),COⅡ基因序列10种47 条(GeneBank 登录号为KC515403-KC515449),16S rRNA 基因序列9种46 条(GeneBank 登录号为KC887100-KC887145)和ITS 基因序列10种45 条(GeneBank 登录号为KC887146-KC887190)。初步结果显示我国乳白蚁属可能仅有2个乳白蚁复合种,即台湾乳白蚁,格斯特乳白蚁。
研究结果可应用于乳白蚁的鉴定,对有效抵御外来有害生物的入侵,保护我国农林业生产安全,维持生态平衡,保证公共卫生安全都有极为重要的意义。研究成果将对我国乳白蚁属的分类鉴定作出一定的贡献,产生积极的社会价值和经济价值。分子生物技术的快速发展将促使白蚁分类鉴定及系统发育分析等多项领域更广泛深入的发展。
References)
Alexander LC,Delion M,Hawthorne DJ,et al.Mitochondrial lineages and DNA barcoding of closely related species in the mayfly genus Ephemerella(Ephemeroptera:Ephemerellidae)[J].Journal of the North American Benthological Society,2009,28(3):584-595.
Aravind K,Ravikanth G,Shaanker RU,et al.DNA barcoding:An exercise in futility or utility[J].Current Science,2007,92(9):1213-1216.
Austin JW,Szalanski AL,Scheffrahn RH,et al.Genetic evidence for two introductions of the Formosan subterranean termite,Coptotermes formosanus(Isoptera:Rhinotermitidae),to the United States[J].The Florida Entomologist,2006,89(2):183-193.
Ball SL,Armstrong KF.Using DNA barcodes to investigate the taxonomy of theNew Zealand sooty beech scale insect[A].Doc Research &Development Swries 287.Department of Conservation,Welligton,2007:1-14.
Ball SL,Hebert PDN,Burian SK,et al.Biological identification of mayflies(Ephemeroptera)using DNA barcodes[J].Journal of the North American Benthological Society,2005,24(3):508-524.
Burns JM,Janzen DH,Hajibabaei M,et al.DNA barcodes of closely related(but Morphologically and ecologically destinct)species of skipper butterflies(Hesperiidae)can differ by only one to three nucleotides[J].Journal of the Lepidopterists' Society,2007,61(3):138-153.
Burns JM,Janzen DH,Hajibabaei M,et al.DNA barcodes and cryptic species of skipper butterflies in the genus Perichares in Area de Conservacion Guanacaste,Costa Rica[J].Proceedings of the National Academy of Sciences,2008,105(17):6350-6355.
Cameron SL,Lo N,Bourguignon T,et al.A mitochondrial genome phylogeny of termites(Blattodea:Termitoidae):Robust support for interfamilial relationships and molecular synapomorphies define major clades[J].Molecular Phylogenetics and Evolution,2012,65(1):163-173.
Ding JJ.Revision of the genus Coptotermes(Isoptera:Rhinotermitidae)in China[D].Nan Chang:Jiangxi Agricultural University,2013,1-55.[丁俊杰.中国乳白蚁属分类修订研究[D].南昌,江西农业大学,2013,1-55]
Ebach MC,Holdrege C.More Taxonomy,Not DNA barcoding[J].BioScience,2005,55(10):822-823.
Fan JA,Gu HF,Chen SJ,et al.Species Identification of 36 Kinds of fruit flies based on minimalist-barcode[J].Chinese Journal of Applied & Environmental Biology.2009,15(2):215-219.[范京安,顾海丰,陈世界,等.DNA 条形码识别Ⅵ:基于微型DNA 条形码的果实蝇物种鉴定[J].应用与环境生物学报,2009,15(2):215-219]
Gentz MC,Rubinoff D,Grace JK.Phylogenetic analysis of subterranean termites(Coptotermes spp.,Isoptera:Rhinotermitidae)indicates the origins of Hawaiian and North American invasions:potential implications for invasion biology[J].Proceedings,Hawaiian Entomological Society,2008,40:1-9.
Ghesini S,Puglia G,Marini M.First report of Coptotermes gestroi in Italy and Europe[J].Bulletin of Insectology,2011,64(1):53-54.
Hajibabaei M,Janzen DH,Burns JM,et al.DNA barcodes distinguish species of tropical Lepidoptera[J].Proceedings of the National Academy of Sciences of the United States of America,2006,103(4):968-971.
Hausberger B,Kimpel D,Neer A,et al.Uncovering cryptic species diversity of a termite community in a West African savanna[J].Molecular Phylogenetics and Evolution,2011,61(3):964-969.
Hebert PDN,Cywinska A,Ball SL,et al.Biological identifications through DNA barcodes[J].Proceedings of the Royal Society of London.Series B:Biological Sciences,2003a,270:313-321.
Hebert PDN,Ratnasingham S,Waard JR.Barcoding animal life:cytochromeCoxidase subunit I divergences among closely related species[J].Proceedings of the Royal Society of London.Series B:Biological Sciences,2003b,270(Suppl.1):96-99.
Hollongsworth PM.DNA barcoding:potential users[J].Life Sciences,Society and Policy,2007,3(2):44-47.
Holmgren N.Termitenstudien 4,Versush einer systematischen Monographic der Termiten der orientalischen Region[J].K Svensk Akad Handl,1913,50(2):1-276.
Huang FS,Zhu SM,Ping ZM,et al.Fauna Sinica Isecta.Vol.17,Isoptera[M].Beijing:Science Press.2000.[黄复生,朱世模,平正明,等.中国动物志·昆虫纲·第十七卷·等翅目[M].北京:科学出版社,2000]
Hussendeder C,Messenger MT,Su NY,et al.Colony social organization and population genetic structure of anint roduced population of formosan subterranean termite from New Orleans,Louisiana[J].Journal of Economic Entomology,2005,98(5):1421-1434.
Jenkins TM,Dean RE,Forschler BT.DNA technology,interstate commerce,and the likely origin of Formosan subterranean termite(Isoptera:Rhinotermitidae)infestation in Atlanta,Georgia[J].Journal of Economic Entomology,2002,95(2):381-389.
Jenkins TM,Jones SC,Lee CY,et al.Phylogeography illuminates maternal origins of exotic Coptotermes gestroi(Isoptera:Rhinotermitidae)[J].Molecular Phylogenetics and Evolution,2007,42(3):612-621.
Kambhampati S,Eggleton P.Taxonomy and phylogeny of termites[A].In:Abe T,Bingell DE,Higashi M,Eds.Termites:Evolution,Sociality,Symbioses,Ecology.Berlin:Academic Press,2000,1-9.
Li GX.Introduction of termitological research in the world[J].Science and Technology of Termites,1988,5(1):1-7.[李桂祥.世界白蚁学研究的概况[J].白蚁科技,1988,5(1):1-7]
Li GX.Chinese Termites and Their Control[M].Beijing:Science Press,2002.[李桂祥.中国白蚁及其防治[M].北京:科学出版社,2002]
Li HF,Ye W,Su NY,et al.Phylogeography of Coptotermes gestroi and Coptotermes formosanus(Isoptera:Rhinotermitidae)in Taiwan[J].Annals of the Entomological Society of America,2009,102(4):684-693.
Li ZQ,Liu BR,Li QJ,et al.Two new synonyms of Coptotermes gestroi(Wasmann)(Isoptera:Rhinotermitidae)in China[J].Sociobiology,2011,58(2):449-454.
Lipscomb D,Platnick N,Wheeler Q.The intellectual content of taxonomy:a comment on DNA taxonomy[J].Trends in Ecology and Evolution,2003,18(2):63-65.
Lo N,Eldridge RH,Lenz M.Phylogeny of Australian Coptotermes(Isoptera:Rhinotermitidae)species inferred from mitochondrial COⅡsequences[J].Bulletin of Entomological Research,2006,96(4):433-437.
Long YH,Xiang H,Xie L,et al.Intra-and inter-specific analysis of genetic diversity and phylogeny of termites in East China detected by ISSR and COⅡmarkers[J].Sociobiology,2009,53(1):1-20.
Mallet J,Willmott K.Taxonomy:renaissance orTower of Babel?[J].Trends in Ecology & Evolution,2003,18(2):57-59.
Malte CE,Craig H.DNA barcoding is no substitute for taxonomy[J].Nature,2005,434:697.
Marshall ET.Will DNA barcodes breathe life into classcification?[J]Science,2005,307:1037.
Martins C,Fontes LR,Bueno OC,et al.Coptotermes gestroi(Isoptera:Rhinotermitidae)in Brazil:possible origins inferred by mitochondrial cytochrome oxidase Ⅱgene sequences[J].Genome,2010,53(9):651-657.
Monaghan MT,Balke M,Gregory TR,et al.DNA-based species delineation in tropical beetles using mitochondrial and nuclear markers[J].Philosophical Transactions of the Royal Society B:Biological Sciences,2005,360:1925-1933.
Ping ZM,Xu YL.The list of termites intercepted in China[J].Plant Quarantine,1996,10(3):170-171.[平正明,徐月莉.我国截获的国外白蚁名录[J].植物检疫,1996,10(3):170-171]
Quan YB.Phylogeny and Molecular Detcetion of Coptotermes(Isoptera:Rhinotermitidae)[D].Nan Chang,Jiangxi Agricultural University.2012,1-51.[权永兵.检疫性乳白蚁系统发育及分子鉴定技术研究[D].南昌:江西农业大学,2012,1-51]
Rust MK,Su NY.Managing social insects of urban importance[J].Annual Review of Entomology,2012,57:355-375.
Scheffrahn RH,Krecek J,Maharajh B,et al.Establishment of the African termite,Coptotermes sjostedti(Isoptera:Rhinotermitidae),on the island of Guadeloupe,French West Indies[J].Annals of the Entomological Society of America,2004,97(5):872-876.
Schindel DE,Miller SE.DNA barcoding,a useful tool for taxonomists[J].Nature,2005,435:17.
Seberg O,Humphries CJ,Knapp S,et al.Shortcuts in systematics?A commentary on DNA-based taxonomy[J].Trends in Ecology and Evolution,2003,18(2):63-65.
Simon C,Frati F,Beckenbach A,et al.Evolution,weighting and phylogenetic utility of mitochondrial gene sequences and a compilation of conserved polymerase chain reaction primers[J].Annals of the Entomological Society of America,1994,87(4):652-701.
Thompson GJ,Lenz M,Crozier RH.Microsatellites in the subterranean,mound-building termite Coptotermes lacteus(Isoptera:Rhinotermitidae)[J].Molecular Ecology,2000,9(11):1932-1934.
Tokuda G,Isagawa H,Sugio K.The complete mitogenome of the Formosan termite,Coptotermes formosanus Shiraki[J].Insectes Sociaux,2011,59(1):17-24.
Vargo EL,Henderson G.Identification of polymorphic microsatellite loci in the formosan subterranean termite Coptotermes formosanus Shiraki[J].Molecular Ecology,2000,9(11):1935-1938.
Vargo EL,Hussender C,Grace JK.Colony and population genetic structure of the Formosan subterranean termite,Coptotermes formosanus,in Japan[J].Molecular Ecology,2003,12:2599-2608.
Vences M,Thomas M,Meijden A,et al.Comparative performance of the 16S rRNA gene in DNA barcoding of amphibians[J].Frontiers in Zoology,2005,2(5):1212.
Wang JG.Phylognetic Study of Termites Based on the Morphological and Molecular Approache[D].Guangzhou:Shouthen Chian Agricultral University.2004,1-142.[王建国.分子系统学方法在白蚁分类中的应用[D].广州:华南农业大学.2004,1-142]
Wang XG,Liang F,Xi GH,et al.Comparison of different isolates of Coptotermes formosanus soldiers based on morphologic characteristic and COI gene sequence[J].Journal of Zhongkai University of Agriculture and Engineering,2012,25(3):10-14.[王新国,梁帆,奚国华,等.台湾乳白蚁不同种群兵蚁形态学及COI基因序列比较[J].仲恺农业工程学院学报,2012,25(3):10-14]
Will KW,Rubin D.Myth of the molecule:DNA barcodes for species cannot replace morphology for identification and classification[J].Cladistics,2004,20(1):47-55.
Yang JL.Application of microsatellite in research of termites[J].Chinese Journal of Hygienic Insecticides & Equipments,2010,16(2):145-148.[杨嘉理.微卫星标记在白蚁研究中的应用[J].中华卫生杀虫药械,2010,16(2):145-148]
Yeap BK,Ahmad SO,Lee CY.Genetic Analysis of Population Structure of Coptotermes gestroi[J].Journal of Economic Entomology,2011,40(2):470-476.
Yeap BK,Othman AS,Lee CY.Identification of polymorphic microsatellite markers for the Asian subterranean termite Coptotermes gestroi(Wasmann)(Blattodea:Rhinotermitidae)[J].Molecular Ecology Resources,2009,1-7.
Yeap BK,Othman AS,Lee VS,et al.Genetic relationship between Coptotermes gestroi and Coptotermes vastator(Isoptera:Rhinotermitidae)[J].Journal of Economic Entomology,2007,100(2):467-474.
Zhang WD,Liao L,Wang L,et al.Sequences and phylogenetic relationship analyses of ITS gene illuminates 5 speices of Coptotermes[J].Guangdong Agriculture Science,2012,19:138-141.[张卫东,廖力,王岚,等.5种乳白蚁ITS 序列及系统发育关系分析[J].广东农业科学,2012,19:138-141]
Zhang WD,Xu MF,Liao L,et al.Phylogenetic analysis of genus Coptotermes(Isoptera:Rhinotermitidae)based on 16S rRNA gene[J].Entomotaxonomia,2010,32(2):93-99.[张卫东,徐淼锋,廖力,等.乳白蚁属部分种类16S rRNA 的分子系统发育关系[J].昆虫分类学报,2010,32(2):93-99]
Zhu YC,Sun JZ,Luo LL,et al.Identification of two haplotypes of cytochrome oxidase subunit Ⅱ(CO Ⅱ)gene of the Formosan subterranean termite,Coptotermes formosanus Shiraki(Isoptera:Rhinotermitidae),in southern Mississippi[J].Pest Management Science,2010,66(6):612-620.

