量子点荧光探针检测人舌鳞状细胞癌荷瘤裸鼠模型早期下颌下淋巴结转移的研究
李艳芬 陈坤
1.广东省深圳市宝安区妇幼保健院口腔科,深圳 518023;2.广东医学院附属医院口腔科,湛江 524023
舌癌是口腔颌面部最常见的恶性肿瘤,颈淋巴结转移是其主要的转移方式。下颌下淋巴结常常是舌癌区域性淋巴结首要转移(即前哨淋巴结)部位之一,如果能在术前或术中用微创方法将其送快速病理检查,根据其性质选择舌癌手术方式,对提高患者的生存及生活质量将有重要的意义。近年来,量子点(quantum dots,QDs)荧光探针以其独特的光学性质在生物学、医学领域,尤其在肿瘤学的生物成像技术研究中显示出了广阔的应用前景。国外已有将QDs运用于肿瘤的活体成像和前哨淋巴结成像[1-2],国内的相关研究还较少。本研究通过建立人舌癌荷瘤裸鼠下颌下淋巴结转移模型,用QDs标记的特异性角蛋白抗体QDs605-CK(AE1/AE3)荧光探针检测荷瘤裸鼠早期下颌下淋巴结的转移率及微转移率,并与传统的免疫组织化学染色(immunohistochemical staining,IHC)及苏木精-伊红(hematineeosin,HE)染色方法相比较,为舌鳞状细胞癌的早期诊断与治疗提供新的探索性的检测方法。
1 材料和方法
1.1 材料
1.1.1 肿瘤细胞与实验动物 人舌鳞状细胞癌Tca8113细胞株购自武汉大学中国典型培养物保藏中心。20只BALB/C-nu/nu 裸鼠购买于广西医科大学实验动物中心,在广东医学院无特殊病原体(specific pathogen free,SPF)级动物实验室的超净层流架中饲养,饲养环境为恒温(20~26 ℃)、恒湿(45%~50%)的洁净环境。20只裸鼠(2只因麻醉意外死亡)雌雄兼用,4~6周龄,质量为 20~24 g,自由摄入灭菌处理的水和饲料。实验在SPF条件下的超净工作台中进行。
1.1.2 主要试剂和仪器 鼠抗人细胞角蛋白(cytokeratin,CK)(广谱)单克隆抗体AE1/AE3、PV-9000二步法免疫组织化学试剂盒、DAB显色试剂盒(北京中杉金桥生物技术有限公司);QDs超敏荧光试剂盒(武汉珈源量子点技术开发有限公司):包括Tween 20、2%牛血清白蛋白(bovine serum albumin,BSA)、生物素化马抗鼠IgG、量子点标记的链霉亲和素QDs-SA复合物、0.1%Triton、缓冲甘油封固剂;RPMI 1640培养基和胰蛋白酶,胎牛血清(Gibco公司,美国);BX51型正置荧光显微镜、OLYMPUS显微镜(Olympus公司,日本)。
1.2 实验方法
1.2.1 人舌癌荷瘤裸鼠下颌下淋巴结转移模型的建立与标本制作 1)建立裸鼠下颌下淋巴结转移模型。裸鼠麻醉后,将传代培养的人舌癌Tca8113 细胞注射接种于裸鼠的舌体组织(不过中线),注射细胞悬液 0.1 mL,细胞密度为2×106·mL-1。隔日观察动物1次。注射接种瘤细胞后10~14 d,切除舌部移植瘤原发灶,行HE染色,以证实为裸鼠荷瘤组织。对切除肿瘤后的20只裸鼠创口用无创缝线缝合,术后继续饲养并观察动物(其中2只因麻醉意外死亡)。注入肿瘤细胞 6~7周后,处死动物,并解剖下颌下淋巴结。2)制作淋巴结标本。将解剖的淋巴结按照同一只裸鼠、同一组淋巴结、同一粒淋巴结分别编号,将同一淋巴结分为两份。一份用10%甲醛溶液固定,制作半连续切片,分别进行HE和IHC染色,用PBS代替一抗作为阴性对照;另一份即刻液氮冷冻,制作冰冻切片,切片厚度约4 μm,采用QDs标记的特异性CK抗体免疫荧光检测,用PBS代替一抗作为阴性对照。
1.2.2 HE和IHC染色 取石蜡包埋组织切片一份进行常规HE染色,统计淋巴结阳性转移率和微转移率;取另一份进行常规IHC的CK(AE1/AE3)DAB染色,统计淋巴结阳性转移率和微转移率。
1.2.3 QDs605-CK(AE1/AE3)免疫荧光染色 取淋巴结冰冻切片,经纯冰丙酮固定10 min,蒸馏水冲洗,TBS(pH值为7.2~7.6)洗2次,每次5 min,吸干,滴加0.1%Triton于37 ℃湿盒内孵育10 min进行通透,TBS洗3次,每次5 min,吸干,滴加2%BSA,37 ℃湿盒内封闭30 min,滴加稀释度为1∶50的一抗CK(AE1/AE3),37 ℃湿盒孵育1 h,TBST(TBS+0.05%Tween 20)洗3次,每次5 min,吸干,滴2%BSA,37 ℃湿盒封闭10 min,滴加二抗(生物素化马抗鼠IgG,稀释度为1∶400),37 ℃湿盒中孵育30 min,TBST洗3次,每次5 min,吸干,滴加2%BSA,37 ℃下封闭20 min,再滴加QDs-SA复合物(605 nm),37 ℃湿盒孵育30 min,TBST洗3次,每次5 min,TBS洗3次,每次5 min,缓冲甘油封片,荧光显微镜观察拍照,统计裸鼠舌癌淋巴结阳性转移率及微转移率。
1.3 统计方法
采用SPSS 10.0统计学软件进行统计分析,统计方法采用χ2检验,可靠性检验采用Kappa指数一致性检验。
2 结果
2.1 人舌癌荷瘤裸鼠下颌下淋巴结转移模型的建立
接种Tca8113细胞6~10 d后,所有裸鼠舌体组织可见移植瘤生长。10~15 d,舌部移植瘤体积增大至2 mm×3 mm(图1左),扪之质地较硬,剖开呈灰白色(图1右)。切除的肿瘤组织HE染色结果显示:光镜下可见大量肿瘤组织,肿瘤细胞排列紧密,间质较少;瘤细胞核大深染,圆形,核浆比例大,异形性明显,并可见病理性核分裂,核仁多个,可见瘤巨细胞;证明裸鼠舌体移植Tca8113肿瘤成功。
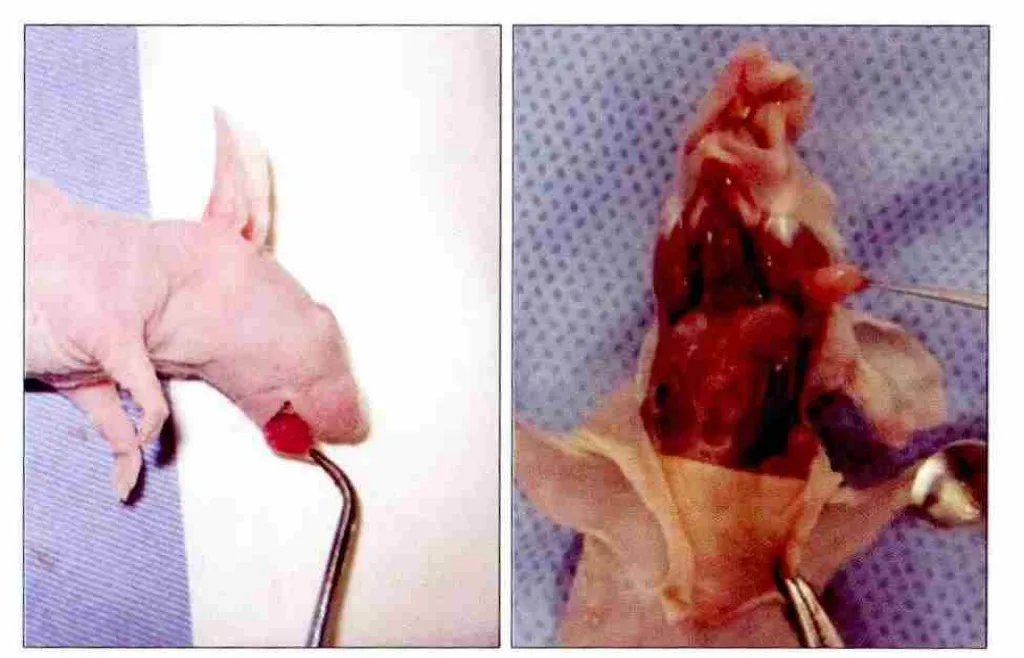
图1 人舌癌荷瘤裸鼠下颌下淋巴结转移模型Fig 1 Submandibular lymph node metastasis model from nude mouse transplanted human tongue squamous cell carcinoma
20只裸鼠除2只在手术切除原发灶时因麻醉死亡外,余18只裸鼠术后存活,能正常进食、进水。接种6周后处死动物,部分动物的下颌下淋巴结可扪及肿大,质地中等偏硬;部分裸鼠有轻度消瘦并见舌部移植瘤部位有肿瘤复发征象。解剖下颌下淋巴结,可见转移淋巴结质地中等偏硬,呈灰白色,直径3~5 mm(图1右);有的转移灶中央坏死。裸鼠舌体复发的移植瘤尽管向后部舌根部蔓延,但未见到肿瘤侵犯口底,与转移的下颌下淋巴结之间有正常的组织间隔开来。这说明本研究成功建立了荷瘤裸鼠下颌下淋巴结转移的动物模型。
2.2 淋巴结组织染色
2.2.1 HE染色 光镜下可见转移的肿瘤细胞位于淋巴结的被膜下窦或髓窦,转移灶呈巢状,有的可见角化珠或数个散在的癌细胞;转移的肿瘤细胞核大而深染,圆形,核浆比例大,异形性明显(图2)。HE染色结果显示,18只裸鼠(36个淋巴结)中有5只出现单侧下颌下淋巴结转移,其淋巴结转移率达27.8%。
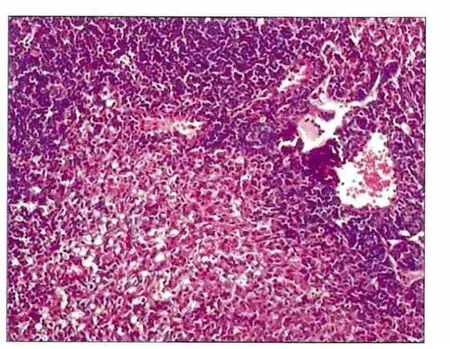
图2 转移的下颌下淋巴结组织 HE × 100Fig 2 Metastasized submandibular lymph node tissue HE × 100
2.2.2 IHC染色 转移的肿瘤细胞中CK(AE1/AE3)表达呈阳性,棕褐色的阳性颗粒主要位于细胞质(图3A)。下颌下淋巴结HE镜检阳性的5只裸鼠对侧淋巴结CK染色全部为阳性,31个HE镜检无转移的淋巴结切片中有11个淋巴结(6只裸鼠)出现CK染色阳性(图3B、C)。综合计算,共有11只裸鼠出现淋巴结转移,其中,5只裸鼠出现淋巴结转移,6只出现淋巴结微转移,转移率达61.1%,微转移率为33.3%。
2.2.3 QDs605-CK(AE1/AE3)免疫荧光染色 QDs标记的荧光探针与CK结合定位于肿瘤细胞质,发出红色荧光,自身正常组织发出绿色荧光,与IHC染色定位相同(图4A)。下颌下淋巴结HE镜检阳性的裸鼠QDs免疫荧光染色阳性,其对侧淋巴结QDs免疫荧光染色也为阳性。31个HE镜检无转移的淋巴结冰冻切片经QDs免疫荧光染色检测,有12个淋巴结7只裸鼠的染色阳性,定位为微转移(图4B、C、D)。综合计算,共有12只裸鼠出现淋巴结转移,其中,5只裸鼠出现淋巴结转移,7只出现淋巴结微转移,转移率达66.7%,微转移率为38.9%。
2.3 3种染色方法检测淋巴结转移率的比较
采用QDs605-CK(AE1/AE3)免疫荧光染色法、半连续切片CK(AE1/AE3)IHC染色法和HE染色法检测18只裸鼠36个下颌下淋巴结的转移阳性率分别为66.7%(12/18)、61.1%(11/18)和27.8%(5/18),经统计学分析,3种方法的差异有统计学意义(χ2=6.379,P<0.05)。QDs标记的免疫荧光染色法和IHC染色法都优于HE染色,但是QDs标记的免疫荧光检测法和IHC检测法之间的差异并无统计学意义(χ2=0.120,P>0.05)。
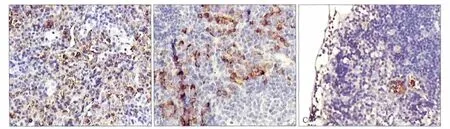
图3 转移的下颌下淋巴结组织 IHC × 100Fig 3 Metastasized submandibular lymph node tissue IHC × 100
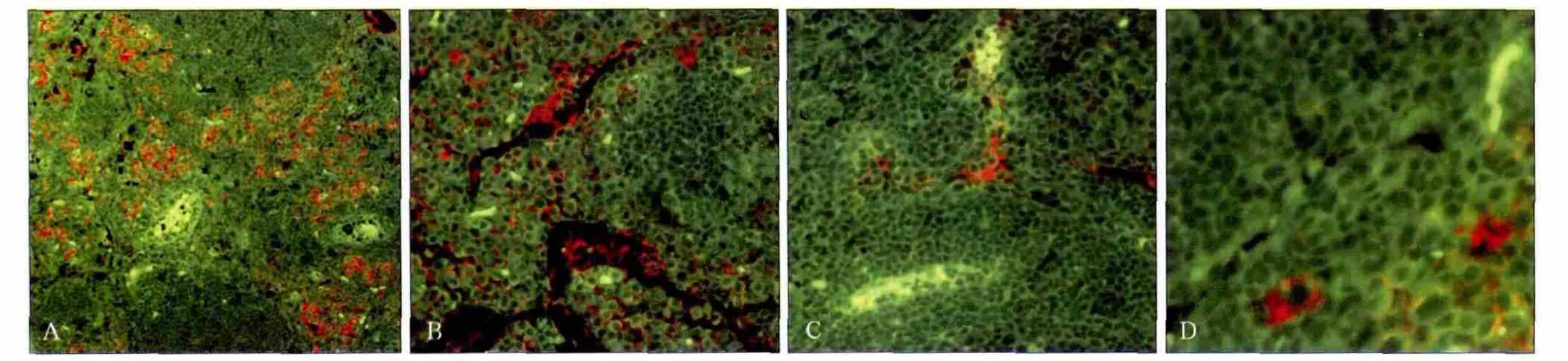
图4 转移的下颌下淋巴结组织 免疫荧光染色 × 400Fig 4 Metastasized submandibular lymph node tissue immunofluorescence staining × 400
3 讨论
舌癌是口腔颌面部最常见的恶性肿瘤,其病理类型98%以上为鳞状细胞癌。早期颈淋巴结转移是影响舌癌患者预后的主要因素之一。即使临床检查没有触及颈部淋巴结肿大的患者,颈清扫术后病理检查常常发现颈淋巴结隐匿性转移,即微转移。微转移灶是指常规病理检查漏诊的微小淋巴结转移病灶,一般为几个恶性细胞或直径小于2 mm的淋巴结转移灶[3]。在淋巴结临床分期N0的患者中,颈部淋巴结微转移率可高达27.8%~45.0%[4-6]。癌细胞在颈淋巴系统中的微转移或跳跃性转移是术后复发的主要原因。在目前外科治疗舌癌时,为了提高术后生存率,常对淋巴结临床分期N0的患者行常规选择性颈淋巴结清扫术,使不少淋巴结实际并未发生转移的患者经受了过度治疗,这无疑违背了功能性外科原则,同时对一部分患者可能带来不必要的创伤和医疗负担。如果能在手术前或手术中用微创方法将前哨淋巴结送快速病理检查,根据其性质选择舌癌手术方式,对提高患者的生存及生活质量将具有重要的意义。
在探索检测舌癌及其淋巴结转移的方法中,需要建立合适的舌癌转移动物模型。目前通过裸鼠舌体接种Tca8113细胞的方法建立人舌鳞状细胞癌早期下颌下淋巴结转移是较为成熟的模型[7]。免疫荧光技术是研究动物模型的常用技术之一。传统的免疫荧光激发光谱较窄,发射光谱较宽,不能同时检测多种蛋白及标记物,同时易耐光漂白,荧光寿命短,很难动态长时间地观察追踪待检测生物分子。近年来,QDs发展起来的生物亲和性功能化的纳米荧光探针完全弥补了这些不足。作为一种理想的功能探针,QDs荧光探针已在细胞标记成像、活体动物成像、肿瘤的前哨淋巴结成像及组织标本的免疫组织化学检测方面都取得了重要进展[8-9]。临床上对于肿瘤标记物的检测,IHC技术可以说是检测这些指标的金标准,而QDs与传统IHC方法相结合可提高检测的灵敏度,尤其对于一些低表达的生物标志物更占优势。Chen等[10]曾在乳腺癌的研究中采用QDs免疫荧光技术标记人类表皮生长因子受体-2(human epidermal growth factor receptor-2,HER-2),并进行了量化检测,结果表明:QDs标记的HER-2表达优于传统的IHC方法检测,其检测方法更为敏感和稳定。
本实验利用QDs的光学优点,将其作为荧光探针与CK相结合检测人舌鳞状细胞癌荷瘤裸鼠下颌下淋巴结有无转移及微转移,结果显示:QDs与CK结合定位于肿瘤细胞的细胞质,与IHC染色定位相同,发出红色荧光,而肿瘤周围的正常组织发出绿色荧光,二者形成鲜明对比。18只裸鼠有5只出现下颌下淋巴结转移,7只出现淋巴结微转移,其阳性转移率66.7%,微转移率为38.9%。统计结果显示,用QDs检测荷瘤裸鼠人舌鳞状细胞癌下颌下淋巴结,其阳性检出率明显高于传统的HE染色检测,能够对淋巴结微转移灶进行检测;而与IHC检测方法相比较差异没有统计学意义,这与其他文献[11]报道的结果相似。在本实验中,尽管QDs检测方法与IHC法在检测淋巴结转移率及微转移率方面无明显差异,但QDs检测时CK定位准确,背景非常干净,分辨率高,即使单个的转移肿瘤细胞也能被敏锐地检测到。有研究[12]表明,当组织本身受激发光激发时,组织的自发荧光会发生改变,而肿瘤组织中QDs标记的肿瘤细胞的荧光并没有明显变化,这种属性使QDs标记法更容易识别肿瘤组织中微小的癌细胞,而在这点上传统IHC检测就明显不够清晰与精确。由此可见,对于常规视野下不能检测到的微转移灶及细胞,可同时用IHC法进行检测,但如果检测结果不够清晰,或者检测结果不确定,可以尝试用QDs免疫荧光技术进行检测。此外,由于QDs的尺寸可以调节,光稳定性好,荧光寿命长且耐光漂白,故可以通过改变其尺寸或内核的组分调节QDs的发射光谱,在荧光显微镜下可以发出不同颜色的光,便于在同一组织中观察不同标志物的同时表达情况[10]。就这方面而言,QDs荧光探针明显优于传统的IHC技术。
本实验证实,QDs能够用于裸鼠舌癌下颌下淋巴结转移及微转移的检测;但是本实验还存在很多不足,如样本量少,未能对活体的动物模型实施荧光成像动态观察等。在以后的实验中,笔者会和多医疗单位协作研究,对舌癌前哨淋巴结进行活体成像,或者对检测标记物进行定量分析,这将是进一步的研究方向。
[1]Gao X, Chung LW, Nie S. Quantum dots forin vivomolecular and cellular imaging[J]. Methods Mol Biol, 2007, 374:135-145.
[2]Kim S, Lim YT, Soltesz EG, et al. Near-infrared fluorescent type Ⅱ quantum dots for sentinel lymph node mapping[J]. Nat Biotechnol, 2004, 22(1):93-97.
[3]习利军, 陈坤, 张铁柱. 口腔鳞癌隐匿性颈淋巴结转移检测技术的研究进展[J]. 广东医学院学报, 2009, 27(5):574-577.
[4]Lippman SM, Hong WK. Molecular markers of the risk of oral cancer[J]. N Engl J Med, 2001, 344(17):1323-1326.
[5]Kowalski LP, Bagietto R, Lara JR, et al. Prognostic signi fi-cance of the distribution of neck node metastasis from oral carcinoma[J]. Head Neck, 2000, 22(3):207-214.
[6]李晓明, 邸斌, 尚耀东, 等. 口腔鳞癌颈淋巴结转移的临床病理学特点及其对预后的影响[J]. 癌症, 2005, 24(2):208-212.
[7]余杨, 邱蔚六, 吕燕, 等. Tca8113细胞系下颌下淋巴结转移动物模型的建立[J]. 口腔颌面外科杂志, 2009, 19(3):159-163.
[8]赵建江, 盘杰, 王治平, 等. 口腔鳞癌细胞中bcl-2、bax的量子点双标免疫荧光成像研究[J]. 实用口腔医学杂志,2011, 27(5):630-633.
[9]杨凯, 曹雨庵, 李志刚, 等. 近红外荧光量子点对颊癌可视化活体成像研究[J]. 中华口腔医学杂志, 2011, 46(3):134-138.
[10]Chen C, Peng J, Xia H, et al. Quantum-dot-based immunofluorescent imaging of HER2 and ER provides new insights into breast cancer heterogeneity[J]. Nanotechnology, 2010,21(9):095101.
[11]Chen H, Xue J, Zhang Y, et al. Comparison of quantum dots immunofluorescence histochemistry and conventional immunohistochemistry for the detection of caveolin-1 and PCNA in the lung cancer tissue microarray[J]. J Mol Histol,2009, 40(4):261-268.
[12]Yang XQ, Chen C, Peng CW, et al. Quantum dot-based quantitative immunofluorescence detection and spectrum analysis of epidermal growth factor receptor in breast cancer tissue arrays[J]. Int J Nanomedicine, 2011(6):2265-2273.

