Box -Behnken响应面法设计藤茶抗氧化活性的最优冲泡工艺
王婉莹,张鑫瑶,肖 伟,郭建军,许利嘉,* ,肖培根
(1.中国医学科学院北京协和医学院药用植物研究所,北京100193;2.国家教育部中草药物质基础与资源利用重点实验室,北京100193;3.黔南民族医学高等专科学校,贵州都匀558003)
藤茶,原植物为葡萄科蛇葡萄属的显齿蛇葡萄Ampelopsis grossedentata(Hand.-Mazz.)W.T.Wang。俗称甜树茶、甜茶藤、田婆茶(广西)、藤婆茶(广东连州)、腊梅茶、石花茶(广东英德)、茅岩霉茶(湖南张家界)、白茶(广东)、白茶饼、癞痢茶、甘露茶等,是一种应用历史悠久,分布广泛的类茶植物资源和药食两用植物资源[1-5]。其幼嫩茎叶当茶泡饮具有清热解毒、消炎抑菌、止咳利咽、降压减脂、消除疲劳等功效。藤茶富含黄酮类成分,据报道藤茶总黄酮含量可高达41.2%左右,其中双氢杨梅素含量可达30%左右[6-8]。
人体内多余的自由基会引发氧化损伤,引起细胞结构和功能的变化,使机体抵抗力下降,从而导致肿瘤、动脉硬化、心脑血管疾病、糖尿病等多种疾病的发生[9]。现代药理活性研究表明,藤茶具有极好的抗氧化活性,能够有效清除自由基[10-11]。并且具有较好的抗肿瘤活性[12],能明显降低高脂饮食大鼠血脂,抑制动脉粥样硬化[13-14],还能提高非特异性免疫功能[15],在维持机体正常代谢和疾病防治中起到了非常积极的作用。
目前关于藤茶的研究多集中于其活性成分分析[15-17],含量测定[18-20],藤茶黄酮工业提取工艺[21-23]等方面,而藤茶作为日常保健茶饮的冲泡条件的研究鲜有报道。为了让藤茶的抗氧化活性在日常冲泡中得到充分有效的利用,本文系统全面的对日常冲泡藤茶的主要因素进行研究,采用单因素和响应面分析方法得出最适的冲泡条件,为科学指导饮用藤茶提供了依据。
1 材料与方法
1.1 材料与仪器
藤茶 湖南张家界,2012年 6月产;DPPH(1,1-diphenyl-2-picryl-hydrazyl) 美国Sigma公司。
MQX200型酶标仪 美国伯腾公司;AL-204型千分之一电子分析天平 美国梅特勒-托利多公司。
1.2 试样冲泡方法
模拟生活泡茶,以藤茶为样品,在不同的温度、次数、时间、料液比、水质的条件下进行实验,分析不同因素对藤茶茶汤的抗氧化活性的影响,采用DPPH法测定其抗氧化活性。
1.2.1 冲泡温度对藤茶抗氧化活性的影响 称取1.0g的藤茶,分别加入 60mL、不同温度(100、90、80、70、60℃)的纯净水,冲泡一次,冲泡时间为4min,过滤,测定茶汤的DPPH自由基清除率。
1.2.2 冲泡次数对藤茶抗氧化活性的影响 称取1.0g的藤茶,加入60mL、80℃的纯净水,冲泡4min,过滤后的滤渣继续同样操作的第二次冲泡、第三次冲泡直至第十次冲泡,测定不同冲泡次数的茶汤的DPPH自由基清除率。
1.2.3 料液比对藤茶抗氧化活性的影响 称取1.0g的藤茶,分别以料液比为 1∶40、1∶50、1∶60、1∶80、1∶100(g/mL),加入 40、50、60、80、100mL、温度 80℃ 的纯净水,冲泡4min,过滤,测定茶汤的DPPH自由基清除率。
1.2.4 冲泡时间对藤茶抗氧化活性的影响 称取1.0g的藤茶,加入60mL、80℃的纯净水,分别冲泡2、4、6、8、10min,过滤,测定茶汤的 DPPH 自由基清除率。
1.2.5 水质对藤茶抗氧化活性的影响 称取1.0g的藤茶,分别加入60mL、80℃的娃哈哈桶装矿泉水、雀巢瓶装矿泉水、自来水、纯净水和超纯水冲泡一次,冲泡时间为4min,过滤,测定茶汤的DPPH自由基清除率。
1.3 DPPH法测定抗氧化活性
DPPH分析法因其能准确、快速、简便地测定自由基清除能力而被广泛用于测定生物试样、酚类物质和食品等的抗氧化能力。本文参照Miliauskas[24]等的研究方法,略有改进。将2mL的2×10-4mol·L-1的DPPH无水乙醇溶液与2mL过滤后的藤茶茶汤混合,摇匀,室温,暗室反应30min。以无水乙醇调零,用酶标仪测517nm波长处吸光度(A1),同时测定2mL样液与2mL无水乙醇混合液的吸光度(A2),2mL无水乙醇与2mL DPPH醇溶液混合液的吸光度(A0)。每组平行测定三次,取平均值即为样品对DPPH自由基的清除率。计算公式为:清除率(%)=[1-(A1-A2)/A0]×100。结果以DPPH自由基清除率表示,清除率越高,样品清除DPPH自由基的能力越强,抗氧化能力越强。
1.4 响应面分析实验优化藤茶冲泡工艺
采用Design Expert 8.0,根据Box-Behnken实验设计原理,在单因素实验的基础上,选取冲泡温度、冲泡时间和料液比三个因素,以藤茶抗氧化活性DPPH自由基清除率为响应值,采用三因素三水平响应面分析方法对藤茶的日常冲泡工艺进行优化,响应面实验因素与水平见表1。

表1 响应面实验因素水平编码表Table 1 Factors and levels of response surface experiments
2 结果与分析
2.1 单因素实验
2.1.1 冲泡温度对藤茶抗氧化活性的影响 由图1可知,60~80℃的藤茶茶汤DPPH自由基清除率随温度的升高而增加明显,温度高于80℃后,DPPH自由基清除率有所下降,100℃时DPPH自由基清除率再次回升,但DPPH自由基清除率的最高值出现在80℃。原因可能是藤茶采用嫩叶嫩芽加工而成,水温较低时,抗氧化的有效成分溶出量较少,活性较差。而水温超过80℃后,藤茶嫩叶嫩芽的表面易熟化、结膜,可能阻碍了部分抗氧化有效成分的溶出,100℃时抗氧化活性再次有所升高,推测可能原因是藤茶中的某些抗氧化有效成分在此温度下溶出增加。考虑到高温条件下,维生素C等有益成分易遭破坏,且DPPH自由基清除率的最高值出现在80℃,选取80℃为最适温度。

图1 温度对藤茶抗氧化活性的影响Fig.1 Effect of temperature on the DPPH radical scavenging rate of vine tea
2.1.2 冲泡次数对藤茶抗氧化活性的影响 由图2可知,仅冲泡一次时,藤茶的抗氧化活性最低,推测是因为其抗氧化活性成分溶出较少所致。冲泡两次之后,藤茶的抗氧化活性随冲泡次数增加而升高,直至冲泡9次时抗氧化活性达到最高,第10次开始下降。可见藤茶多次冲泡后抗氧化活性仍然很高。这与民间使用藤茶的经验相契合:民间形容藤茶茶汤“经久不馊”,放置数天仍能饮用。但冲泡次数超过四次,茶汤口感明显变差,可能是因为多次冲泡后氨基酸、维生素C等成分的溶出量减少[25]所致。综合考虑,冲泡次数可按个人喜好选择,3~9次为宜。
2.1.3 料液比对藤茶抗氧化活性的影响 由图3可知,1∶40~1∶60g/mL 时,随着料液比的增加,藤茶的抗氧化活性明显增加,料液比1∶60时,DPPH自由基清除率达到最高值,随后呈下降趋势。推测原因可能为,在相同的温度和时间下,水量过少,有效成分不能充分溶出。水量过大,溶剂比例增加对溶出物和藤茶抗氧化的主要有效成分起到了一定的稀释作用,同时也影响口感,综合考虑,选择1∶60为最适料液比。

图3 料液比对藤茶抗氧化活性的影响Fig.3 Effect of solid-liquid ratio on the DPPH radical scavenging rate of vine tea
2.1.4 冲泡时间对藤茶抗氧化活性的影响 由图4可知,藤茶的抗氧化活性随着时间的增加,整体呈现先增后减的趋势,且在6min达到最大值。藤茶的有效物质随着冲泡时间延长而溶出量逐渐增大,但时间过长可能使部分有效成分被氧化,导致藤茶的抗氧化活性反而降低,10min时抗氧化活性又再次稍有上升可能是因为有其他物质溶出。考虑到抗氧化活性、口感等综合因素,选择6min为最适时间。
2.1.5 水质对藤茶抗氧化活性的影响 由图5可知,自来水冲泡的抗氧化活性最低,主要因为自来水中次氯酸的强氧化性氧化了藤茶中的有效成分,再者自来水中的矿物质和杂质也较多,降低了藤茶的抗氧化活性。娃哈哈桶装矿泉水和雀巢瓶装矿泉水的效果也较差,可能是矿泉水中的矿物质和其他杂质与藤茶中的有效成分发生反应而降低其抗氧化活性。纯净水和超纯水的抗氧化最好,但考虑到超纯水较难应用于日常生活,故选择纯净水为最适宜的水质。

图4 冲泡时间对藤茶抗氧化活性的影响Fig.4 Effect of time on the DPPH radical scavenging rate of vine tea

图5 水质对藤茶抗氧化活性的影响Fig.5 Effect of water on the DPPH radical scavenging rate of vine tea
2.2 响应面分析及验证
2.2.1 响应面实验结果及方差分析 在单因素实验的基础上,选取冲泡温度、冲泡时间和料液比三个因素,根据Box-Behnken的中心组合设计原理,对三因素各取三水平,设计了三因素三水平共15个实验点的响应面分析实验,以三因素为自变量,藤茶DPPH自由基清除率为响应值。实验结果见表2。

表2 响应面分析实验结果Table 2 Results of response surface experiments

表3 回归模型方差分析Table 3 Analysis results of regression and variance
经二次多项式回归拟和得到各实验因子对响应面影响的回归方程为:藤茶DPPH自由基清除率(%)=+86.47-0.94×C+0.54×A×B-0.65×A×C+1.81×B×C-2.17×A2-1.86×B2-3.06×C2

2.2.2 响应曲面分析及优化 响应面图形是响应值对各因素(A、B、C)所构成三维空间的曲面图,根据回归方程得出不同因子的响应面分析图,体现了在第三个变量保持最佳水平时,另两个独立变量之间的交互关系。结果见图6~图8。曲面图直观地反映了各因素对响应值的影响,图6,图7和图8表明温度、时间和料液比与藤茶茶汤的DPPH自由基清除率均呈二次方程关系。图中等高线形状可反映出交互效应的强弱,椭圆形表示两因素交互作用显著,而圆形则表明交互作用不显著,图6,图7,图8的等高线图表明,温度、时间和料液比三者之间均有交互作用,交互作用的影响可能导致响应面预测最佳值与单因素最佳值相对偏移。

图6 温度和时间对DPPH自由基清除率影响的响应面图Fig.6 Response surface of temperature and time on the DPPH radical scavenging rate of vine tea

图7 温度和料液比对DPPH自由基清除率影响的响应面图Fig.7 Response surface of temperature and solid-liquid ratio on the DPPH radical scavenging rate of vine tea
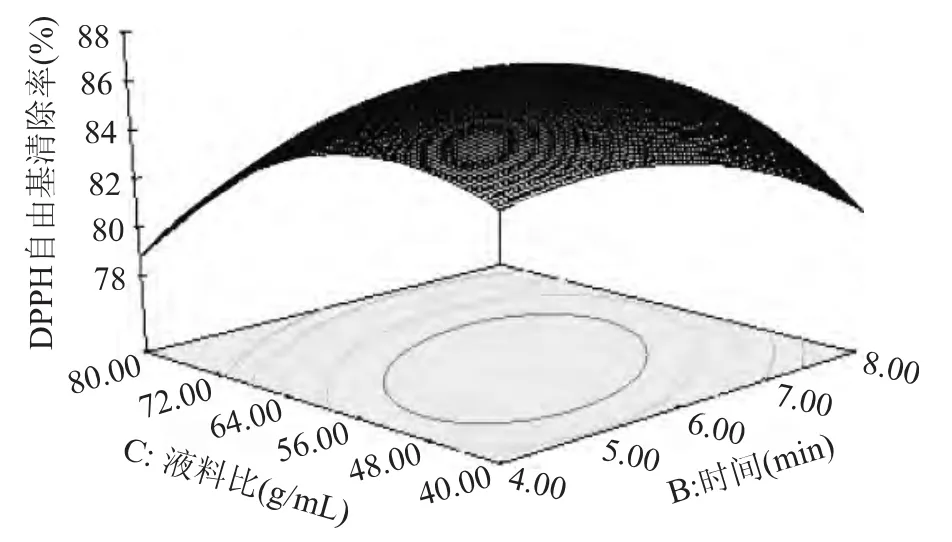
图8 时间和料液比对DPPH自由基清除率影响的响应面图Fig.8 Response surface of time and solid-liquid ratio on the DPPH radical scavenging rate of vine tea
由响应面实验得到藤茶抗氧化活性最好时的最适冲泡条件为:温度80.17℃,时间5.83min,料液比1∶56.42,此条件下预测的 DPPH自由基清除率为86.56%。为实际操作方便,修正条件为温度80℃,时间5.8min,料液比1∶56,在此修正条件下进行三次平行的验证实验,结果得到实际的DPPH自由基清除率为86.49%,与预测值86.56%非常接近。
3 结论
本实验以DPPH自由基清除率为评价指标,模拟日常实际冲泡条件,采用单因素实验设计考察了冲泡温度、冲泡次数、单次冲泡时间、料液比和水质五个因素对藤茶抗氧化活性的影响。以DPPH自由基清除率为响应值,利用Box-Behnken实验设计进行响应面分析,研究冲泡时间、冲泡温度和料液比三个自变量的交互作用及其对藤茶抗氧化活性的影响,模拟得到二次多项式回归方程的预测模型,并确定了日常冲泡藤茶时抗氧化活性最佳的条件为:1g藤茶,加56mL温度为80℃的水,冲泡5.8min,此时藤茶DPPH自由基的清除率可达86.49%,藤茶的抗氧化活性达到最佳。按此条件冲泡,藤茶能够发挥更理想的抗氧化作用。
[1]广西植物研究所.广西药用植物名录[M].南宁:广西民族出版社,1974.
[2]全国中草药汇编编写组.全国中草药汇编下册[M].北京:人民出版社,1978.
[3]张友胜,宁正祥,杨伟丽.藤茶学[M].广州:广东科技出版社,2003.
[4]许利嘉,马培,肖伟,等.别样茶-藤茶的古今应用历史初步调查[J].中国现代中药,2012,14(4):62-66.
[5]张友胜,杨伟丽,熊浩平.类茶植物显齿蛇葡萄的研究利用现状[J].茶叶通讯,2001,(1):19-23.
[6]薛慧.恩施来凤藤茶微量元素的分析及其保健功能探讨[J].广东微量元素科学,2004,11(8):56-58.
[7]张友胜,杨伟丽,熊皓平.显齿蛇葡萄基本成分研究[J].天然产物研究与开发,2001,13(5):46-48.
[8]何桂霞,裴刚,周天达,等.显齿蛇葡萄中总黄酮和二氢杨梅素的含量测定[J].中国中药杂志,2000,25(7):423-425.
[9]Marx J L.Oxygen free radicals linked to many diseases[J].Science,1987,5:235-238.
[10]唐瑛.藤茶总黄酮的体外抗氧化作用研究[J].中国医院药学杂志,2006,26(12):1449.
[11]何桂霞,杜方麓,杨伟丽,等.藤茶总黄酮清除自由基与抗脂质过氧化作用[J].中药材,2003,26(5):338-340.
[12]郑作文,郭成贤,毛健,等.藤茶总黄酮对人胃癌SGC-7901细胞增殖抑制作用的实验研究[J].时珍国医国药,2009,20(5):1158-1159.
[13]钟正贤,陈学芬,周桂芬,等.广西产藤茶总黄酮的药理研究[J].广西科学,1999,6(3):216-218.
[14]陈晓军,陈学芬,李茂,等.显齿蛇葡萄总黄酮降脂作用的研究[J].广西中医药,2001,24(5):52-54.
[15]阎莉,郑作文,卫智权.广西藤茶总黄酮对免疫抑制小鼠细胞免疫功能的影响[J].中国药物应用与监测,2009,6(2):65-67.
[16]覃洁萍,许学健,李剑江,等.广西瑶族藤茶化学成分的研究[J].天然产物研究与开发,1997,9(4):41-43.
[17]张友胜,杨伟丽,崔春.显齿蛇葡萄化学成分的研究[J].中草药,2003,34(5):402-403.
[18]熊皓平,杨伟丽,何国庆,等.分光光度法测定显齿蛇葡萄总黄酮含量[J].食品科学,2004,25(2):144-145.
[19]田森林,张友胜,杨英雄,等.反相高效液相色谱法测定显齿蛇葡萄中二氢杨梅素的含量[J].湖南农业大学学报:自然科学版,2002,28(1):32-34.
[20]张友胜,杨伟丽,熊皓平.RP-HPLC法测定显齿蛇葡萄植物中杨梅素的含量[J].中草药,2001,32(11):983-985.
[21]李卫,宁正祥.逆流法提取二氢杨梅素研究[J].食品科学,2004,25(11):192-194.
[22]杨铃,郑成,宁正祥.正交实验设计优选二氢杨梅素的提取工艺[J].食品工业科技,2005,26(5):95-97.
[23]罗祖友,杨晓萍,吴谋成.藤茶水溶性多糖及总黄酮的提取工艺研究[J].食品科学,2005,26(5):156-160.
[24]Miliauskas G,Venskutonis P R,van Beek T A.Screening of radical scavenging activity of some medicinal and aromatic plant extracts[J].Food Chemistry,2004,85:231-237.
[25]胡迎芬,杭瑚.饮茶方式对茶汤有效成分含量的影响[J].食品工业科技,2002,23(2):27-29.

