野艾蒿抑菌成分提取工艺的研究
陈海燕,陈晓平
(1.长春科技学院,吉林长春130600;2.吉林农业大学,吉林长春130118)
艾蒿(Artemisia argyi Levl.et Vant),又称灸草,为菊科属多年生草本植物,在全国分布较广[1]。迄今为止,艾蒿在我国至少有3000多年的应用历史,如用于制作艾叶酒、艾叶糕点等。
现代研究表明,艾蒿中的化学成分主要集中在茎、叶两部分,主要有挥发油类、黄酮类、桉叶烷类、三萜类和微量化学元素[2-4]等。艾蒿的活性成分具有抗菌和抗病毒成分,其中主要起抑菌作用的物质有黄酮、挥发油和三萜类[5-7]。艾蒿的水浸液对革兰氏阳性嗜气菌具有抗菌作用[8-9]。江茂生[10]等研究了艾蒿提取物对植物病原菌的抑制活性,结果表明艾蒿具有开发为新型植物源农药的潜力。马烁等[11-13]以艾蒿中黄酮类物质为研究对象,探索黄酮类物质对大肠杆菌,金黄色葡萄球菌、黑曲霉和白曲霉的抑制情况。确定了艾蒿中黄酮物质对大肠杆菌和金黄色葡萄球菌抑制较强,但并没有给出确切数据。
本研究以大肠杆菌为指示菌,以艾蒿提取物抑菌圈直径为响应值,对超声波辅助乙醇提取法的主要工艺参数进行优化以期获得最佳提取工艺,旨在探索高效提取艾蒿抑制物质的条件。高效提取这些抑菌物质可用于食品中果蔬及其制品的杀菌,也为进一步研发艾蒿功能性食品,保健产品提供一定的理论依据。
1 材料与方法
1.1 材料与仪器
艾蒿(Artemisia argyi L) 双阳湖水库;大肠杆菌(Escherichia coli) 长春科技学院食品微生物实验室;无水乙醇、乙酸乙酯、丙酮 均为分析纯。
微型植物粉碎机 天津泰斯特仪器设备有限公司;电热恒温鼓风干燥箱 上海精科仪器有限公司;电子天平 上海精科仪器有限公司;旋转蒸发器 南京科尔仪器设备有限公司;超净工作台 天津永利达实验室设备有限公司;生化培养箱 上海精科仪器有限公司;超声波发生器 上海冠特超声仪器有限公司。
1.2 实验方法
1.2.1 原料预处理 艾蒿在未开花时采收,取新鲜的艾蒿,除去杂质,置于干燥箱中在60℃的条件下烘干,再用粉碎机粉碎,过100目筛制成植物干粉,并置于0℃的低温下密封保存备用。
1.2.2 艾蒿抑菌成分生物活性的研究 以大肠杆菌为指示菌,用琼脂孔穴扩散法[14]来评价艾蒿抗菌成分对大肠杆菌的抑菌效果。判定标准[15]:抑菌圈直径≥10mm者被判为有抑菌作用,抑菌圈直径 <10mm者被判为无抑菌作用,3次重复实验均有抑菌作用,才可判为实验结果有效。阴性对照组应无抑菌圈产生,否则实验无效。
1.2.3 单因素实验
1.2.3.1 超 声 功 率 对 艾 蒿 提 取 液 抑 菌 效 果 的 影响 准确称取10g艾蒿粉,超声功率分别为100、200、300、400、500W,料液比为 1∶20,超声时间为20min,乙醇浓度为60%,浸提温度为60℃,浸提时间为8h,抽滤后将滤液旋转蒸发后定容至25mL。以大肠杆菌为指示菌[16-18]进行抑菌实验,记录抑菌圈直径大小,实验重复三次。
1.2.3.2 超 声 时 间 对 艾 蒿 提 取 液 抑 菌 效 果 的 影响 准确称取10g艾蒿粉,超声时间分别为10、20、30、40、50min,料液比为 1∶20,超声功率为 300W,乙醇浓度为60%,浸提温度为60℃,浸提时间为8 h,方法同 1.2.3.1。
1.2.3.3 乙 醇 浓 度 对 艾 蒿 提 取 液 抑 菌 效 果 的 影响 准确称取10g艾蒿粉,乙醇浓度分别为40%、50%、60%、70%、80%,料液比为 1∶20,超声功率为300W,超声时间为20min,浸提温度为60℃,浸提时间为 8h,方法同 1.2.3.1。
1.2.3.4 乙醇浸提温度对艾蒿提取液抑菌效果的影响 准确称取10g艾蒿粉,浸提温度分别为50、60、70、80、90℃,料液比为1∶20,超声功率为 300W,超声时间为20min,乙醇浓度为60%,浸提时间为8h,方法同 1.2.3.1。
1.2.3.5 乙醇浸提时间对艾蒿提取液抑菌效果的影响 准确称取10g艾蒿粉,浸提时间分别为2、4、6、8、10h,料液比为1∶20,超声功率为300W,超声时间为20min,乙醇浓度为60%,浸提温度为60℃,方法同1.2.3.1。
1.2.3.6 料液比对艾蒿提取液抑菌效果的影响 准确称取 10g 艾蒿粉,料液比分别为 1∶10、1∶15、1∶20、1∶25、1∶30,超声功率为 300W,超声时间为 20min,乙醇浓度为60%,浸提温度为60℃,浸提时间为8h,方法同 1.2.3.1。
1.2.4 最佳提取工艺的优选 根据中心组合(Box-Behnken)实验设计原理,通过四因素三水平的响应面分析方法。通过单因素实验结果综合分析,确定料液比为1∶15,乙醇浸提时间6h,从而选取超声功率(A)、超声时间(B)、乙醇浓度(C)、浸提温度(D)作为考察变量,抑菌圈直径(Y)为响应值,通过Design-Expert 7.0设计软件进行多元回归分析。实验设计因素水平见表1。
2 结果与讨论
2.1 单因素实验
2.1.1 超声功率对艾蒿提取液抑菌效果的影响 超声功率对艾蒿提取液抑菌效果的影响结果见图1。

表1 中心组合实验方案Table 1 Factors and levels of RAS test
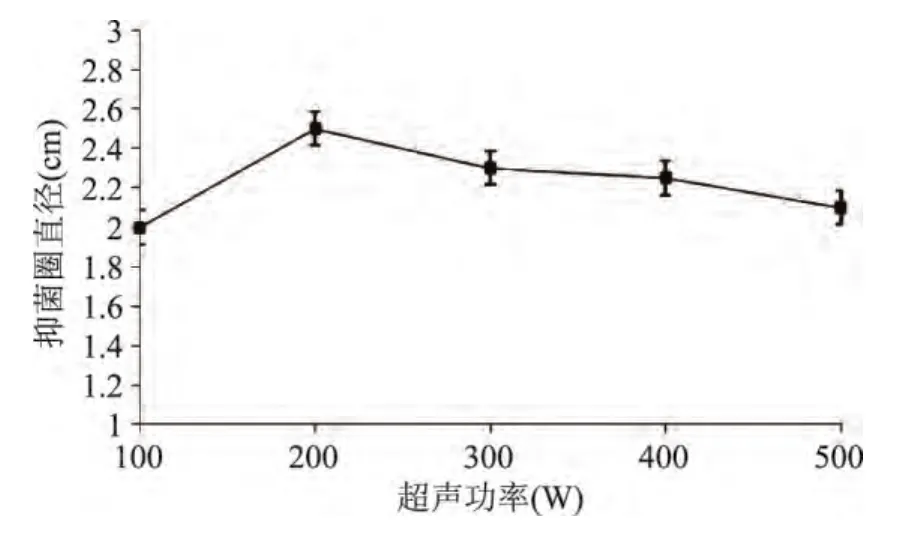
图1 超声功率对艾蒿提取物抑菌效果的影响Fig.1 Effect of ultrasonic power on bacteria inhibiting result
由图1可知,随着超声功率增大,艾蒿抑菌能力先增加后减少,超声功率为200W时艾蒿抑菌成分浸出最多。随着超声功率继续增加,艾蒿抑菌成分浸出又逐渐减少,导致这种结果原因可能是当超声功率较大时,部分艾蒿抑菌成分发生分解,从而导致抑菌效果降低。
2.1.2 超声时间对艾蒿提取液抑菌效果的影响 超声时间对艾蒿提取液抑菌效果的影响结果见图2。
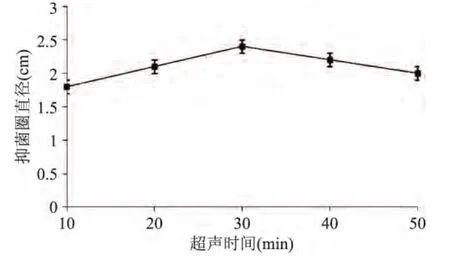
图2 超声时间对艾蒿提取物抑菌效果的影响Fig.2 Effect of ultrasonic time on bacteria inhibiting result
由图2可知,随着超声时间的延长,艾蒿抑菌物质浸出随之增多。当超声时间达到30min时艾蒿抑菌物质浸出达到最大值,所以选取超声时间30min作为响应面水平值。
2.1.3 乙醇浓度对艾蒿提取液抑菌效果的影响 乙醇浓度对艾蒿提取液抑菌效果的影响结果见图3。
由图3可知,随着乙醇浓度增大,抑菌物质浸出随之增多,当乙醇浓度达到60%时,抑菌物质浸出达到最大值,抑菌效果最好,所以选取乙醇浓度60%左右作为响应面水平值。
2.1.4 浸提温度对艾蒿提取液抑菌效果的影响 浸提温度对艾蒿提取液抑菌效果的影响结果见图4。
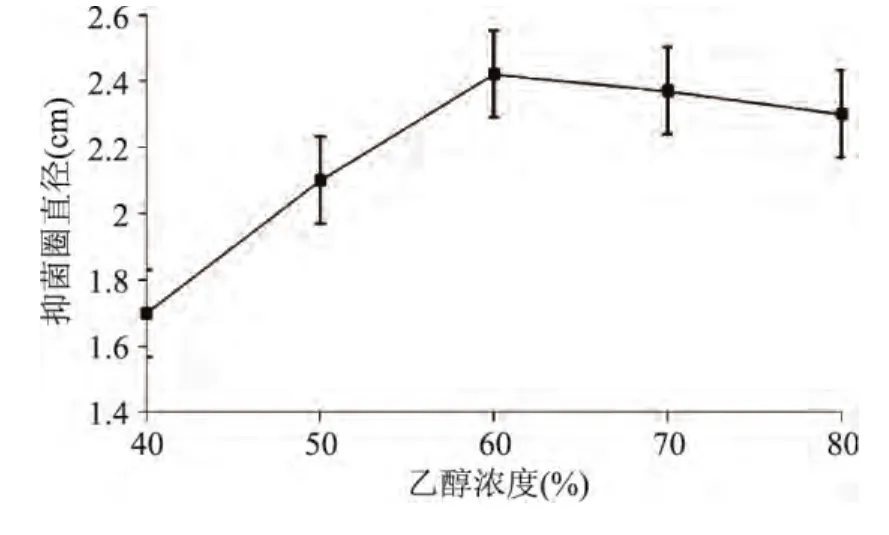
图3 乙醇浓度对艾蒿提取物抑菌效果的影响Fig.3 Effect of ethanol concentration on bacteria inhibiting result
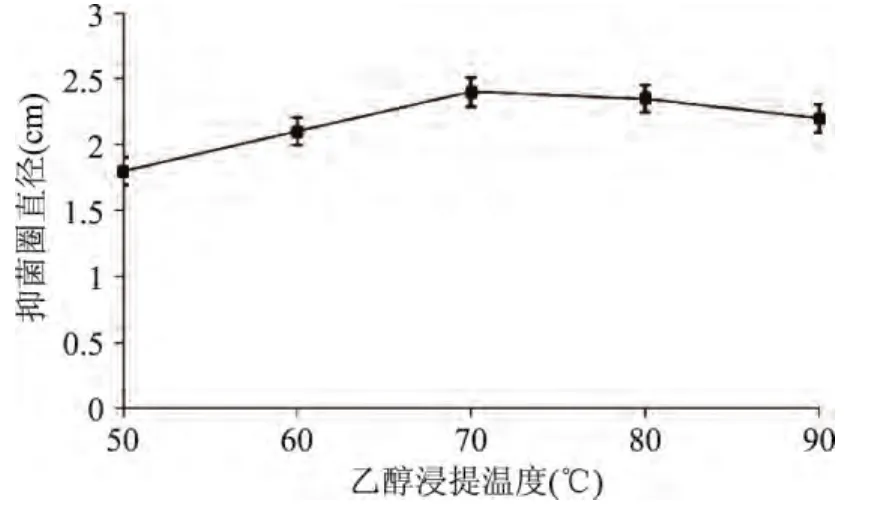
图4 乙醇浸提温度对艾蒿提取物抑菌效果的影响Fig.4 Effect of ethanol extraction temperature on bacteria inhibiting result
由图4可知,浸提温度在50~70℃范围内,随着温度升高,抑菌效果随之增强,当温度达到70℃时,抑菌效果最好,之后,随着温度继续升高,抑菌效果反而下降,所以选取浸提温度70℃左右作为响应面水平值。
2.1.5 浸提时间对艾蒿提取液抑菌效果的影响 浸提时间对艾蒿提取液抑菌效果的影响结果见图5。
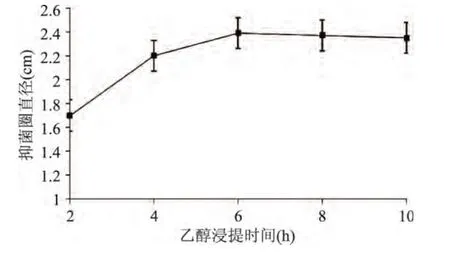
图5 乙醇浸提时间对艾蒿提取物抑菌效果的影响Fig.5 Effect of ethanol extraction time on bacteria inhibiting result
由图5可知,随着时间增长,抑菌效果随之增强,浸提时间为6h时艾蒿提取物的抑菌效果最好,6h后随着时间继续增长,浸提物浸出不明显,这说明提取时间达到6h时抑菌成分已经充分溶出。因此,综合考虑在响应面实验设计中选取浸提时间为6h。
2.1.6 料液比对艾蒿提取液抑菌效果的影响 料液比对艾蒿提取液抑菌效果的影响结果见图6。

图6 料液比对艾蒿提取物抑菌效果的影响Fig.6 Effect of ratio of liquid material on bacteria inhibiting result
由图6可知,随着料液比逐渐增大,艾蒿抑菌效果随之增强,当料液比为1∶15时,抑菌效果最佳,当料液比继续增加时,抑菌圈直径基本没有增加。在响应面实验设计中选取料液比为1∶15。
2.2 回归模型的建立及显著性检验
按照Box-Behnken实验方案进行四因素三水平实验,结果见表2。将所得的实验数据采用响应面Design Expert7.0软件进行多元回归拟合,得到以抑菌圈直径(cm)对超声功率(W)、超声时间(min)、乙醇浓度(%)、浸提温度(℃)的二次多项回归方程为:Y=2.60+0.27A+0.24B+0.19C+0.18D+0.14AB-0.097AC-0.010AD-5.000 × 10-3BC+0.098BD+0.025CD-0.23A2-0.33B2-0.28C2-0.36D2
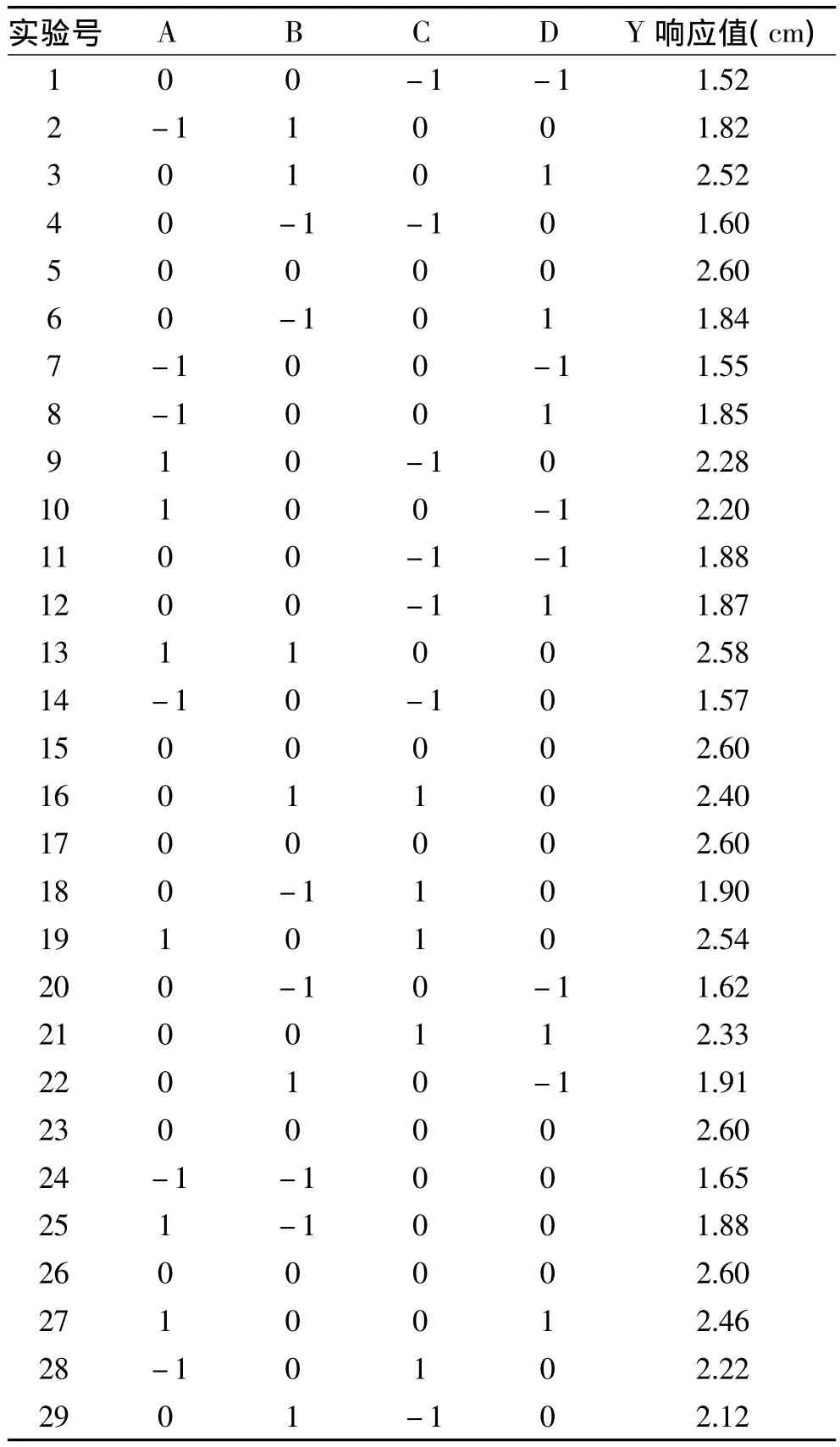
表2 响应面实验设计及结果Table 2 Program and results of RSM test
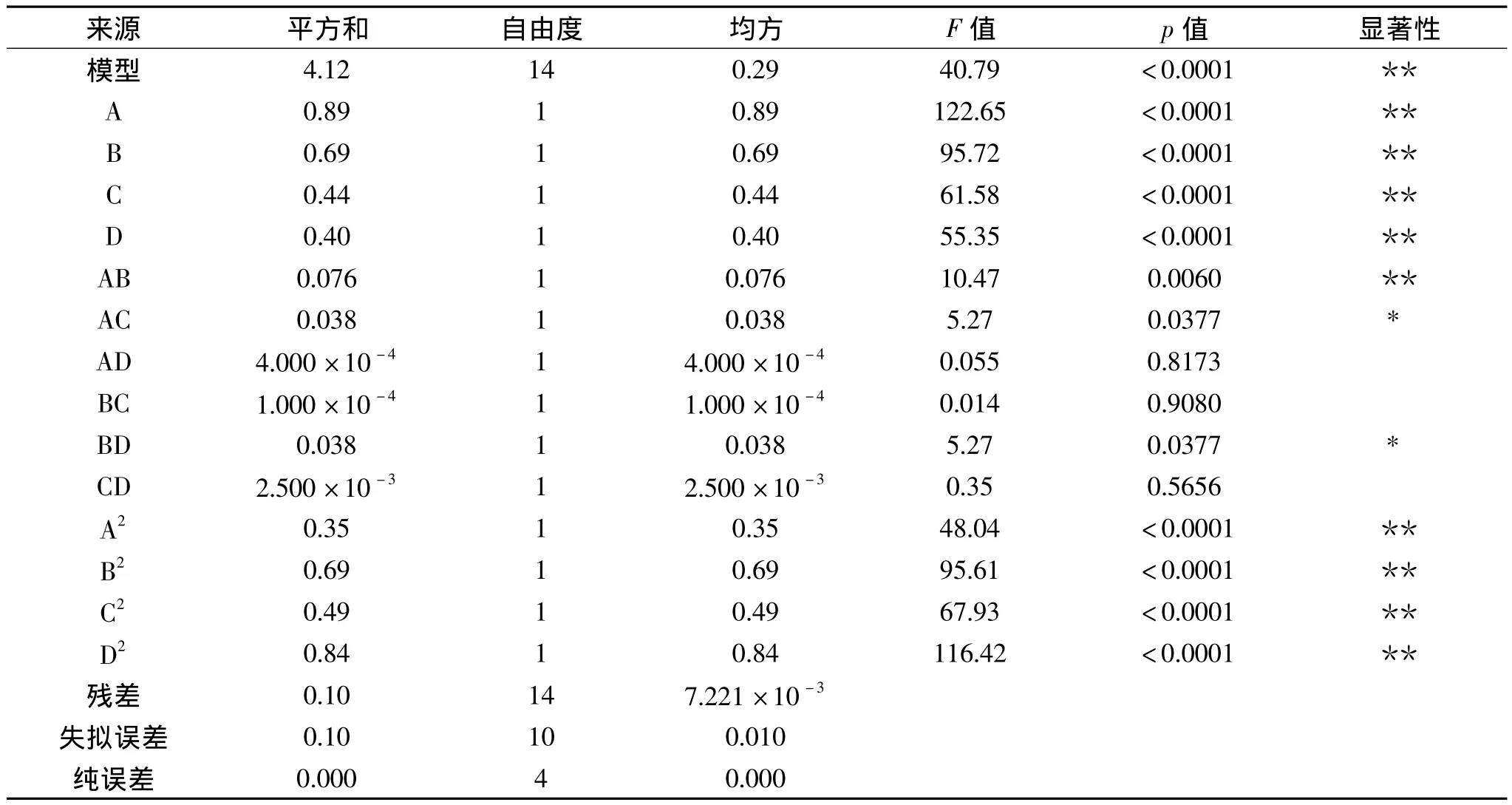
表3 响应面实验方差分析Table 3 Variance analysis for the developed regression model

式中:Y-抑菌圈直径(cm),A-超声功率(W),B-超声时间(min),C-乙醇浓度(%),D-浸提温度(℃)。
为检验方程的有效性,对超声波提取艾蒿抑菌成分的数学模型进行方差分析,结果如表3所示。
由表3可以看出,一次项回归模型均达到极显著水平(p<0.01),说明超声功率、超声时间、乙醇浓度和浸提温度对艾蒿抑菌成分提取有极显著影响,表明回归方程与实际情况吻合较好,实验误差小。所以可用该回归方程代替实验真实点对实验结果进行分析。交互项AB达到极显著水平(p<0.01),说明超声功率和超声时间交互项对艾蒿抑菌成分提取有极显著影响,交互项AC、BD达到显著水平(p<0.05),说明超声功率和乙醇浓度交互项、超声时间和浸提温度对艾蒿抑菌成分提取有显著影响。二次项A2、B2、C2、D2均达到极显著水平(p < 0.01)。回归模型中 A、B、C、D、AB、AC、BD、A2、B2、C2、D2作用显著。由各变量显著性检验F值的大小,可以得出艾蒿抑菌成分提取的各影响因素按大小依次排序为:超声功率、超声时间、乙醇浓度、浸提温度。
2.3 响应面及等高线分析结果
利用Design Expert7.0软件,根据回归方程分析作响应曲面见图7、图8、图9、图10。
如图7所示,超声功率与超声时间的曲面均较陡,说明超声功率与超声时间对抑菌圈直径的大小有极显著的影响。等高线趋近于椭圆形,说明超声功率与超声时间的交互项对抑菌圈直径的大小有极显著的影响。
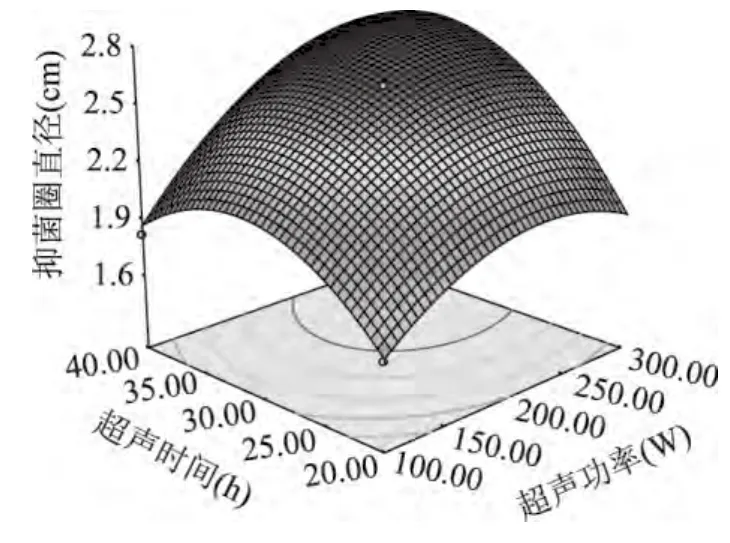
图7 超声功率与超声时间对艾蒿抑菌物质提取的影响的响应面图Fig.7 Response surface showing the effects of ultrasonic power and ultrasonic time on the Artemisia argyi antibacterial ingredient
如图8所示,超声功率与乙醇浓度的曲面明显的较陡,呈二次关系,说明超声功率与乙醇浓度对抑菌圈直径的大小有极显著的影响。等高线趋于椭圆形,表示这两个因素的交互项也对抑菌圈直径有显著的影响。
如图9所示,超声功率的曲面较陡,呈二次关系,对抑菌圈直径的大小影响较大,等高线呈圆形说明两因素的交互项影响不显著。
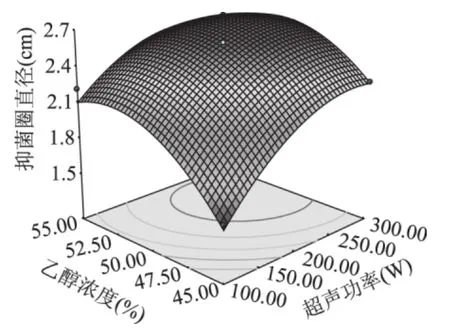
图8 超声功率与乙醇浓度对艾蒿抑菌物质提取的影响的响应面图Fig.8 Response surface showing the effects of ultrasonic power and ethanol concentration on the Artemisia argyi antibacterial ingredient
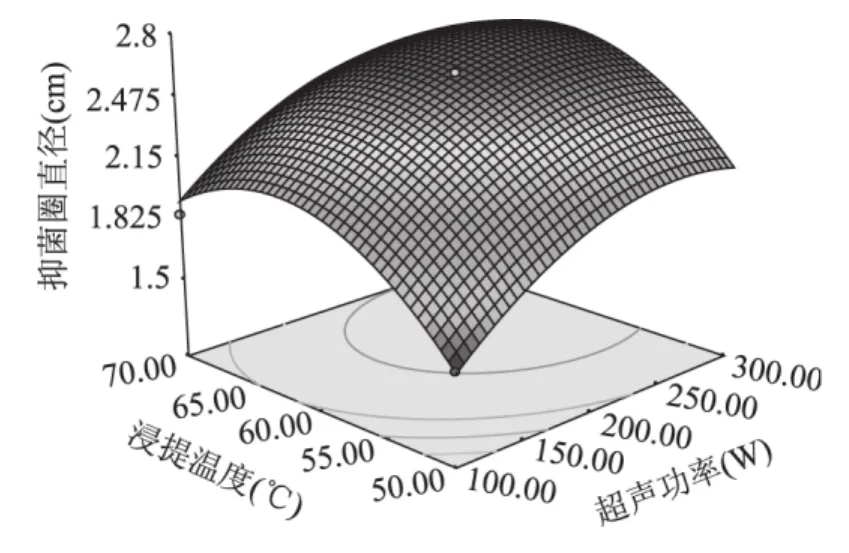
图9 超声功率与浸提温度对艾蒿抑菌物质提取的影响的响应面图Fig.9 Response surface showing the effects of ultrasonic power and extraction temperature on the Artemisia argyi antibacterial ingredient
如图10所示,超声时间与浸提温度的曲面均较陡,呈二次关系,说明超声时间与浸提温度对抑菌圈直径的大小有显著的影响。与此同时等高线趋于椭圆形,表示这两个因素的交互项也对抑菌圈直径有显著的影响。
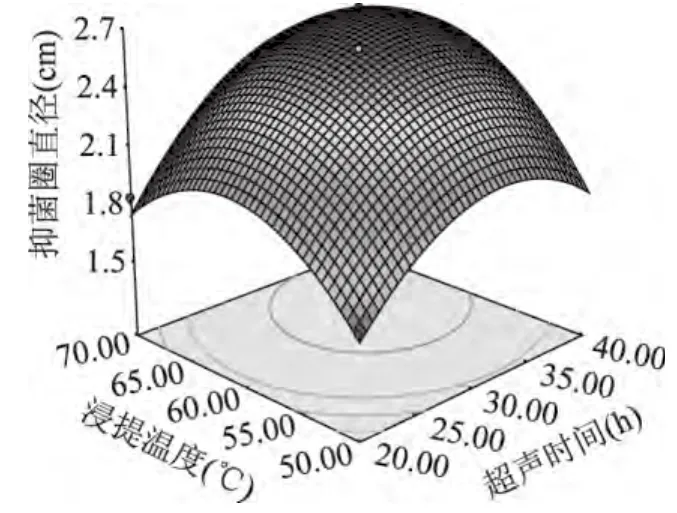
图10 超声时间与浸提温度对艾蒿抑菌物质提取的影响的响应面图Fig.10 Response surface showing the effects of ultrasonic time and extraction temperature on the Artemisia argyi antibacterial ingredient
2.4 超声波提取法响应面优化结果
经响应面7.0软件的数值优化与二次回归模型的数据分析,本研究提取艾蒿抑菌成分的最佳工艺参数为:超声时间为 35.62min、超声功率为 269.74 W、浸提温度为73.27℃、乙醇浓度为51.18%,大肠杆菌抑菌圈直径预测值为2.78cm。
2.5 野生艾蒿抑菌成分最佳提取条件的确定和验证实验
结合实际操作的数据真实性,并验证预测结果,在最佳提取工艺条件下:超声时间35min、超声功率270W、浸提温度73℃、乙醇浓度51%重复实验3次,结果艾蒿提取液抑菌圈直径为2.62cm。与预测值2.78cm相对误差为6.11%,说明该分析结果与实际操作结果拟合良好,充分验证所建模型正确性,说明响应面法适用于对野生艾蒿抗菌物质的超声提取工艺参数优化及回归分析。
3 结论
超声波辅助乙醇提取法的最佳工艺条件为:超声功率270W、超声时间35min、乙醇浓度51%、浸提温度73℃、乙醇浸提时间6h、料液比1∶15,该条件下,获得的艾蒿抗菌成分抑菌圈直径为2.62 cm。
[1]周峰,秦路平.艾叶的化学成分、生物活性和植物资源[J].药学实践杂志,2000,18(2):96-98.
[2]顾静文,刘立鼎.艾蒿和野艾蒿精油的化学成分[J].江西科学,1998,16(4):273-276.
[3]谢静华.艾蒿的开发利用前景[J].宁夏农林科技,2004,5:57-58.
[4]胡林峰,崔乘幸,吴玉博,等.艾蒿化学成分及其生物活性研究进展[J].河南科技学院学报,2010,38(4):75-78.
[5]孙红祥.一些中草药及其挥发性成分抗霉菌活性研究[J].中国中药杂志,2001,26(2):99-102.
[6]纪丽莲,张强华.八种菊科中草药抗霉菌及饲料霉变的研究[J].生命科学研究,2003,7(4):350-354.
[7]吴光旭,何庭玉,刘爱媛,等.植物中抗病原真菌的活性物质[J].植物学通报,2004,21(3):367-375.
[8]OZKAL S G,YENER M E,BAYINDIRLI L.Response surfaces of apricot kernel oil yield in supercritical carbon dioxide[J].Food Science and Technology,2005,38(6):611-616.
[9]刘军海,黄宝旭,蒋德超.响应面分析法优化艾叶多糖提取工艺研究[J].食品科学,2009,30(2):114-118.
[10]李亚娜.林永成.佘志刚.响应面分析法优化羊栖菜多糖的提取工艺[J].华南理工大学学报:自然科学版,2004,32(11):29-31.
[11]刘洋,赵谋明,杨宁.响应面分析法优化仙人掌多糖提取工艺的研究[J].食品与机械,2006,22(6):42-45.
[12]沈萍,范秀容.微生物学实验[M].第3版.北京高等教育出版社,1996.
[13]杨宇,陈晓平.响应面法优化野生艾蒿中抗菌成分工艺的研究[J].食品科技,2013,12(5):197-202.
[14]熊子文,罗丽萍,张丽丽.响应面法优化野艾蒿总黄酮的超声波提取工艺[J].食品科学,2011,32(8):38-42.
[15]戴喜末,熊子文,罗丽萍.响应面法优化野艾蒿多糖的超声波提取及其抗氧化性研究[J].食品科学,2011,32(8):93-97.
[16]罗兴武.艾蒿总黄酮的超声波提取工艺研究[J].食品研究与开发,2011,12(7):39-44.
[17]马烁,吴朝霞,张琦,等.艾蒿中总黄酮的提取及抑菌实验[J].中国食品添加剂,2011(2):71-78.
[18]江茂生,许文耀.艾蒿提取物对13种植物病原菌物的抑制作用[J].福建农林大学学报:自然科学版,2007,6(4):352-356.

