双水相萃取长鱼蛋白酶的工艺研究
刘 坤,李登超,陈 辉
(淮阴师范学院生命科学学院,江苏淮安223300)
长鱼,又名黄鳝,是一种重要的特种水产经济动物,其肉味鲜美,营养价值高,是滋补佳品。长鱼作为一种水产品,资源相当丰富,尤其在我国的中部及南方,但长鱼食用的下脚料常被丢弃,不仅造成资源浪费,而且造成污染环境。蛋白酶是一类重要的水解酶类,主要催化蛋白质水解为多肽或氨基酸。蛋白酶作为一种生物催化剂在食品、医药、化工和皮革制造等多方面有广泛应用,如洗涤剂、制革、毛皮、明胶以及纺织、医药品、化学品等的生产[1]。近年来,蛋白酶在啤酒、果酒等的澄清方面也显示出良好的应用前景[2]。该酶来源有限,急需开发新的蛋白酶源。以长鱼下脚料为研究对象,研究开发新的蛋白酶,来源丰富,价格低廉,前景广阔。近年来对长鱼蛋白酶类的研究开发逐渐引起许多学者关注,如江信红等人,对长鱼肠道蛋白酶进行了分离纯化,得到了蛋白酶纯品并对该酶的性质进行了初步研究,结果表明长鱼肠道蛋白酶属于丝氨酸蛋白酶类,且属于金属酶,等电点为 6.2,分子量约为 26ku[3-4]。目前提取蛋白酶的方法很多,包括盐析法,酸浸提法,等电点沉淀法和有机溶剂沉淀法等;这些方法往往存在生产周期长,工艺参数不确定,容易导致酶失活等一系列问题。双水相萃取技术,是近年来兴起的一种新型的萃取技术,和一般的分离技术相比,双水相萃取具有分离条件温和、耗能耗时低、安全环保,而且易连续化批量操作生产等优点[5-6]。双水相萃取技术同时保护酶的活性,很适合萃取分离有生物活性的大分子物质[7]。本项目以长鱼下脚料中的肠道为研究对象,采用双水相萃取技术,通过研究不同PEG分子量、不同的盐种类、盐浓度、不同pH等因素对长鱼蛋白酶萃取效率的影响,确定最佳的萃取工艺条件,为综合利用开发长鱼蛋白酶提供重要的理论依据,同时变废为宝,保护环境。
1 材料与方法
1.1 材料与仪器
长鱼下脚料 购于淮安市淮阴区农贸市场;PEG1000进口分装 广东光华化学厂有限公司;硫酸铵、硫酸镁 国药集团化学试剂有限公司;考马斯亮蓝-G250美国Amresco进口分装 南京汇百侍生物科技有限公司;其余试剂均为市售分析纯或生化试剂。
BS224S、TE612-L电子天平 北京赛多利斯仪器系统有限公司;自动可调移液器 Eppendorf;TDL-60B离心机 上海安亭科学仪器;5810R台式高速冷冻离心机 Beckman Culter;PHS-3D pH计 上海三信仪表厂;WH-3微型漩涡混合仪 上海沪西分析仪器厂有限公司;HH-S恒温水浴锅 金坛市亿通电子有限公司;UV757CRT紫外可见分光光度计 上海精密科学仪器有限公司。
1.2 实验方法
1.2.1 双水相体系建立 把(NH4)2SO4和 PEG400、PEG1000、PEG2000分别配制成四种适当已知高浓度的母液。用移液器准确吸取适当量的(NH4)2SO4加入50mL离心管中,再滴加适当的PEG溶液,混合,静置,直至开始出现浑浊为止,记录加入PEG的量和此时总体积;然后滴加适当量的H2O,直到恰好体系澄清为止,记下H2O的量,再滴加适当量的PEG,直至体系再次出现浑浊,重复以上操作。得到数据后计算每步的(NH4)2SO4和PEG的百分含量,以PEG的百分含量为纵坐标,(NH4)2SO4的百分含量为横坐标绘制相图;根据相图选择最理想的萃取配比数据。
1.2.2 长鱼蛋白酶粗提取物的制备 在长鱼下脚料中挑取肠道,用清水冲洗干净。然后与预冷50mmol/L Tris-HCl(pH7.5)按照 1∶2 的配比混合,用高速组织捣碎机,将其制成组织匀浆;均匀分装到离心管中,进行4℃,8000r/min离心30min,弃沉淀,留上清液;加入总体积(上清液体积+正丁醇体积)的25%的预冷正丁醇,边缓慢滴加边搅拌,充分混匀后4℃下低温萃取4h;用分液漏斗分液得上层丁醇酯相和下层长鱼蛋白酶水相。最后将长鱼蛋白酶水相分装到离心管中进行离心(4℃,4000r/min,30min),再除去离心管内长鱼蛋白酶水相中沉淀物和上层少量丁醇相油脂,得到下层水相长鱼蛋白酶粗提物。-20℃分批冷冻保藏水相长鱼蛋白酶粗提物,待用。
1.2.3 酶活力测定和蛋白质浓度测定
1.2.3.1 各种条件下的酶活均采用紫外分光光度法[8]具体步骤为:取 50mmol/L Tris-HCl、2%酪蛋白、稀释适当倍数的酶液、10%TCA(三氯乙酸)37℃下水浴5min,按以上顺序分别加入前三种物质1mL,继续置于37℃水浴5min后加入TCA溶液1mL终止反应。空白组加入1mL Tris-HCl缓冲液。3000r/min离心15min,用紫外分光光度计测多组A280值(装入离心上清液后,静置1min),求平均值。定义1min内水解酪蛋白释放出的可溶于三氯乙酸的物质让A280值变化0.001个吸光度值为一个酶活单位(U)。
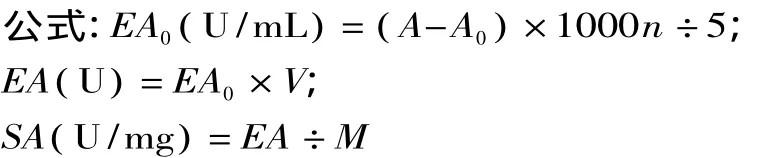
式中:EA0(U/mL)样液中长鱼蛋白酶活力;A样液平均A280;A0空白组平均A280;EA(U)样液中长鱼蛋白酶总活力;V(mL)样液体积;SA(U/mg)样液中长鱼蛋白酶比活力;M(mg)样液总蛋白;n稀释倍数;5表示5min。
1.2.3.2 各种条件下的蛋白质含量的测定 均采用考马斯亮蓝G-250法[9]称取适量牛血清白蛋白,配制成1mg/mL的BSA溶液。考马斯亮蓝G-250溶液:精确称取50mg的考马斯亮蓝G-250,溶于25mL 95%的CH3CH2OH中,然后加入85%的磷酸50mL,加纯水定容至500mL,边加边搅拌,4℃静置一夜,减压抽滤除杂质,最后4℃保存备用。1mL的待测液体和3mL的考马斯亮蓝G-250均匀混合,在595nm波长处5~40min内测定各组A595值,求平均值A。
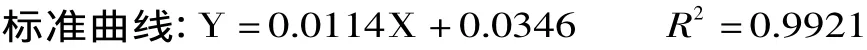
式中:Y为A595值;X为标准蛋白质含量,μg/mL。
1.2.4 双水相萃取长鱼蛋白酶 根据相图和各个物质物理性质选择合适配比,准确称取PEG于带刻度的试管中,加入已计算得到的母液体积(NH4)2SO4于试管中,然后加水定容至10mL,制成稳定的双水相体系。6℃左右环境下,向体系中加入适量长鱼蛋白酶提取液,充分振荡,混合均匀,静置。于37℃水浴反应后,2h内完成酶活力和蛋白质含量测定,并计算相比(VR)、酶比活力(SA)、纯化倍数(PF)、酶活回收率(η,%)。

2 结果与讨论
2.1 PEG/(NH4)2SO4成相关系图
图1显示,随着(NH4)2SO4质量分数逐渐增大,PEG质量分数逐渐减小;拟合曲线称为双节线,双节线以上的区域为两相区,以下的区域为均相区。在双节线的上方易形成双水相,靠近临界点的系统形成两相较难,远离临界点以上的区域比较容易,但是高聚物使双水相体系粘度增大,两相分离时间延长,PEG和(NH4)2SO4的质量分数应适中,使相分离时间尽可能短,为工业生产节约时间。制备相图时发现在PEG/(NH4)2SO4体系中,尽管在双节线上方可以形成两相,但是其成相过程只在一个较小的范围内才比较稳定。(NH4)2SO4质量分数15%~22%,PEG质量分数为12%~30%的双水相体系两相间有稳定的电位差,适合建立萃取长鱼蛋白酶的双水相体系[10]。故选择20%(NH4)2SO4和25%不同分子量PEG建立萃取长鱼蛋白酶的双水相体系,进而通过数据比对筛选出合适分子量PEG。
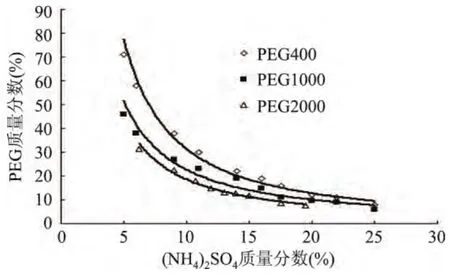
图1 不同分子量的PEG和(NH4)2SO4体系相图Fig.1 The phase diagrams of PEG/(NH4)2SO4aqueous two phase extraction
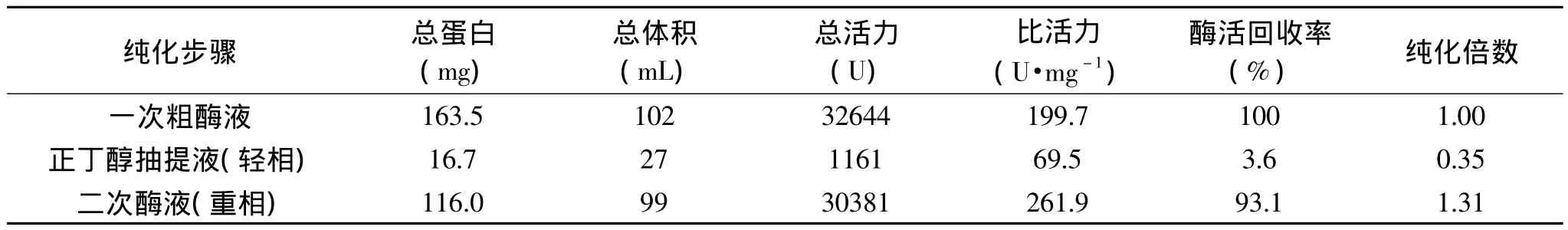
表1 长鱼蛋白酶的粗分离纯化结果Tabel 1 The results of crude separation and purification protease from Monopterus albus
2.2 长鱼蛋白酶二次分离纯化
长鱼下脚料经离心除沉淀物和正丁醇抽提除酯后,对两次分离纯化得到的蛋白酶液分别测总蛋白含量、总体积、总活力、比活力、酶活回收率和纯化倍数,计算得表1。由表1可知,正丁醇抽提液(轻相)除去约10.2%的脂蛋白,长鱼蛋白酶总活力回收率3.6%,几乎没有酶活回收率;二次酶液(重相)中总活力高达30381U,酶活回收率93.1%,故长鱼蛋白酶主要富集在重相,为后期双水相分离纯化长鱼蛋白酶提供实验基础。
2.3 不同分子量PEG对萃取效率的影响
根据相图规律及PEG400、PEG1000、PEG2000的物理性质,选择质量分数为25%的PEG和20%的(NH4)2SO4建立双水相体系。并用这些体系萃取长鱼蛋白酶,然后测出相比(VR),酶比活力(SA),纯化倍数(PF),酶活回收率(η,%)。表2数据显示,随着PEG分子量的增加,相比逐渐减小,说明分子内亲水性减弱,疏水性增强。PEG1000和(NH4)2SO4建立的双水相上相酶比活力和酶活回收率最佳,分别为921.5U/mg和 89.9%,故选择 PEG1000 适合萃取长鱼蛋白酶。
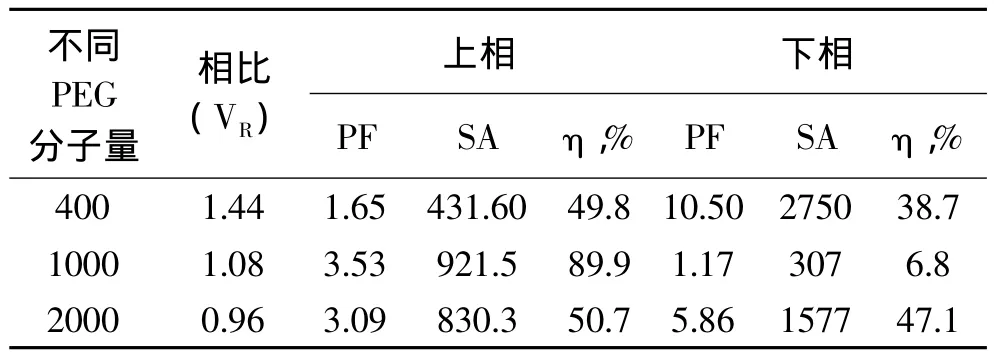
表2 不同PEG分子量萃取长鱼蛋白酶的影响Tabel 2 Effect of PEG molecular on extraction of protease from Monopterus albus
2.4 无机盐种类及其浓度对萃取效率的影响
用质量分数为25%的PEG1000和不同质量分数的无机盐建立双水相体系。表3数据显示,随着盐浓度的增加,相比在减小。主要是由于盐析作用,使得水有从上相转移下相的趋势。PEG1000/MgSO4体系上相酶活回收率相对20%(NH4)2SO4较低,且MgSO4的溶解度没有(NH4)2SO4的溶解度大(6℃左右),低温成相易有结晶析出,相比不稳定。25%的PEG1000和20%(NH4)2SO4建立的双水相上相酶比活力和酶活回收率最佳;故选择20%(NH4)2SO4萃取长鱼蛋白酶较佳。
2.5 不同质量分数的PEG1000对萃取效率的影响
用质量分数为20%的(NH4)2SO4和不同质量分数的PEG1000建立双水相体系。表4数据显示,随着PEG1000质量分数的增加,相比逐渐增大、纯化倍数和酶活回收率先增大后减小。PEG1000浓度增大,分子内亲水性增强,疏水性减弱,分子表面张力减弱,长鱼蛋白酶趋于向上相分配,所以相比增大。另一方面,PEG1000浓度增大,体系粘度增大,分子间阻力增大,阻碍蛋白酶向上相分配,所以纯化倍数和酶活回收率先增大后减小。20%(NH4)2SO4和25%PEG1000建立的双水相上相酶比活力和酶活回收率最佳,故选择25%PEG1000比较适合萃取长鱼蛋白酶。
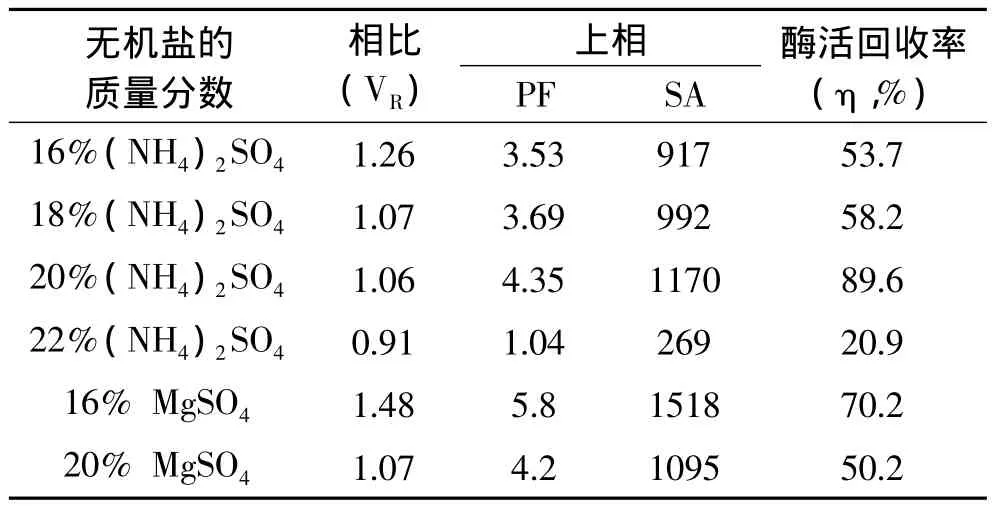
表3 无机盐种类及其浓度萃取长鱼蛋白酶的影响Tabel 3 Effect of different kinds of inorganic salts and their concentrations on extraction of protease from Monopterus albus
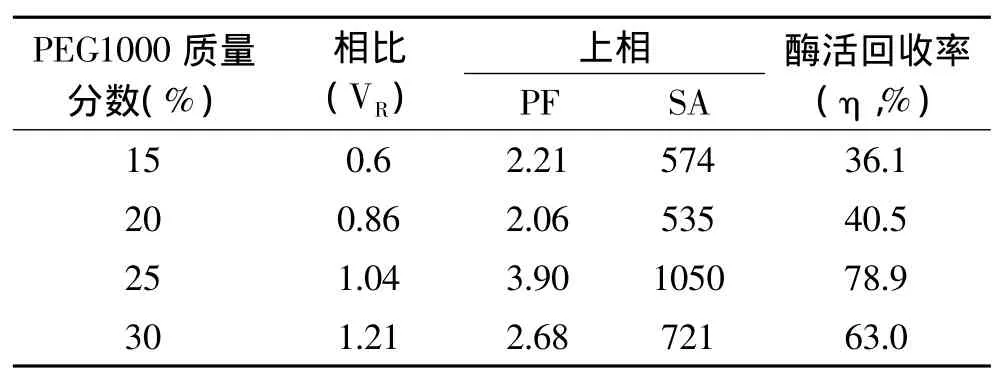
表4 不同质量分数的PEG1000萃取长鱼蛋白酶的影响Tabel 4 Effect of PEG1000 concentrations on extraction of protease from Monopterus albus
2.6 不同pH对萃取效率的影响
综合上述所得结果,选用25%PEG1000和20%(NH4)2SO4建立的双水相体系萃取长鱼蛋白酶,并改变体系的pH。表5数据显示,随着pH的增大,相比、纯化倍数和酶活回收率先增大后减小。体系pH的变化会改变蛋白酶表面的电荷数,因而改变分配系 数。pH 为 7.0 的 25% PEG1000 和 20%(NH4)2SO4建立的双水相体系上相纯化倍数为4.40和酶活回收率为90.5%,故选择体系pH7.0时比较适合萃取长鱼蛋白酶。
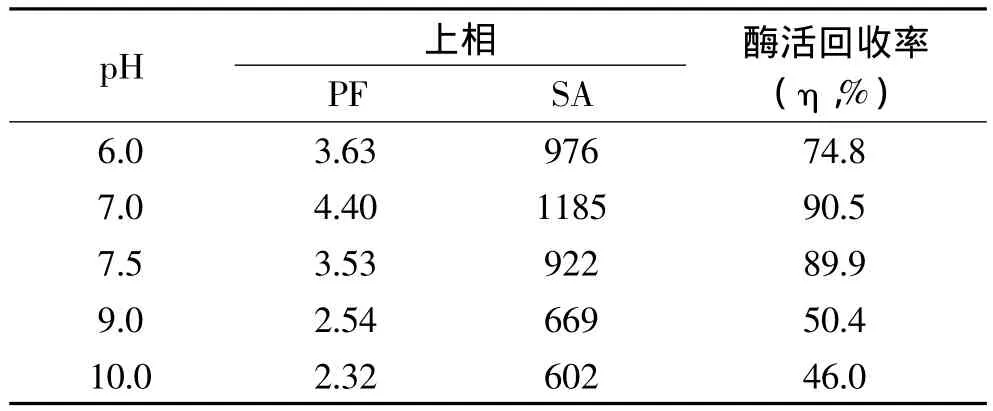
表5 不同pH对萃取长鱼蛋白酶的影响Tabel 5 Effect of pH on extraction of protease from Monopterus albus
3 结论
通过考察影响PEG/盐双水相系统分离纯化长鱼肠道蛋白酶的因素,确定了适宜的双水相体系为25%PEG1000、20%(NH4)2SO4和 pH7.0。长鱼肠道蛋白酶主要富集在上相中,在最佳的双水相体系中,酶活回收率90.5%,上相纯化倍数为4.40。
[1]胡学智,王俊.蛋白酶生产和应用的进展[J].工业微生物,2008,38(4):49-61.
[2]Nielsen P K,Foltmann B.Purification and characterization of porcine pepsinogen B and pepsin B[J].Arch Biochem Biophys,1995,322(2):417-422.
[3]江信红,唐云明.黄鳝肠道蛋白酶的分离纯化及其性质[J].中国水产科学,2005,12(3):329-334.
[4]江信红,唐云明.黄鳝蛋白酶的化学修饰[J].西南师范大学学报,2005,30(2):346-349.
[5]冯自立,马娜.无花果蛋白酶在PEG/(NH4)2SO4双水相体系中的分配行为[J].食品科学,2010,31(19):67-70.
[6]张儒,张变玲,谢涛,等.聚乙二醇/硫酸铵双水相萃取猪胃蛋白酶工艺研究[J].食品工业科技,2012,33(15):245-246.
[7]Shahbaz Mohammadi H,Omidinia E,Taherkhani H.Rapid one-step separation and purification of recombinant phenylalanine dehydrogenase in aqueous two-phase systems[J].Iran Biomed J,2008,12(2):115-122.
[8]粟桂娇,阎欲晓,陈春宁.双水相萃取分离米曲霉中性蛋白酶[J].食品科技,2012,37(1):9-12.
[9]魏群.基础生物化学实验(第三版)[M].北京:高等教育出版社,2009:129-131.
[10]赵新颖,屈锋,董敏,等.双水相萃取结合液相色谱法分离蛋白质[J].分析化学,2012,40(1):38-41.

