茉莉花中黄酮化合物的超声提取与测定
杨莉莉,侯冬岩,回瑞华
(1.辽宁师范大学化学化工学院,辽宁大连116029;2.鞍山师范学院化学与生命科学学院,辽宁鞍山114007)
茉莉,木犀科素馨属植物,是一种闻名世界的香料植物.茉莉主要含有挥发油、脂肪酸、苷类、苯丙素类、三萜类、生物碱、黄酮苷类等化学成分[1].黄酮类化合物是优良的活性氧清除剂和脂质抗氧化剂,已成为国内外天然药物和功能食品开发研究的热点[2-3].相关药理和临床试验证实,黄酮类化合物具有广泛的药理功能,如不少治疗冠心病有效的中草药或活血化瘀类中药中均含有黄酮类化合物,芦丁(rutin)、槲皮素(quercetin)、葛根素(puerarin)、人工合成的立可定(recordin)等均有明显的扩冠作用,并己用于临床;染料木素(genistein)、金雀花异黄酮(5,7-dihydroxy-4’-methoxy-isoflavone)、大豆甙元(daidzein)等均有雌性激素作用[4-5],还有许多黄酮类化合物被证明有抗癌和抗HIV病毒活性[6-7].由于其具有多样的生物活性和药理功能,而且毒性较低,因此,黄酮类物质备受重视,其提取工艺的研究就显得颇为重要[8].本文针对其黄酮类化合物,采用超声波法从干茉莉花中提取黄酮类化合物,并得出最佳提取条件,用紫外光谱法测定黄酮化合物的含量.旨在促进茉莉花资源能够得到更好的开发和利用.
1 实验部分
1.1 仪器与试剂
1.1.1 主要仪器 UV-036紫外分光光度计(美国Varian公司);RE-52C旋转蒸发器(上海亚荣盛华仪器厂);HH-2电子恒温水浴锅(深圳天南海北实业有限公司);KQ-250B型超声波清洗器(昆山市超声仪器有限公司);AL 204电子天平(梅特勒-托利多公司(上海)有限公司);台式离心机-80-2B(上海安亭科学仪器厂);SHZ-D(Ⅲ)循环水式真空泵(巩义市英峪予华仪器厂).
1.1.2 试剂 芦丁标准品;甲醇(分析纯,天津化学试剂有限公司);无水乙醇、正己烷、乙酸乙酯、亚硝酸钠、硝酸铝、氢氧化钠(均为分析纯,天津市光复精细化工研究所).
1.1.3 样品处理 干茉莉花,经研磨后备用.
1.2 溶液的制备
1.2.1 芦丁标准储备液的制备 精密称取芦丁对照品0.020 g,加入60%乙醇溶解并稀释至25 mL容量瓶中,得0.8 mg/mL芦丁标准品溶液.
1.2.2 样品溶液的制备 称量干茉莉花粉末1.00 g,置于锥形瓶中,加入25 mL体积分数为80%的乙醇,30℃水浴中超声波提取50 min,抽滤.滤渣以同法提取50 min后抽滤,2次滤液合并,用旋转蒸发仪浓缩至7 mL,将浓缩液离心10 min,得样品液.
1.3 实验方法
取1.2.1芦丁标准储备液或1.2.2样品溶液一定量,加5%亚硝酸钠溶液0.3 mL,摇匀,静置4 min,加10%硝酸铝溶液0.3 mL,摇匀,静置4 min,再加4%氢氧化钠溶液4.0 mL,用60%乙醇定容至刻度,摇匀,静置10 min.以试剂空白为参比,于510 nm处测吸光度.
1.4 吸收曲线的绘制及测定波长的确定
按1.3实验方法,在400~800 nm范围内扫描标准品和样品,结果如图1,2.
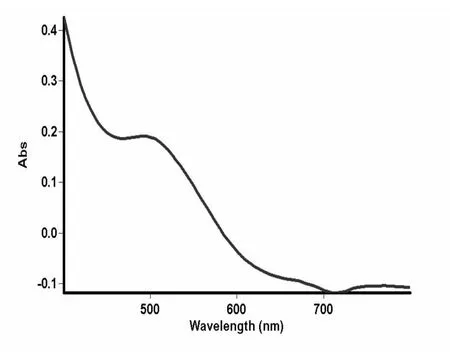
图1 芦丁标品紫外吸收光谱图
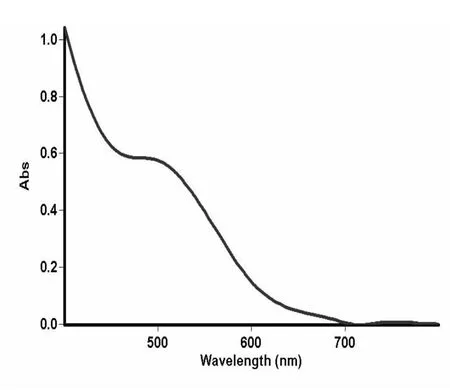
图2 茉莉花样品液紫外吸收光谱图
由上可知,超声波法提取茉莉中的总黄酮可用芦丁做黄酮标准品,测定波长为510 nm.
1.5 标准曲线的绘制
分别取1.2.1 制备的芦丁标准储备液0.25,0.50,0.60,0.70,0.80,0.90,1.00,1.10 mL,置于 10 mL 容量瓶中,按1.3实验方法,结果如表1和图3所示.

表1 芦丁标准曲线数据
以芦丁质量浓度(C)为横坐标、吸光度(A)为纵坐标,绘制标准曲线,如图3所示.
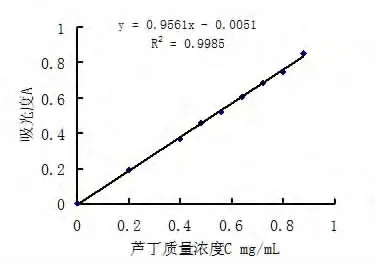
图3 芦丁标准曲线
求得吸光度A与芦丁质量浓度C关系的线性回归方程为:A=0.956 1C -0.0051,相关系数r=0.999 0,说明对照品在0.20~0.88 mg/mL范围内,A与浓度C呈良好线性关系,可按标准曲线法进行定量分析.
2 结果与分析
2.1 影响茉莉花中总黄酮提取率的单因素实验
2.1.1 不同溶剂对黄酮提取率的影响[9]分别称取4份1 g茉莉花粉末样品,分别以25 mL甲醇、乙醇、正己烷、和乙酸乙酯于锥形瓶中,在30℃的水浴中超声提取50 min,抽滤.滤渣以同法提取50 min后抽滤,2次滤液合并,旋转蒸发滤液,浓缩液离心10 min,得到4份样品液.从中各取0.1 mL置于10 mL容量瓶中,按1.3实验方法,结果见表2.

表2 提取溶剂对提取率的影响
由表2中可看出,用乙醇作溶剂时,吸光度为最大,提取率最高,所以选择乙醇做提取剂.
2.1.2 物料比对黄酮提取率的影响 分别称取4份1 g茉莉花粉 末 样品,物料比分别为1∶10,1∶15,1∶20,1∶25,1∶30,1∶35,乙醇做溶剂,其它实验条件同 2.1.1,实验结果见图 4.
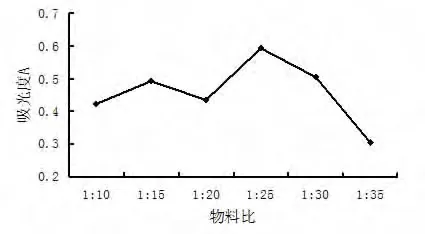
图4 物料比对黄酮提取率的影响
结果表明,在超声作用下,溶剂量的适当增大有利于黄酮提取率的提高,但是当物料比超过1∶25,随着溶剂量的增多,黄酮提取率却下降.因此,应选择合适的物料比,本实验取物料比为1∶25.
2.1.3 乙醇浓度对黄酮提取率的影响 分别称取5份1 g研磨后的茉莉花粉末样品,分别以25 mL60%乙醇、70%乙醇、80%乙醇、90%乙醇、无水乙醇为溶剂于锥形瓶中,其它实验方法同2.1.2,实验结果见图5.
由结果可知80%乙醇的提取率最高,所以选择80%乙醇作为提取溶剂.2.1.4 超声提取时间对黄酮提取率的影响 超声提取时间分别为10,20,30,40,50 min,1 h,80%乙醇做溶剂,物料比1∶25,其它实验方法同2.1.3,实验结果见图6.
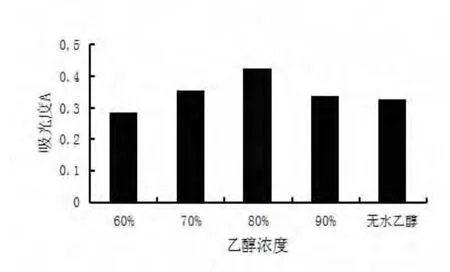
图5 乙醇浓度对黄酮提取率的影响
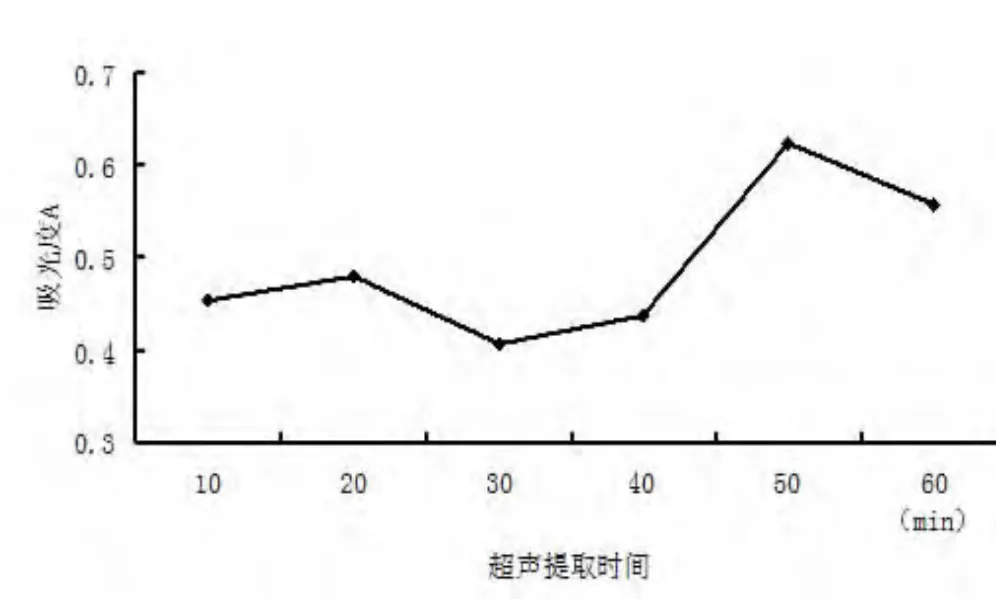
图6 超声提取时间影响黄酮提取率
结果表明,适量增加提取时间有利于黄酮提取率的提高,但是当提取时间超过50 min时,随着提取时间的增加,黄酮提取率却下降.因此,本实验取超声提取时间为50 min.
综上所述,茉莉花中黄酮的最佳提取条件为物料比为1∶25,80%乙醇做溶剂,超声提取时间为50 min.
2.2 方法精密度
移取1.2.1中0.6 mL的芦丁标准溶液,按1.3实验方法,做9次,测定其吸光度,求得标准偏差和变异系数,结果见表3.

表3 方法精密度
2.3 方法回收率
取经 1.2.2 处理后样品储备液 0.1 mL3 份,分别加入经1.2.1 处理后芦丁标准品 0.1,0.2,0.3 mL按1.3方法操作,测定吸光度,求得该方法的回收率,结果见表4.

表4 方法回收率
可以看出,此方法的回收率为98% ~100%,变异系数0.015%,方法的准确度与精密度均较高.
2.4 方法稳定性
取1.2.2制备的样品储备液适量,按1.3实验方法,进行稳定性实验,结果表明:样品放置20 min,测得其吸光度值基本不变.
2.5 茉莉花样品中总黄酮含量测定
按确定的最佳提取条件制备样品液.从样品溶液中,准确吸取0.1 mL于10 mL容量瓶中,按1.3实验方法,平行测定3次,其吸光度见表5.

表5 茉莉花样品中黄酮的测定
3 结论
实验结果表明,超声波提取方法工艺简单,可以达到省时、高效、节能、无污染的目的,是一条理想的提取黄酮类物质的途径,具有广阔的应用前景[9].本实验结果表明,茉莉花中含有较为丰富的黄酮,与其它花类相比较,茉莉花中黄酮含量大于合欢花[10]、鸡冠花[11],金银花[12]、蒲公英花[13]、沙枣花[14],佩兰[15]、万寿菊[16],因此茉莉花具有广泛开发和利用价值,值得深入研究.
[1]黄桂丽.茉莉的化学成分与药理作用的研究进展[J].中外医疗.2010,11(33):113-114.
[2]李世敏.功能食品加工技术[M].北京:中国轻工业出版社,2003,121.
[3]杨淑文,马兴,汪业菊.柚皮总黄酮的提取及其抗氧化活性研究[J].辽宁师范大学学报:自然科学版,2011,34(2):225.
[4]Harbome J B.The Flavonoids Advances in Research since 1986[M].London:Chapman & Hall,1994,676.
[5]Yu O,McGonigle B.Metabolic engineering of isoflavone biosynthesis[J].Advances in Agronomy,2005,86:147.
[6]Habtemariam S.Flavonoids as inhibitors or enhancers of the cytotoxicity of tumor Necrisis factwra in L-929 tumor cells[J].J Nat Prod,1997,60(8):775.
[7]Hu C Q,Chen K,Shi Q,etal.Anti-AID sagents,10,acacetin-7-O-β-D-galactopyranoside,an anti-HIV principle from chrysanthemum 69 morifolivm and a structure activity correlation with some related flavonoids[J].J Nat Prod,1994,57(1):42.
[8]李凌智.新疆紫茉莉黄酮类化合物及色素的初步研究[D].新疆:新疆大学食品科学,2010.
[9]侯冬岩,回瑞华,李学成,等.洋葱皮中黄酮化合物的超声提取与光谱分析[J].食品科学,2006,27(9):172-174.
[10]罗建华.茉莉花植物总黄酮的超声波提取及鉴别[J].微量元素与健康研究,2007,24(5):49-51.
[11]袁建梅.合欢花中总黄酮的提取工艺及对羟自由基清除作用的研究[J].中国食品添加剂,2012,11(1):87-92.
[12]侯冬岩,回瑞华,刘晓媛.鸡冠花花叶茎中黄酮类化合物提取工艺的研究[J].鞍山师范学院学报,2008,10(2):11-14.
[13]回瑞华,杨梅,唐蕊.金银花中总黄酮的光谱分析及抗氧化性能测定[J].分析试验室,2004,23(11):52-56.
[14]宁坚刚.蒲公英花中黄酮类物质的提取和含量测定[J].青海大学学报,2004,22(4):59-61.
[15]石玉平.沙枣花中黄酮类化合物的提取[J].南京林业大学学报,2005,29(2):106-109.
[16]侯冬岩,回瑞华,许冰.佩兰中黄酮类化合物提取工艺的研究[J].鞍山师范学院学报,2006,8(6):14 -18.
[17]侯冬岩,回瑞华,刘晓媛.万寿菊花叶茎中黄酮的含量及抗氧化性能的分析[J].鞍山师范学院学报,2008,10(4):15-18.

