I期非小细胞肺癌淋巴结清扫中胸腔镜手术的效果
贾 辉,俞明锋,胡振东,任斌辉,尹 荣,张 治,邱宁雷,许 林
(江苏省肿瘤医院胸外科,江苏 南京210009)
目前,肺癌发病率呈升高趋势,以手术为主的综合治疗是非小细胞肺癌(non-small cell lung cancer,NSCLC)的主要治疗方法。淋巴结转移是肺癌术后复发和转移的主要因素,在肺癌外科手术中常常需要行系统性淋巴结清扫。胸腔镜技术有创伤轻、恢复快、住院时间短等优点,在胸外科应用日益广泛。胸腔镜肺癌根治术主要应用于I期NSCLC。然而其应用仍然存在一定争议,主要原因在于其清扫淋巴结的局限性。作者对比研究胸腔镜与开胸淋巴结清扫的差异,并总结报道如下。
1 资料与方法
1.1 一般资料 自2007年10月至2011年10月,我院胸腔镜手术治疗I期NSCLC 患者74 例(胸腔镜组)和同期开胸治疗I期NSCLC 患者80 例(开胸组)。所有病例经术前肺穿刺明确病理学诊断或在术中快速病理获得诊断。术前均行头颅MRI、ECT、上腹部CT 检查以排除远处转移可能;胸部CT 扫描(平扫加增强)以评价肿瘤的临床分期,纵隔淋巴结直径小于1 cm 为不肿大;纤维支气管镜列为常规。其他检查包括血常规、血生化、心电图、心脏超声、血气分析和肺功能检测。
胸腔镜组有1 例在术中因胸腔广泛致密粘连而中转开胸,排除在研究之外,2 例术中发生胸腔镜下难以控制的出血而中转开胸,中转开胸率2.7%,胸腔镜组术后大出血2 例,出血来源于肺裂断面,此5 例不入组。开胸组中胸腔广泛致密粘连4 例,因其术后胸腔引流量可能来自粘连分离后的创面,影响观察指标,故排除在研究之外。术后胸腔大出血再次开胸2 例,其出血分别来源于支气管动脉和胸顶粘连带的出血,并非来源于淋巴结清扫术后的创面,不纳入研究分组。这样,正式纳入研究的胸腔镜组69 例,开胸组74 例。2 组患者在性别比例、年龄,体质量、病灶大小及部位方面具有可比性(P >0.05)。见表1。

表1 2 组一般资料比较
1.2 方法 麻醉采用双腔气管插管加静脉复合全身麻醉。术前未能明确病理学诊断的肺部肿块,手术先行肿块所在肺叶楔形切除术,行快速病理学检查,如为良性病变,手术结束,病例不纳入研究。如快速病理学诊断为肺癌,则行标准肺叶切除或双肺叶切除(主要是右中肺叶的切除与否)加淋巴结清扫术。淋巴结清扫包括N1和N2组淋巴结。
胸腔镜组:取健侧卧位,手术床头部、肩部放低,使胸部凸向上呈“折刀位”约20° ~30°,健侧单肺通气,使患侧肺完全萎陷。在腋中线第7 肋间作2 cm 观察孔放置胸腔镜套管,置入胸腔镜。探查胸腔无胸膜转移后,决定手术。于腋前线第4 ~5 肋间做约5 cm 操作孔,腋后线第5 ~6 肋间作2 cm 操作孔。系统性淋巴结清扫包括纵隔、隆突下、肺门及叶间淋巴结。采用电钩游离淋巴结包膜后,以超声刀分离、离断淋巴结周围组织,清扫淋巴结,并止血。其中,隆突下淋巴结在支气管离断前清扫。将切除的标本装入标本袋自胸壁操作孔取出。
开胸组:健侧侧卧位,经第5 肋间,标准胸后外侧切口,行常规肺叶切除+淋巴结清扫术,淋巴结清扫范围包括纵隔、隆突下、肺门及叶间淋巴结。
1.3 观察指标的选择 右侧病变无论是上叶切除、中叶切除还是下叶切除,均行系统性纵隔及肺门淋巴结清扫,左侧同样。因此淋巴结清扫数量比较采取左右分别比较,而不是按照手术方式进行比较。淋巴结按照N1组或N2组进行分层。在胸内无明显粘连、I期肺癌,淋巴结清扫与否和术中出血量、术后胸腔引流量有一定的关系,心肺相关并发症与手术的创伤有明确关联,因此本研究选择了术中出血量、术后胸腔引流量、声音嘶哑发生率及心肺总并发症发生率作为与淋巴结清扫有关的指标。
1.4 统计学处理 采用SPSS 11.0 进行数据分析,计量数据比较分析采用t 检验,率的比较采用χ2检验,检验水准α=0.05。
2 结果
2 组均无手术死亡病例。术后病理类型及术后病理分期见表2。清扫淋巴结数目见表3。术后并发症发生情况见表4。
3 讨论
胸腔镜手术切口小、对肺功能影响小,因而具有创伤轻、术后疼痛轻、并发症少、恢复快、住院时间短和对美容的影响小等优点,被越来越多的患者接受[1]。缺点是对有胸膜腔严重粘连的病变胸腔镜下暴露不佳,分离粘连困难而且手术危险性增大;对有肺门纵隔淋巴结肿大者清扫淋巴结有一定难度,对手术技巧要求较高,尤其是左上肺叶的切除。因而目前临床上仅限于I 期肺癌的治疗。
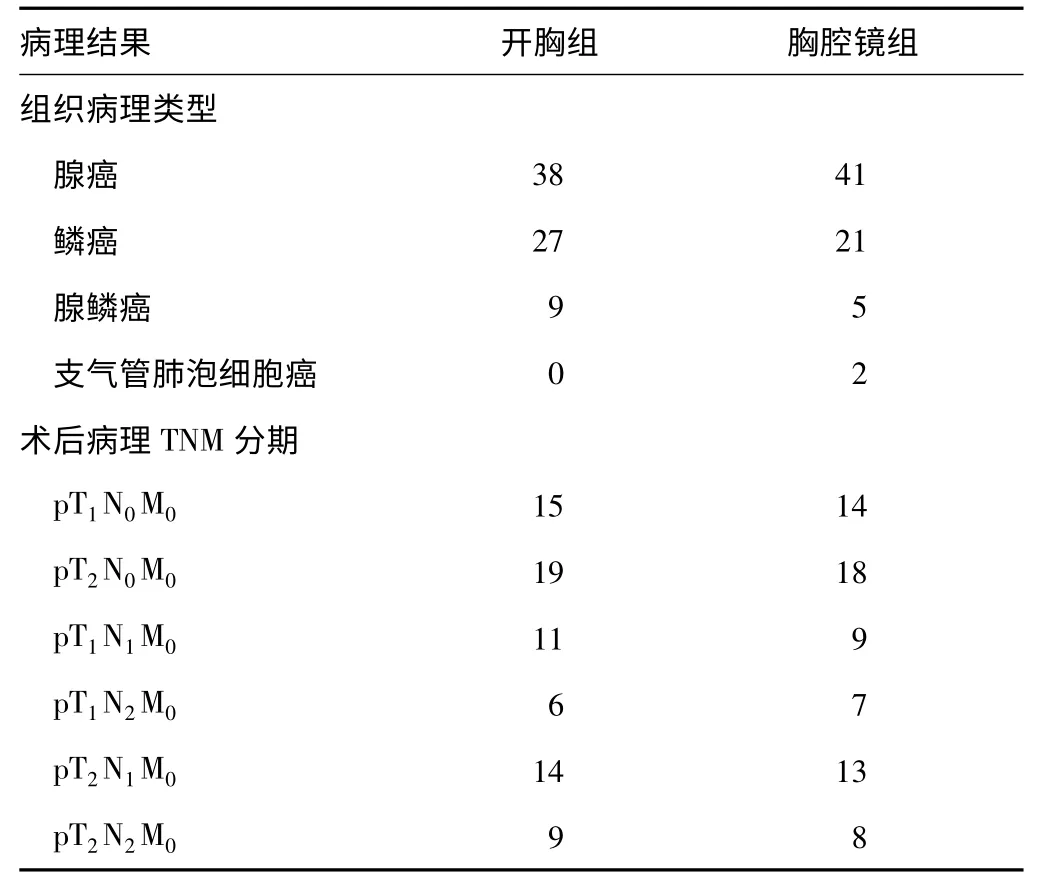
表2 2 组病例术后病理类型及病理分期
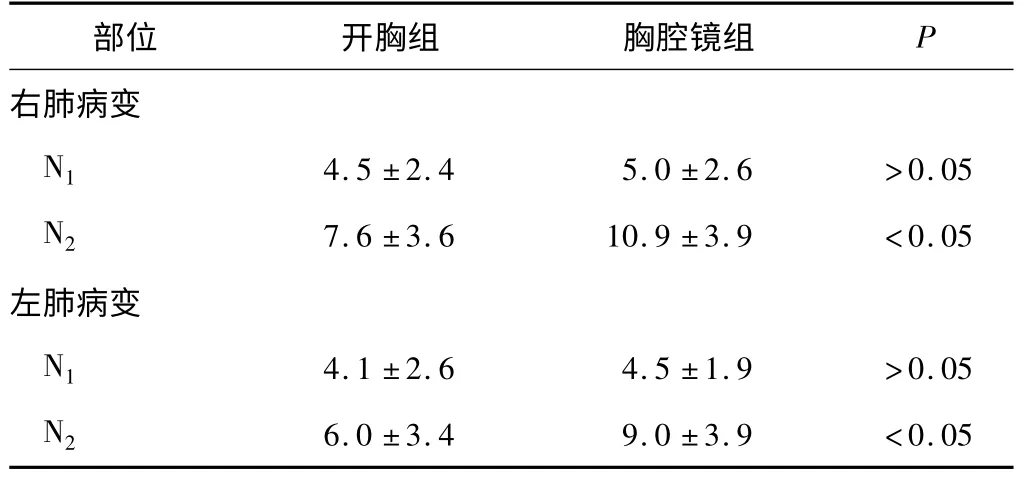
表3 2 组淋巴结清扫数目比较
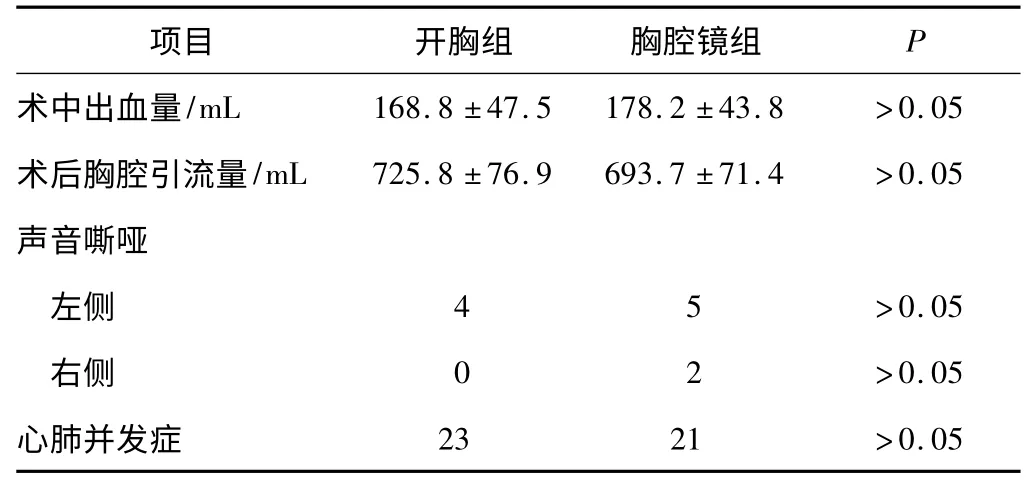
表4 2 组病例术后观察指标比较
但是,胸腔镜肺癌手术仍然存在争议:是否足够安全及是否符合肿瘤外科原则。现在,随着胸腔镜的应用日趋广泛,胸腔镜Ia 期肺癌手术是安全可行的[2-3]。一项Meta 分析研究中发现,胸腔镜和开胸肺叶切除术在术后肺漏气时间、心率失常、肺炎及死亡率方面比较差异无统计学意义[4],本研究结果与其相似,同样说明胸腔镜手术的安全性与开胸手术相近。而且,随着技术的成熟,胸外科医生开始尝试将胸腔镜技术应用于更复杂的肺癌手术,比如袖式肺叶切除。但是否符合肿瘤外科原则尚无明确定论。
对于I期肺癌,胸腔镜手术切除肿瘤能够达到切缘阴性,更为让外科医生担心的是淋巴结清扫是否完全,而淋巴结清扫与预后有密切关联。一项研究[2]报道了胸腔镜辅助小切口形肺叶切除术加淋巴结清扫术后,再开胸行淋巴结清扫,旨在评估胸腔镜辅助下肺癌根治术的淋巴结遗漏情况,并得出结论:胸腔镜辅助肺癌根治术中淋巴结清扫可以接受。但其操作50%在直视下小切口(8 cm)完成。这种小切口有助于完成淋巴结清扫。本研究胸腔镜组是标准胸腔镜即全胸腔镜下行肺癌根治术,其淋巴结清扫是在全胸腔镜下完成的,最大的操作孔切口长约5 cm。
本研究中发现胸腔镜组在N2淋巴结清扫的数量均高于开胸组。原因可能在于胸腔镜的特殊放大作用。在胸腔镜下,视野放大数倍,易于发现细小、肉眼易于忽略的淋巴结。此外,胸腔镜的器械容易达到常规开胸不易到达的部位,如胸顶锁骨下静脉部位及隆突下靠近对侧主支气管部位,从而顺利清扫此部位的淋巴结。
然而对于右肺病变,胸腔镜组发生2 例声音嘶哑,而开胸组右肺手术未发生。分析原因亦与胸腔镜手术有关。由于胸腔镜的上述2 点优势,位于右锁骨下静脉附近的高位淋巴结被发现,此处淋巴结在胸腔镜下易于切除而开胸时不易发现和切除,从而促使外科医生试图去整块切除。因而就容易误伤右侧喉返神经,导致声音嘶哑。左肺病变2 种手术方式均可造成声音嘶哑,发生率相近。
综上所述,我们认为在I期NSCLC 根治术中,胸腔镜下系统性淋巴结清扫在技术上达到了肺癌指南的标准,符合肿瘤外科原则,并发症并未较常规开胸手术增加;而术后恢复却更快,患者的痛苦更小,亦即在同样的手术效果下,患者接受了微创手术,符合人性化的治疗原则,但是可能的代价是相对较高的医疗费用和对麻醉的较高要求[5]。
[1]Jiménez MF,Spanish Video-Assisted Thoracic Surgery Study Group.Prospective study on video-assisted thoracoscopic surgery in the resection of pulmonary nodules:209 cases from the Spanish Video-Assisted Thoracic Surgery Study Group[J]. Eur J Cardiothorac Surg,2001,19(5):562 -565.
[2]Sagawa M,Sato M,Sakurada A,et al.A prospective trial of systematic nodal dissection for lung cancer by video-assisted thoracic surgery:can it be perfect[J]. Ann Thorac Surg,2002,73(3):900-904.
[3]McKenna RJ Jr,Houck W,Fuller CB. Video-assisted thoracic surgery lobectomy:experience with 1 100 cases[J]. Ann Thorac Surg,2006,81(2):421 -425.
[4]Yan TD,Black D,Bannon PG,et al.Systematic review and meta-analysis of randomized and nonrandomized trials on safety and efficacy of video-assisted thoracic surgery lobectomy for early-stage non-small-cell lung cancer[J]. J Clin Oncol,2009,27(15):2553-2562.
[5]孙来荣,顾连兵.胸腔镜下行肺癌手术时单肺通气的麻醉分析[J].肿瘤基础与临床,2012,25(6):521 -523.

