蛋白酶体抑制剂MG132减轻糖尿病大鼠肾小管间质纤维化
王圆圆,刘丽荣,李 霜,郭 兵,石 磊,石明隽,肖 瑛
在糖尿病肾病(diabetic nephropathy,DN)发生发展过程中,转化生长因子-β1(transforming growth factor-β1,TGF-β1)激活其下游的 Smad2/3,导致其目的基因的转录活化,促进肾小管上皮细胞(renal tubular epithelial cells,RTECs)向间质细胞转化(epithelial to mesenchymal transition,EMT)及细胞外基质(extracellular matrix,ECM)的合成和过度沉积,造成广泛的肾组织纤维化[1-5]。Smad7 作为抑制性Smad蛋白,可抑制 TGF-β1/Smads信号通路致纤维化效应[1,6]。然而在 DN 进程中,Smad7蛋白的表达是显著下调的,其机制可能与Smad泛素化调节因子2(Smad ubiquitin regulatory factor 2,Smurf2)介导的泛素化降解有关[1,7]。蛋白酶体抑制剂 MG132能对抗糖尿病介导的肾损伤[8-10],但其抑制肾小管-间质纤维化的机制尚不甚清楚。本研究旨在观察DM大鼠肾组织Smurf2、Smad7蛋白及纤维化相关指标的表达变化,并用MG132处理RTECs后高糖培养,观察对 Smad7和 Smurf2及EMT和ECM相关指标的影响,探讨MG132治疗肾小管-间质纤维化的机制,为MG132治疗DN提供理论依据。
1 材料与方法
1.1 主要材料与试剂
链脲菌素(streptozotocin,STZ)和MG132(Sigma公司);胎牛血清(Gibco Introvagen公司)、低糖DMEM培养液(Hyclone公司);Rabbit-anti-SMAd7、Rabbit-anti-角 蛋 白 18(Cytokeratin-18,CK-18)、Mouse-anti-α-平滑肌肌动蛋白(α-sooth muscle actin,α-SMA)、Rabbit-anti-纤 连 蛋 白 (fibronectin,FN)和 Rabbit-anti-胶 原 蛋 白 Ⅰ(CollagenⅠ,Col-Ⅰ)多克隆抗体(博奥森生物技术有限公司),Mouse-anti-β-actin单克隆抗体和DAB显色剂(博士德生物技术有限公司),Rabbit-anti-Smurf2(1∶600)(Abcam 公司)、Rabbit-anti-钙黏蛋白(E-cadherin)(Santa Cruz公司);两步法免疫组化检测试剂(中杉金桥生物技术有限公司);Western印迹用PVDF膜;Goat-anti-Rabbit FITC、Goat-anti-Mouse Tex-red、4,6-二氨基-2-苯基吲哚(4,6-diamino-2-phenyl indole,DAPI);超敏 ECL化学发光试剂盒(碧云天生物研究所);其他试剂均为市售分析纯;RERCs(NRK-52E细胞)由上海复旦大学陆利民教授惠赠。
1.2 方法
实验动物及糖尿病模型的制备:清洁级雄性SD大鼠20只,体质量(180±20)g,由北京华阜康生物科技股份有限公司提供,批号:SCXK(京)2009-0004。适应性饲养1周后,乙醚麻醉后尾静脉按55 mg/kg注射0.01 mol/L无菌柠檬酸-柠檬酸钠缓冲液(pH 4.5)的链脲菌素。48 h后测空腹血糖,血糖值≥16.7 mmol/L为糖尿病组(DM)。并设同龄正常对照组(NC),每组(n=10)。各组大鼠均给予普通饲料,自由饮水。实验24周时处死动物,处死前收集24 h尿液,记录尿量。禁食6~8 h,称重,麻醉后股动脉采集血液,4℃离心,分离血清,尿液和血清于-20℃保存供检测尿蛋白及生化指标用。开腹取胰腺和肾脏,胰腺及一侧肾脏固定于4%多聚甲醛,供制作石蜡切片用,另一肾脏于-80℃保存供Western blot印迹检测。
1.3 生化指标检测和组织形态学观察
采用氧化酶法测血清葡萄糖(BG);考马斯亮蓝法测尿蛋白(UP),Bayer1650全自动生化分析仪检测。尿蛋白与尿量乘积为24 h尿蛋白量。胰腺及肾脏组织行石蜡切片,HE染色后光镜下观察胰腺形态结构的改变,HE、Masson染色观察肾组织的形态结构改变和纤维化病变。
1.4 细胞培养
将细胞分为1)正常糖对照组(NG):予以0.12‰的溶媒二甲基亚砜(DMSO)加入DMEM+2%胎牛血清培养3 h后,换DMEM+2%胎牛血清培养;2)高糖对照组(HG):予以 0.12‰ DMSO加入DMEM+2%胎牛血清培养3h后,换19.5 mmol/L D-glucose+DMEM+2%胎牛血清培养;3)高糖MG132处理组:予于终浓度分别为1μmol/L MG132,2 μmol/L MG132,5 μmol/L MG132 加入DMEM+2%胎牛血清培养3h后,换19.5 mmol/L D-glucose+DMEM+2%胎牛血清培养;每组继续培养48 h。
1.5 免疫组化染色、免疫荧光染色和Western blot检测
用免疫组化两步法检测组织切片Smad7(1∶200)、Smurf2(1∶600)、E-cadherin(1∶100)、α-SMA(1∶100)、FN(1∶50)及 Col-Ⅰ(1∶150)在各组大鼠肾组织的分布和表达。FN、Col-Ⅰ阳性表达计数方法参考本实验室以前的研究[1],计数10个高倍视野(400倍),取均值。用免疫荧光间接染色法分别检测CK-18(1∶100)、FN(1∶100)、E-cadherin(1∶200)、α-SMA(1∶100)在 NRK-52 细胞表达和分布,OLYMPUS-DP72倒置荧光显微镜观察并采集图像。
各组大鼠肾皮质及细胞加裂解液裂解,分别提取蛋白,经电泳转膜封闭后,特异性抗体孵育浓度如下:Smad7(1∶200)、Smurf2(1∶600)、E-cadherin(1∶200)、α-SMA(1∶150)、Col-Ⅰ(1∶200)和β-actin(1∶400),检测各目标蛋白的相对表达量。
1.6 统计学分析
所有数据用SPSS13.0统计软件分析处理,以均数±标准差)表示,两组间比较采用t检验,多组比较采用单因素方差分析,S-N-K法检验。
2 结果
2.1 大鼠一般情况和生化指标的变化
DM大鼠逐渐出现多饮、多尿、多食等现象,体质量显著减轻(p<0.05);而24 h尿蛋白(313.06±47.7 vs 39.22±10.31)mg及血糖(28.34±4.60)vs(7.13±1.26)mmol/L显著高于NC组(p<0.05)。
2.2 糖尿病大鼠胰腺组织和肾组织病理学改变
NC组大鼠胰岛完整,轮廓规则整齐,胰岛内细胞排列整齐,胞质饱满,细胞界限清楚,DM组胰岛内形态欠规则,细胞排列紊乱,常有细胞缺失、塌陷及炎性细胞浸润(图1A)。
NC组肾脏结构清晰完整,肾小管上皮细胞饱满,DM组大鼠部分肾小管扩张,肾脏结构排列不清,可见肾小体和肾小管的纤维化明显,肾小管上皮细胞空泡变性,细胞萎缩和脱落,小管间质细胞增多伴有炎性细胞的浸润,间质区增宽,毛细血管基底膜增厚(图1B)。
2.3 糖尿病大鼠肾组织 E-cadherin、α-SMA及FN、Col-Ⅰ分布和表达
E-cadherin在大鼠肾组织主要表达于肾小管上皮细胞,在正常大鼠的肾皮质表达较高,而DM大鼠表达减少;相反,α-SMA正常大鼠的肾皮质表达极少,而在DM组大鼠肾小管上皮细胞可见到大量阳性染色。与NC组相比,DM组大鼠肾皮质中E-cadherin蛋白的表达明显下调(p<0.05),α-SMA蛋白的表达显著增多(p<0.05)(图2)。
NC组大鼠肾组织 FN及Col-Ⅰ的阳性染色仅少量存在于细胞间质;DM组大鼠肾组织FN和Col-Ⅰ的表达明显增加(p<0.05),肾小管间质尤为明显(图3)。

图1 各组大鼠胰腺和肾组织形态学变化Fig 1 Histological change of pancreas and kidneys in each group rats(×200)
2.4 Smad7及Smurf2蛋白在各组大鼠肾组织中的表达
Smad7及Smurf2在大鼠肾组织主要分布于肾小管上皮细胞,与NC组相比,DM组大鼠肾皮质中Smad7蛋白的表达明显下调(p<0.05),而Smurf2在DM组大鼠肾组织表达显著增加(p<0.05)(图4)。
2.5 NRK-52E细胞鉴定
NRK-52E细胞高表达E-cadherin和CK-18蛋白,几乎看不到α-SMA蛋白阳性染色表达,说明培养细胞纯度良好(图5)。
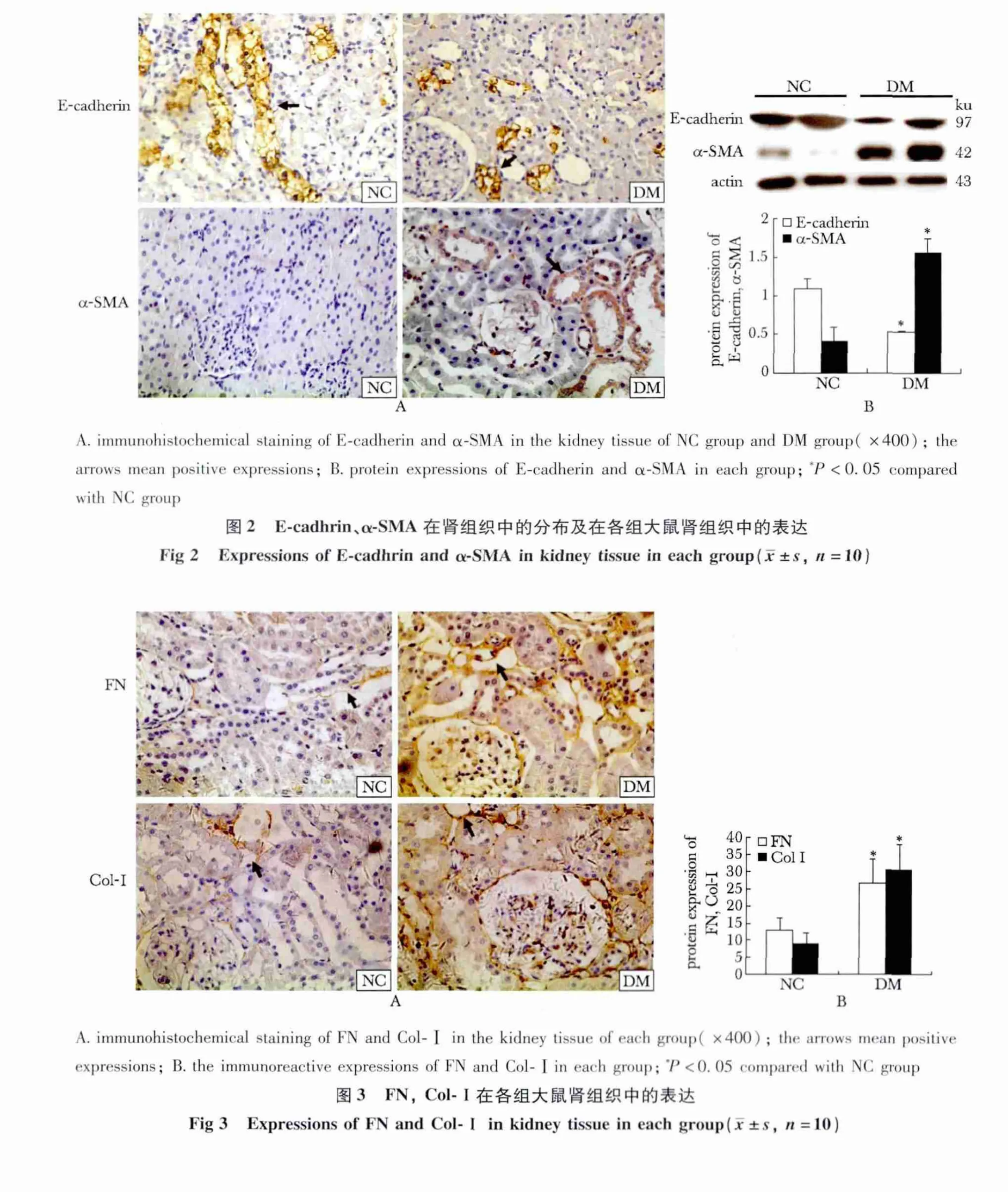
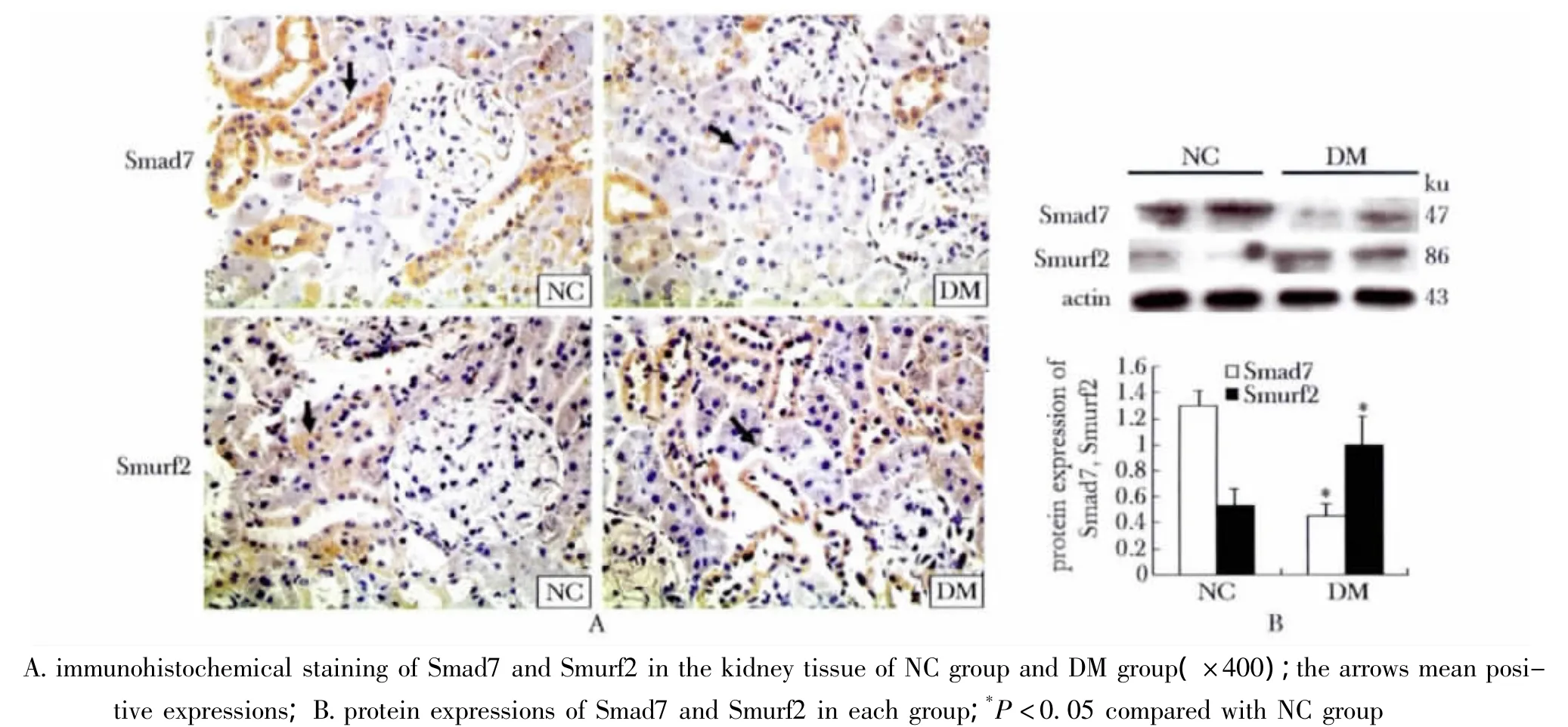
图4 Smad7及Smurf2蛋白在各组大鼠肾组织中的表达Fig 4 Expressions of Smad7 and Smurf2 in kidney tissue in each group,n=10)
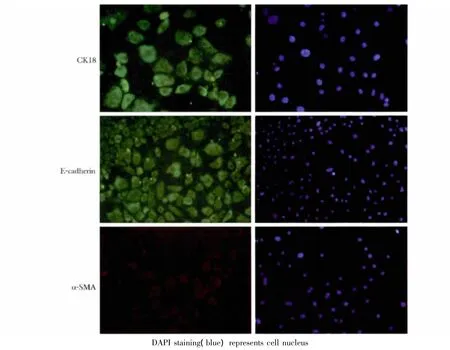
图5 E-cadherin、α-SMA及CK-18在NRK-52E细胞的表达Fig 5 Immunofluorescencel staining of E-cadherin,α-SMA and CK-18 in NRK-52E cells(×200)
2.6 不同环境下NRK-52E细胞E-cadherin、α-SMA及FN的表达
NRK-52E细胞在正常糖环境培养下,E-cadherin表达较多,而α-SMA表达极少;相反,在高糖环境培养48 h后,E-cadherin表达明显减少,而α-SMA表达增多(图6A)。高糖培养NRK-52E细胞后,FN蛋白明显增多,主要沉积于细胞间质(图6B)。
2.7 MG132对高糖培养NRK-52E细胞E-cadherin,α-SMA及Col-Ⅰ表达的影响
高糖显著上调 NRK-52E细胞中 α-SMA和Col-Ⅰ蛋白表达(p<0.05),下调 E-cadherin蛋白表达(p<0.05);随MG132浓度的增高,高糖环境下NRK-52E细胞α-SMA和Col-Ⅰ蛋白表达减少(p<0.05),而E-cadherin蛋白表达增多(p<0.05)(图7)。
2.8 MG132对 NRK-52E细胞 Smad7、Smurf2蛋白表达的影响
高糖环境下NRK-52E细胞中Smad7蛋白表达减少,而Smurf2蛋白的表达增多;MG132预处理浓度的增高,Smad7蛋白表达较单一高糖处理组逐渐增多(p<0.05),但Smurf2蛋白的表达与单一高糖处理组相比无明显差异(图8)。
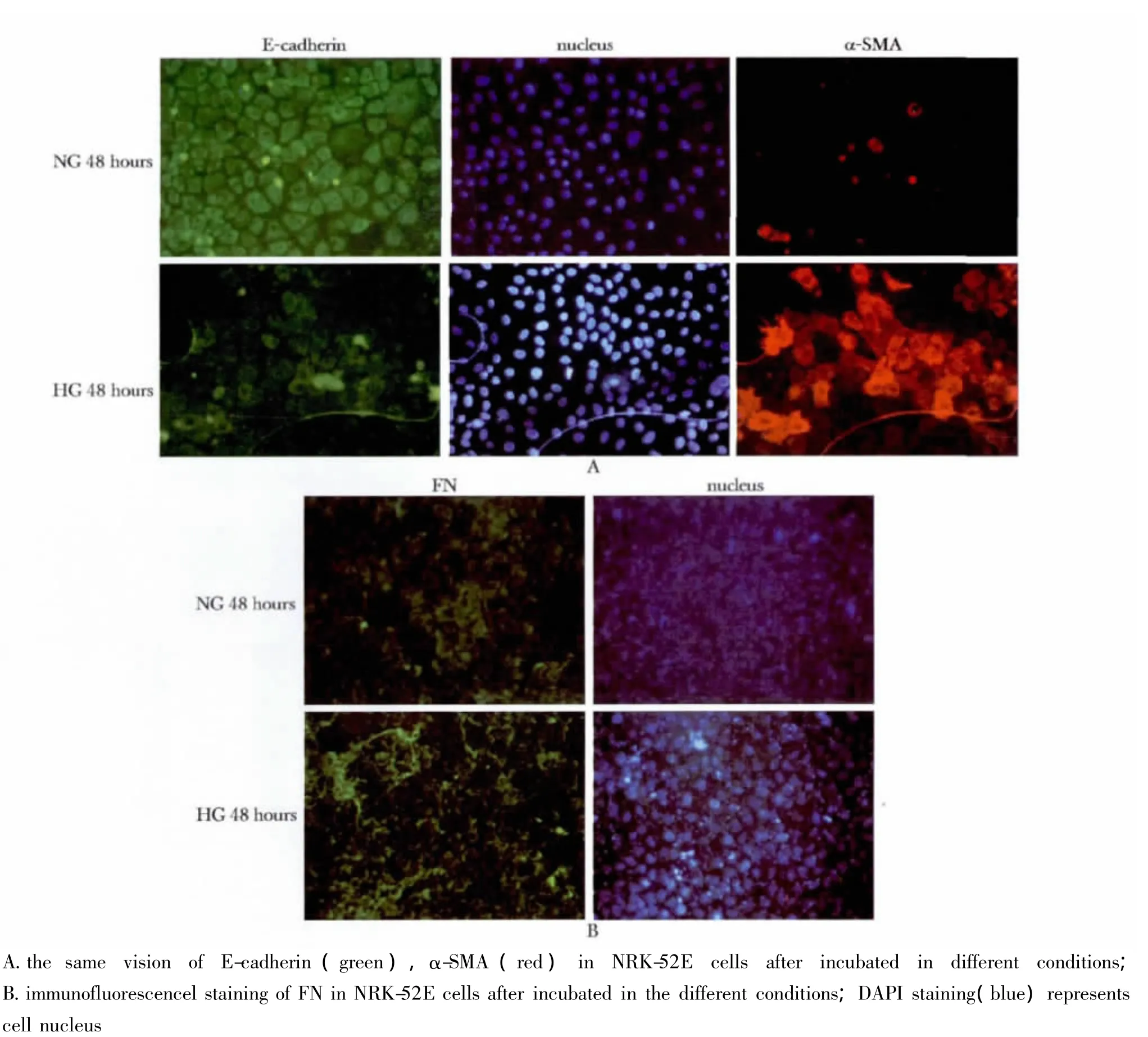
图6 不同环境下E-cadherin、α-SMA及FN在NRK-52E细胞的表达Fig 6 Immunofluorescencel staining of E-cadherin,α-SMA,FN in NRK-52E cells after incubated in the different conditions(×200)
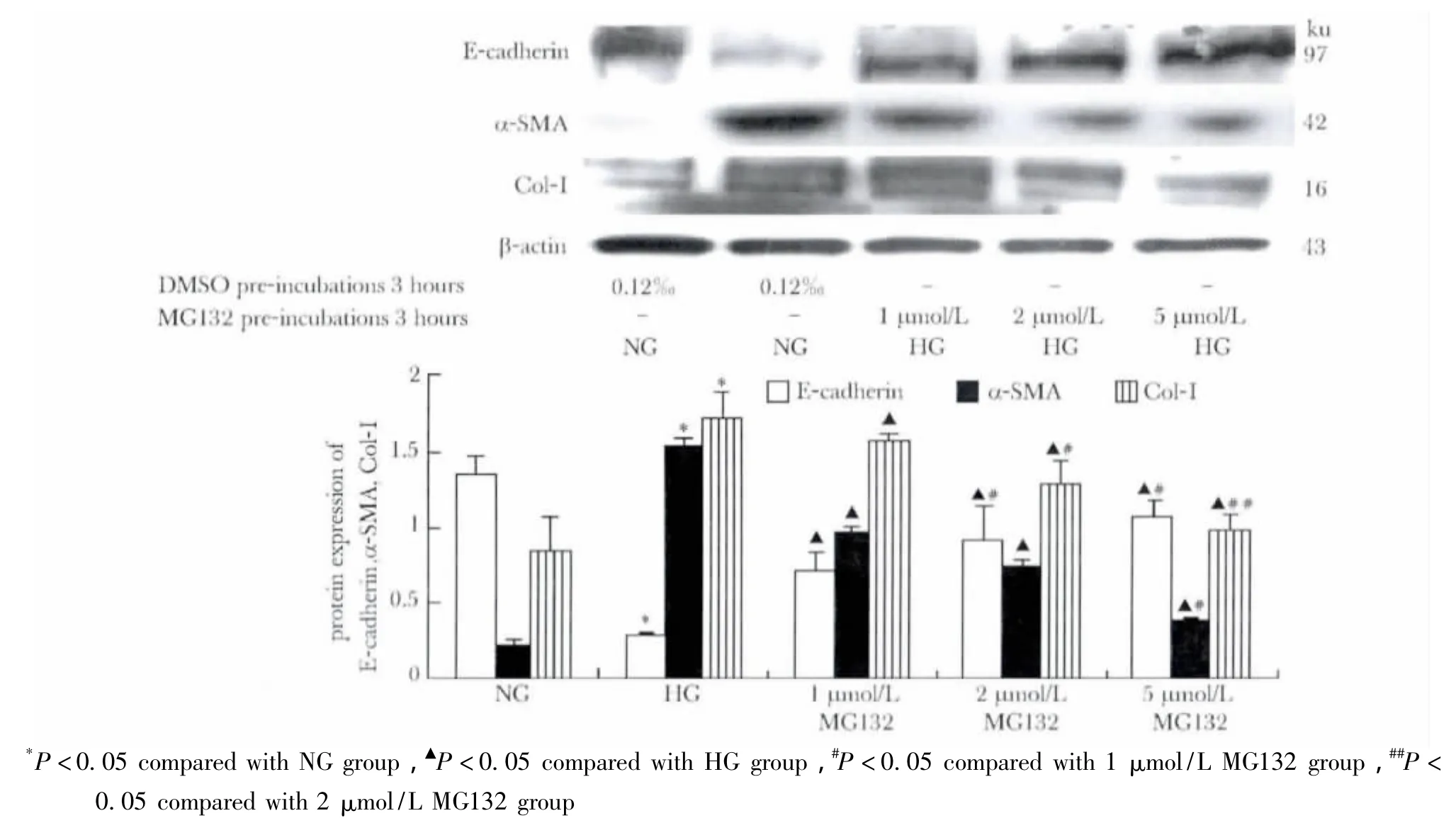
图7 MG132对高糖培养NRK-52E细胞E-cadherin,α-SMA及Col-Ⅰ表达的影响Fig 7 Effects of MG132 on the expressions of E-cadherin,α-SMA and Col-Ⅰ in NRK-52E cells after incubated in the different conditions(,n=3)
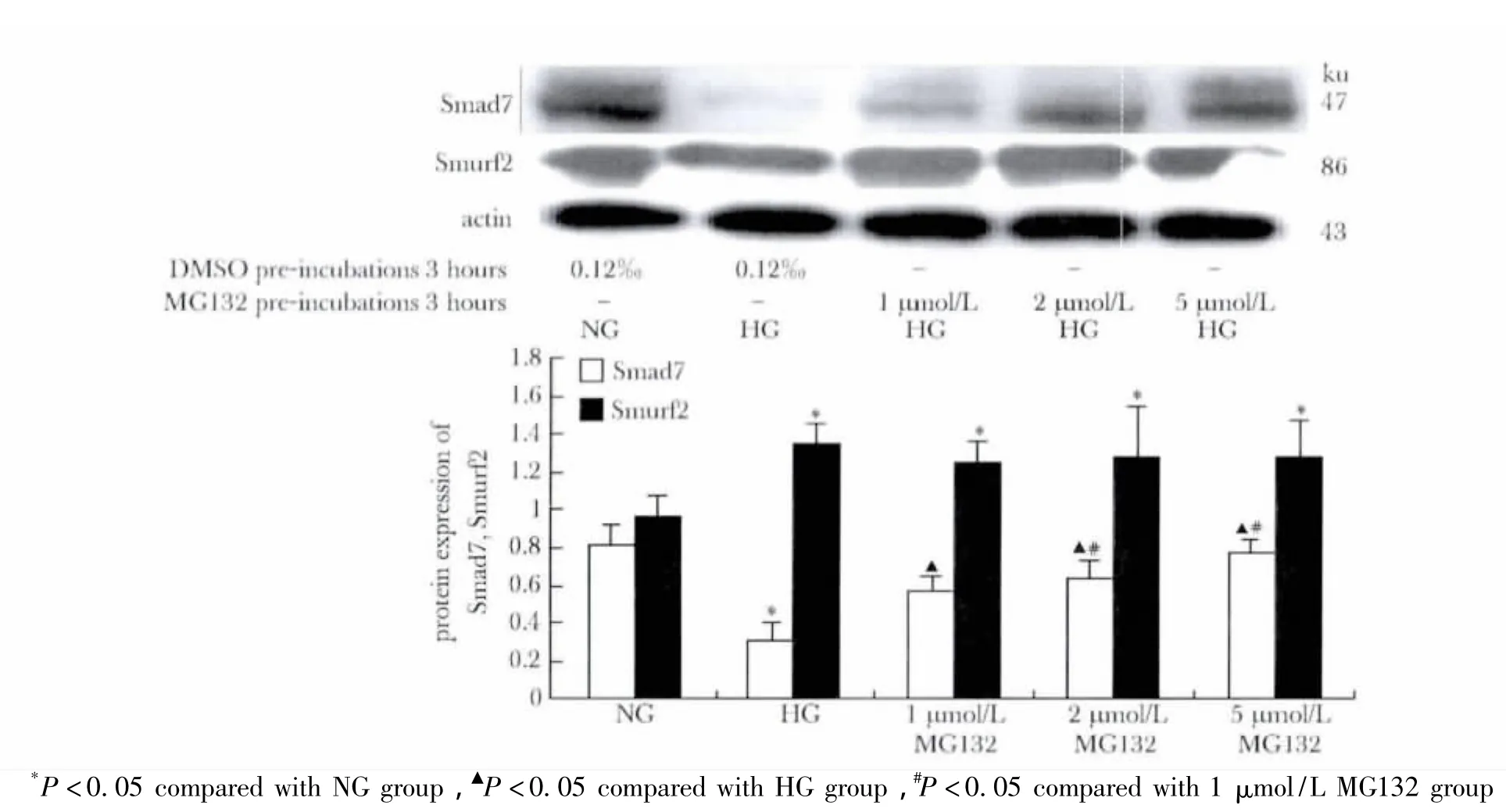
图8 MG132对NRK-52E细胞Smad7及Smurf2蛋白表达的影响Fig 8 Effects of MG132 on the protein expressions of Smad7 and Smurf2 in NRK-52E cells after incubated in the different conditions( s,n=3)
3 讨论
DM大鼠24周时,尿蛋白持续高浓度,肾组织纤维化病变严重,E-cadherin显著减少,而α-SMA高表达,提示RTECs EMT的发生,且FN及Col-Ⅰ在肾间质也显著增加,表明ECM的沉积增多。体外高糖培养NRK-52E细胞 48 h后,E-cadherin显著减少,而α-SMA高表达;FN和Col-Ⅰ表达也明显增多。故在高糖的持续刺激下,RTECs发生EMT且大量合成和分泌ECM,导致肾脏结构和功能的紊乱。
研究表明,TGF-β1/Smads通路在肾小管-间质纤维化发挥着多种致纤维化效应:参与RTECsEMT过程、促进间质 ECM 合成、介导 RTECs 的损伤[1-3,6]。而Smad7蛋白可与TβRI形成一个稳定复合物,并抑制其招募和磷酸化R-SMAd以及R-SMAd-SMAd4复合物的形成[11],从而负调控TGF-β1/Smads 通路的传导。有报道在肾纤维化病程时,活化TGF-β1/Smads通路可诱导Smad7基因的表达[7],但Smad7蛋白的表达却是减少的,这可能是由于TGF-β1介导E3泛素连接酶Smurf2特异性的识别Smad7将其泛素化后被蛋白酶体降解所致[1,7]。本研究提示:较正常对照组,在DM大鼠肾组织Smurf2高表达而Smad7蛋白表达下调,与体外高糖处理RTECs结果一致。有作者在UUO模型、5/6肾切除大鼠模型发现类似结果[2-3]。因此DN时Smurf2表达增加,促进了Smad7的泛素化途径的降解,导致TGF-β1/Smads信号通路失去控制,纤维化效应级联放大。相反,上调或过表达Smad7基因的DM大鼠可以减轻糖尿病导致的肾纤维化[1,6]。所以,恢复内源性Smad7蛋白表达成为防治DN的研究重点。
蛋白酶体抑制剂MG132能对抗糖尿病引起多种机制介导的肾损伤[9]。MG132属于醛基肽类化合物,该类化合物通过结构中的醛基和蛋白酶复合体催化中心20S的β1和β2苏氨酸残基的-OH结合,可逆性的抑制蛋白酶复合体的活性,进而抑制蛋白的降解[12]。本研究予于MG132干预NRK-52E细胞后高糖培养,致Smad7表达上调,EMT过程和ECM沉积受到抑制,而且这种效应呈现出量效依赖性,但Smurf2蛋白表达并未发生改变。提示MG132上调Smad7蛋白表达不是通过减少起识别作用的Smurf2表达,而是抑制蛋白酶体对靶蛋白的降解作用所致。从而可恢复Smad7蛋白表达,抑制EMT的发生和ECM的合成,减轻了肾小管-间质纤维化的发展,这可能是MG132治疗DN的机制之一。
[1]王圆圆,李霜,刘丽荣,等.胰岛素控制血糖对糖尿病大鼠肾组织Smad7表达及纤维化病变的影响[J].中国病理生理杂志,2013,29:43 -49.
[2]李彧,陈朝青,李亚东,等.姜黄素对单侧输尿管梗阻大鼠肾小管上皮细胞转分化及TGF-β/Smads信号通传导途径的影响[J].中国中西医结合杂志,2011,31:1224-1228.
[3]Pan MM,Zhang MH,Ni HF,et al.Inhibition of TGF-β1/Smad signal pathway is involved in the effect of Cordyceps sinensis against renal fibrosis in 5/6 nephrectomy rats[J].Food Chem Toxicol.2013 Apr 26.pii:S0278-6915(13)00280-9.doi:10.1016/j.fct.2013.04.037.[Epub ahead of print].
[4]Liu R,Wang Y,Xiao Y,et al.SnoN as a key regulator of the high glucose-induced epithelial-mesenchymal transition in cells of the proximal tubule[J].Kidney Blood Press Res,2012,35:517 -528.
[5]Hung TJ,Chen WM,Liu SF,el al.20-Hydroxyecdysone attenuates TGF-β1-induced renal cellular fibrosis in proximal tubule cells[J].JDiabetes Complications,2012,26:463 -469.
[6]Chen HY,Huang XR,Wang W,el al.The protective role of Smad7 in diabetic kidney disease:mechanism and therapeutic potential[J].Diabetes,2011,60:590 -601.
[7]Liu FY,Li XZ,Peng YM,et al.Arkadia regulates TGF-beta signaling during renal tubular epithelial to mesenchymal cell transition[J].Int,2008,73:588 -594.
[8]Cui W,Li B,Bai Y,el al.Potential role for Nrf2 activation in the therapeutic effect of MG132 on diabetic nephropathy in OVE26 diabetic mice[J].Am J Physiol Endocrinol Metab,2013,304:87 -99.
[9]Luo ZF,Qi W,Feng B,et al.Prevention of diabetic nephropathy in rats through enhanced renal antioxidative capacity by inhibition of the proteasome[J].Life Sci,2011,88:512-520.
[10]Yang YL,Liu YS,Chuang LY,et al.Bone morphogenetic protein-2 antagonizes renal interstitial fibrosis by promoting catabolism of type I transforming growth factor-beta receptors[J].Endocrinology,2009,150:727 - 740.
[11]Nakao A,Afrakhte M,Moren A,et al.Identification of Smad7,a TGFβ-inducible antagonist of TGF-β signalling[J].Nature,1997,389:631 -635.
[12]Guo N,Peng Z.MG132,a proteasome inhibitor,induces apoptosis in tumor cells[J].Asia Pac JClin Oncol,2013,9:6-11.

