RNA干扰YAP基因对人膀胱癌T24细胞株增殖和迁移能力的影响
胡光辉 徐亮 赖鹏 郭锥锋 刘欢 刘敏 王云 姚旭东 许云飞
上海市第十人民医院泌尿外科,同济大学附属第十人民医院,上海 200072
膀胱癌是泌尿系统中发病率最高的肿瘤,居于第1位。在男性所患肿瘤中居于第4位,致死性肿瘤中居于第9位,男女发病率比例为3∶1[1]。每年有超过330 000例新确诊膀胱肿瘤,超过130 000人死于膀胱癌。70%~80%的患者确诊时为非肌层浸润性膀胱癌,50%~70%会复发,10%~30%会进展为肌层浸润性膀胱 癌[2]。YAP是Hippo信号通路下游转录因 子[3],目前研究认为YAP基因可能是致癌基因,在许多肿瘤中高表达[4-5]。YAP基因在膀胱癌中高表达并且与肿瘤分期、分级及预后显著相关[6]。本实验通过siRNA特异性下调YAP基因,观察YAP基因表达下调后对膀胱癌T24细胞增殖、迁移功能的影响。
1 材料和方法
1.1 材料与试剂
人类膀胱癌T24细胞株购自中国科学院上海生命科学研究院细胞资源中心。用含 100 IU/mL青霉素、100 IU/mL链霉素(购自美国Hyclone公司)、10%胎牛血清(购自美国Hyclone公司)的RPMI-1640培养基(购自美国Hyclone公司)于CO2体积分数为5%的培养箱中培养。YAP抗体购自Cell Signaling Technology公司。YAP基因RNA干扰基因序列:靶向沉默YAP基因的RNA(siRNA)顺义链为:5’-GCAUCUUCFACAGUCUUCUTT’-3’;反义链为:5’-AGAAGACUGUCGAAGAUGCTT-3’。以siRNA NC的序列作为与人类基因组序列无任何匹配的阴性对照,siRNA NC顺义链为:5’-UUCUCCGAACGUGUCACGUTT-3’;反义链为:5’-ACGUGACACGUUCGGAGAATT-3’。
1.2 方法
1.2.1 细胞培养及T24细胞转染
人膀胱癌T24细胞培养于含10%胎牛血清的RPMI-l640培养液中,以1×105个T24细胞每孔的密度将细胞分种于6孔培养板中,并置于 37 ℃、CO2体积分数为5%及饱和湿度的温箱中培养,应用阳离子脂质载体LipofectamineTM2000将小干扰RNA(small interfering RNA,siRNA)转染入T24细胞,转染前细胞密度为70%~85%,siRNA转染终浓度为50 nmol/L,温育72 h。转染siRNA NC组作为阴性对照组,未做任何处理组细胞为空白对照组。
1.2.2 实时定量逆转录聚合酶链反应(quantitative real time-polymerase chain reaction,qRT-PCR)检测
总RNA提取试剂(TRIzol reagent)提取各实验组T24细胞的总RNA,紫外分光光度计准确定量。总RNA进行反转录获取cDNA后进行PCR反应。PCR反应条件为94 ℃变性;按下列参数循环32次:94 ℃变性20 s,57 ℃退火40 s, 72 ℃延伸40 s;最后72 ℃温育10 min。qRT-PCR引物YAP基因顺义链为:5’-ACCCACAGCTCAGCATCTTCG-3’;反义链为:5’-TGGCTTGTTCCCATCCATCAG-3’;β-actin基因顺义链为:5’-CGTCTTCCCCTCCATCGT-3’;反义链为:5’-GAAGGTGTGGTGCCAGATTT-3’。
1.2.3 蛋白质印迹法(Western blot)分析
细胞转染48~72 h后,收集细胞,利用RIPA细胞裂解液(购自北京康为世纪生物科技有限公司)提取总蛋白,二辛可酸(bicinchonininc acid,BCA)试剂盒(购自江苏碧云天生物技术有限公司)测定蛋白浓度,并调整待测样本的蛋白质含量。每孔加50 μg的蛋白样品,电泳、转膜、封闭,按1∶1 000稀释一抗温育,置4 ℃冰箱过夜。TBST中洗膜3次,每次10 min,分别按 1∶2 000稀释二抗温育l h,TBST中洗膜3次,每次10 min。曝光、显影及定影,用底片扫描仪扫描X线胶片,通过Odyssey双色红外荧光成像系统(购自美国LICOR公司)读取目的电泳条带的密度值。
1.2.4 细胞增殖活性实验
取对数生长期T24细胞,按5 000个/孔接种于96孔板,每孔100 μL,每个样品设置5个复孔,边缘加100 μL PBS,在37 ℃、CO2体积分数为5%培养箱中培养。18 h后按LipofectamineTM2000说明书转染siRNA,siRNA转染终浓度为50 nmoL/L。转染后细胞培养12、24、36、48和72 h。每个检测时间点每孔加入10 μL细胞增殖活性检测试剂盒(cell counting kit-8,CCK-8,购自上海和元生物公司)。3~4 h后酶标仪检测450 nm的吸光度(A)值。
1.2.5 划痕试验
取对数生长期T24细胞,按1×105个/孔接种于6孔板,温育24 h后分别加入浓度为50 nmol含有空白对照或siControl或siRNA YAP的培养基,继续培养24 h后细胞已铺满6孔板,利用枪头尖在细胞培养液表面划一条痕迹(长约2 cm),继续培养12和24 h后镜下观察各组T24细胞迁移变化情况。
1.2.6 Transwell迁移试验
采用Becton Dickinson公司的Transwell小室,消化6孔板中已转染的状态良好的T24细胞以1×105个/孔接种于6孔培养板内,温育16 h后分别加入浓度为50 nmol含有空白对照或NC control或siRNA的培养基24 h后消化离心,调整细胞密度为4×105/mL,取0.2 mL接种到Transwell小室,并将Transwell小室置于24孔板内,上室内为含1%灭活血清的培养基,下室为含10%灭活血清的培养基。培养20 h后用棉签头擦掉小室内细胞,予95%乙醇固定,0.1%结晶紫染色,洗净风干后于Leica荧光倒置显微镜200倍视野下拍照。33%冰醋酸洗脱结晶紫,检测A450nm值。实验重复3次。
1.3 统计学处理
2 结 果
2.1 qRT-PCR及Western blot检测siRNA干扰后YAP基因及蛋白的表达
qRT-PCR和Western blot蛋白印迹杂交分析分别检测siRNA干扰YAP基因后在基因水平和蛋白水平的表达变化。结果显示:与空白对照组、NC组相比,siRNA处理组T24细胞的YAP基因的RNA(F=93.91,P<0.000 1)、蛋白水平(F=4.62,P<0.05)的表达量均被显著抑制 (图1、2)。
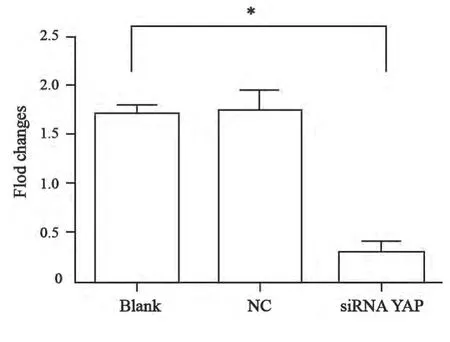
图1 qRT-PCR检测转染siRNA后T24膀胱癌中YAP mRNA表达量Fig. 1 Relative expression of YAP mRNA was detected by qRTPCR in T24 bladder cancer cells after transfected with siRNA YAP
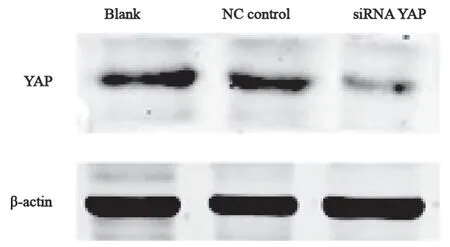
图2 Western blot检测转染siRNA后T24膀胱癌中YAP蛋白表达量Fig. 2 The expression of YAP protein was detected by Western blot in T24 bladder cancer cells after transfected with siRNA YAP
2.2 siRNA降低YAP基因表达抑制T24细胞增殖活性
CCK-8法测定空白转染组、NC control组、siRNA组细胞不同时间的A值,随着细胞生长时间的延长,空白组与NC control组细胞生长能力无明显变化。而YAP-siRNA转染组T24细胞随着时间延长(12、24、36、48和72 h)和前2组比较细胞增殖减缓,差异有统计学意义 (12 h:F=6.00,P=0.037;24 h:F=41.72,P=0.000 3;36 h:F=462.8,P<0.000 1; 48 h:F=236.6,P<0.000 1;72 h:F=140.5,P<0.000 1,图3)。因此,YAP基因调控膀胱癌细胞增殖。
2.3 siRNA降低YAP基因表达抑制T24细胞的迁移能力
Transwell迁移试验显示,在每高倍镜视野下,NC Control组和空白对照组的细胞数目显著高于siRNA YAP组(F=20.7,P<0.05,图4、5)。划痕试验显示,随时间的推移,空白对照组和NC control组细胞的愈合速度最快,而siRNA+YAP组的愈合速度最慢(F=43.55, P<0.05)。因此,YAP可以显著增强膀胱癌T24细胞的迁移能力,而siRNA沉默YAP基因表达后可以有效地抑制YAP引起的T24细胞迁移能力的变化(图6、7)。
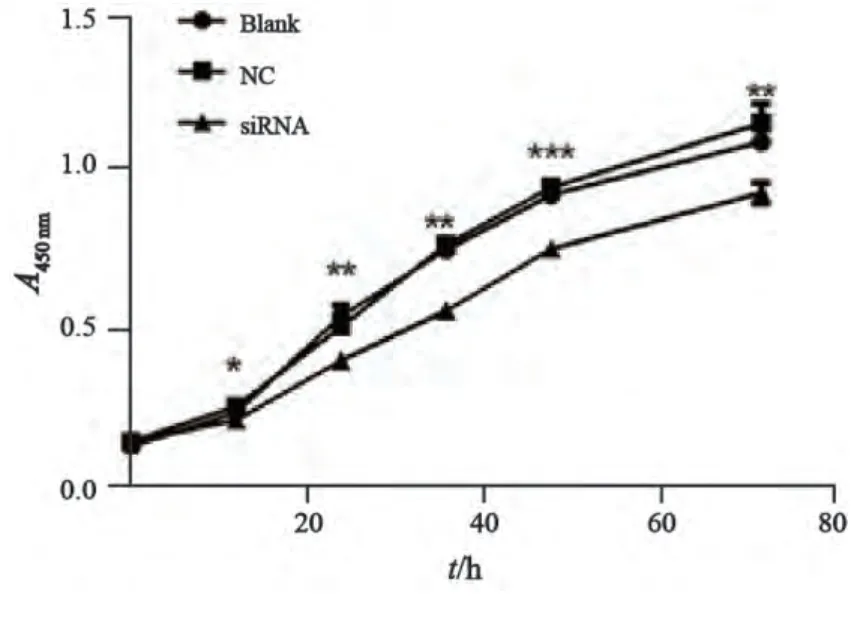
图3 CCK-8检测转染siRNA后T24膀胱癌细胞增殖活性Fig. 3 Cell proliferation was detected by CCK-8 assay in T24 bladder cancer cells after transfected with siRNA YAP
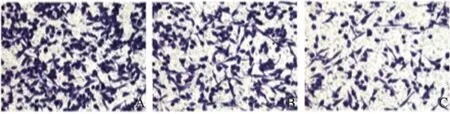
图4 Transwell迁移实验检测转染siRNA后T24膀胱癌细胞迁移能力Fig. 4 Cell migration was detected in T24 bladder cancer cells after transfected with siRNA YAP(×200)
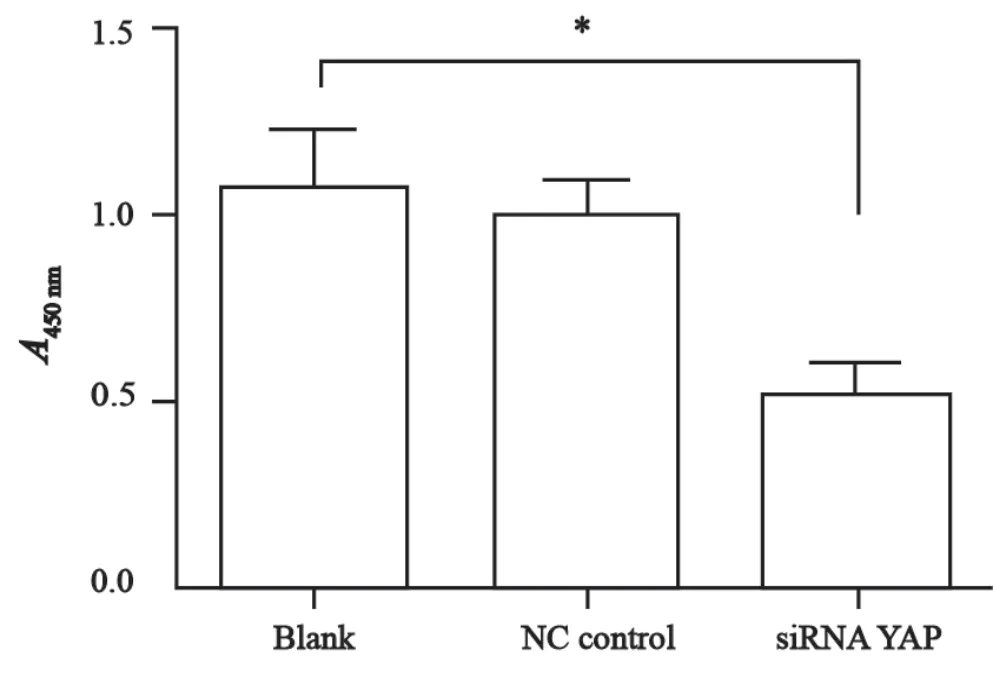
图5 Tranwell 迁移实验A值检测分析Fig. 5 Analysis of cell migration
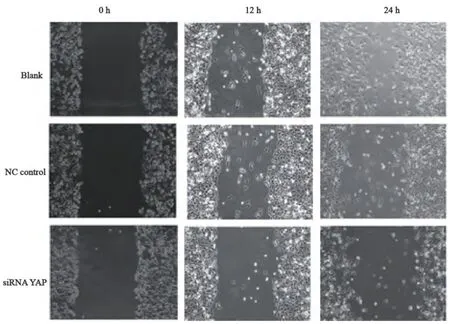
图6 划痕试验检测转染siRNA后T24膀胱癌的迁移能力Fig. 6 Wound healing was detected in T24 bladder cancer cells after transfected with siRNA YAP(×100)
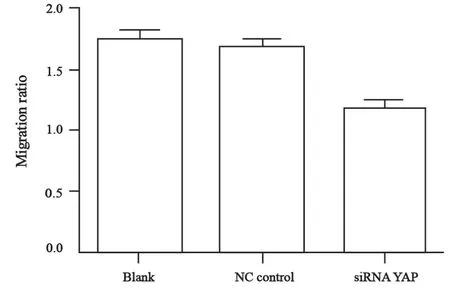
图7 划痕试验统计分析(0 h vs 24 h)Fig. 7 Analysis of wound healing (o h vs 24 h)
3 讨 论
膀胱尿路上皮癌是泌尿系统最常见的肿瘤,并且术后极易复发,30%的患者确诊时已发生远处转移。膀胱尿路上皮癌复发的主要危险因素为肿瘤大小、多灶性、病理分期等[2]。而充分认识膀胱癌的生物学行为的分子机制具有重要作用。Hippo信号通路是近年来发现的重要的信号通路,主要通过细胞增殖和凋亡进行调控器官发育[4],Hippo信号通路与肿瘤的发生、发展密切相关[7-8]。YAP蛋白是Hippo信号通路下游重要的转录因子,通过磷酸化修饰发挥作用。YAP基因在许多肿瘤中过表达,如肝癌、结肠癌、肺癌等[9-11]。YAP基因在膀胱尿路上皮癌中表达上调,并且与膀胱癌患者T分期、淋巴转移以及预后密切相关。YAP蛋白免疫组化评分高的膀胱尿路上皮癌患者往往预后差、生存期短[6]。
YAP基因在泌尿系统肿瘤如膀胱癌、前列腺癌中均表达上调[12-13],本实验首次通过siRNA在人膀胱癌T24细胞中下调YAP基因表达,RT-PCR以及Western blot分析结果显示,YAP基因在基因以及蛋白水平的表达均被抑制。通过RNA干扰技术,成功下调YAP基因表达后,发现膀胱癌T24细胞的增殖活性以及迁移能力被显著抑制。因此,YAP蛋白与膀胱癌的增殖、迁移、侵袭以及转移相关。在裸鼠体内移植瘤模型中,过表达YAP能显著促进肿瘤的生长[9]。过表达YAP基因能促进宫颈癌细胞上皮间质转化(epithelial–mesenchymal transition,EMT)[14],EMT与肿瘤侵袭和转移密切相关,而在膀胱尿路上皮癌中,EMT信号通路处于活化状态[15],并且活化程度在高级别和低级别膀胱癌中差异有统计学意义[16]。在肝癌细胞中,YAP上调Notch信号通路配体Jagged-1(Jag-1)激活Notch信号通路,调控肝癌细胞增殖、迁移以及侵袭[9]。YAP在膀胱癌中可能通过活化EMT以及激活Nocth信号通路或者其他通路促进膀胱癌复发、侵袭及转移。
易复发、转移是膀胱肿瘤的特点。肿瘤的增殖和转移是一系列多因素、多信号通路相互作用的结果。与siRNA干扰YAP在其他肿瘤细胞中观察到能明显抑制肿瘤的增殖、迁移和侵袭。YAP与Akt/PIK-TOR、Wnt、Notch通路等通路串话[9,14],调控肿瘤细胞增殖、侵袭。YAP基因与膀胱尿路上皮癌分期、分级以及预后显著相关,并且调控膀胱尿路上皮癌细胞增殖、迁移。因此,关于YAP基因以及靶向YAP基因治疗膀胱肿瘤值得进一步研究。
[1]JEMAL A, BRAY F, CENTER M M, et al. Global cancer statistics [J]. CA Cancer J Clin, 2011, 61(2): 69-90.
[2]BURGER M, CATTO J W, DALBAGNI G, et al. Epidemiology and risk factors of urothelial bladder cancer [J]. Euro Urol, 2013, 63(2): 234-241.
[3]ZHAO B, LI L, LEI Q, et al. The hippo-yap pathway in organ size control and tumorigenesis: An updated version [J]. Genes Dev, 2010, 24(9): 862-874.
[4]PAN D. The hippo signaling pathway in development and cancer [J]. Dev Cell, 2010, 19(4): 491-505.
[5]MATSUURA K, NAKADA C, MASHIO M, et al. Downregulation of sav1 plays a role in pathogenesis of highgrade clear cell renal cell carcinoma [J]. BMC cancer, 2011, 11: 523.
[6]LIU J Y, LI Y H, LIN H X, et al. Overexpression of yap 1 contributes to progressive features and poor prognosis of human urothelial carcinoma of the bladder [J]. BMC cancer, 2013, 13: 349.
[7]SANCHEZ I M, APLIN A E. Hippo: Hungry, hungry for melanoma invasion [J]. J of Invest Dermatol, 2014, 134(1): 14-16.
[8]HALDER G, CAMARGO F D. The hippo tumor suppressor network: From organ size control to stem cells and cancer [J]. Cancer Res, 2013, 73(21): 6389-6392.
[9]TSCHAHARGANEH D F, CHEN X, LATZKO P, et al. Yesassociated protein up-regulates jagged-1 and activates the notch pathway in human hepatocellular carcinoma [J]. Gastroenterology, 2013, 144(7): 1530-1542.
[10]YI C L, SHEN Z W, STEMMER-RACHAMINOV A, et al. The p130 isoform of angiomotin is required for yap-mediated hepatic epithelial cell proliferation and tumorigenesis [J]. Sci Signal, 2013, 6: 291.
[11]LAU A N, CURTIS S J, FILLMORE C M, et al. Tumorpropagating cells and yap/taz activity contribute to lung tumor progression and metastasis [J]. EMBO J, 2014, 33(5): 468-481.
[12]李宁, 肖虹, 郑绘霞, 等. Yap蛋白在膀胱尿路上皮肿瘤中的表达及临床意义 [J]. 山西医科大学学报, 2011, 42(5): 383-386.
[13]安蓉, 王丽娟, 吏圣甲, 等. Yap蛋白在前列腺癌中的表达及其意义 [J]. 现代检验医学杂志, 2013, 28(2): 70-73.
[14]XIA Y, CHANG T, WANG Y, et al. Yap promotes ovarian cancer cell tumorigenesis and is indicative of a poor prognosis for ovarian cancer patients [J]. PloS One, 2014, 9(3): e91770.
[15]WU K, NING Z, ZENG J, et al. Silibinin inhibits beta-catenin/zeb1 signaling and suppresses bladder cancer metastasis Ⅵa dual-blocking epithelial-mesenchymal transition and stemness [J]. Cell Signal, 2013, 25(12): 2625-2633.
[16]JEPPESEN D K, NAWROCKI A, JENSEN S G, et al. Quantitative proteomics of fractionated membrane and lumen exosome proteins from isogenic metastatic and nonmetastatic bladder cancer cells reveal differential expression of emt factors [J]. Proteomics, 2014, 14(6): 699-712.

