穿心莲内酯及其衍生物药理活性研究
马长沙,段成军,马静洁
(延边大学,吉林延吉133000)
穿心莲内酯(andrographolide,AHL)为爵床科植物穿心莲干燥地上部分[Andrographis paniculata(Burm.f)Nees]中提取得到的二萜内酯类化合物,是中药穿心莲的主要有效成分之一。穿心莲内酯具有广泛的药理活性,具有抗菌、抗病毒、抗肿瘤、治疗心脑血管疾病等多种药理作用。但其水溶性较差,影响其制剂的发展。对其进行结构改造,增强其活性及水中溶解性,利用Michael加成、羟基上的反应、分子内环化、分子内酯环化等反应进行结构修饰得到了穿心莲内酯衍生物。笔者对穿心莲内酯及其衍生物的研究进展进行概述,为穿心莲内酯今后的研究及临床应用提供依据。
1 理化性质
穿心莲内酯(C20H30O5)为萜内酯类化合物,结构式见图1。化学名:(3E,4S)-3-[2-[(1R,4aS,5R,6R,8aS)-decahydro-6-hydroxy-5-(hydroxymethyl)-5,8a-dimethyl-2-methylene-1-naphthalenyl]ethylidene dihydro-4-hydroxy-2(3H)-furanone。白色方棱形或片状结晶(乙醇或甲醇),无臭,味苦。穿心莲内酯在水相中的溶解度非常低,在油相中的溶解度较高,属于脂溶性很强的药物,但水中溶解度随着外界温度的升高而增大[1]。在沸乙醇中溶解,在甲醇或乙醇中略溶,极微溶于氯仿,在水或乙醚中几乎不溶。熔点230~231 ℃,(α)17D-126.6 ±2°(C=1.5,冰醋酸),[α]D-112.7(C=0.53,MeOH)。
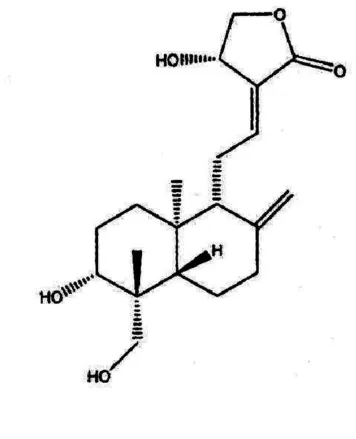
图1 结构式
2 提取分离
从穿心莲茎叶中提取穿心莲内酯的方法很多,主要有水提法、醇提法、碱水法和酸水法,这些方法同时辅以超声波,可显著缩短浸提时间,明显加快溶出效率,提高内酯的浸出率,保证其稳定性。赵玉江等[2]以穿心莲内酯为考察指标,以HPLC法测定水提法、醇提法和碱水法对穿心莲内酯浓度及出膏率的影响,结果穿心莲内酯浓度以醇提法及0.01%碱水提取为佳,浓度分别为4.43%和4.31%,但出膏率 0.01%碱水较高,达24.08%。周一君[3]采用乙醇等溶剂冷浸、热浸或渗漉等方法提取穿心莲茎叶中的穿心莲内酯,回收乙醇,经过一系列处理得到穿心莲总内酯,将其以三氯甲烷或二氯甲烷冷溶2~4次,过滤,得到滤液与不溶物,滤液可分离得到脱水穿心莲内酯与去氧穿心莲内酯纯品。不溶物经溶剂分离可得到新穿心莲内酯及和穿心莲内酯纯品。
吴俊伟等[4]根据穿心莲内酯可以同亚硫酸氢钠起加成反应的原理,设计了酸水法提取穿心莲内酯的方法,并与乙醇回流法、碱水法、乙醇冷浸法、冷水浸渍法等方法比较,结果显示此方法与乙醇回流法对穿心莲内酯的提取效果相同,且好于其他方法。马芝玉等[5]用正交法对微波和超声波辅助提取穿心莲内酯的工艺条件进行对比,筛选出微波和超声波辅助提取法的最佳工艺,并对2种提取方法进行了比较。结果表明:与超声波提取法相比,微波提取法提取时间较短,提取率较高。彭梦微等[6]对减压沸腾法提取穿心莲内酯的工艺进行研究,得出结论,此方法由于在较低温度下快速操作完成,抑制了杂质的溶出,且收率较高。并得出了减压沸腾法提取穿心莲的最佳工艺:提取剂浓度32%,提取温度59℃。此条件下穿心莲的最大收率为0.662%。
3 穿心莲内酯及其衍生物的药理作用
穿心莲内酯及其衍生物除了具有清热解毒,凉血消肿的功效外,还具有抗菌、抗炎、治疗心脑血管疾病、免疫增强、抗肿瘤等多种药理作用。
3.1 抗菌作用 Wang Zhongli[7]通过用不同的取代侧链取代穿心莲内酯的C-14位羟基,发生缩合反应合成穿心莲内酯的一系列衍生物。合成的一系列新穿心莲内酯衍生物都是信号分子AHLs(acyl homoserine lactones)类似物,并且有较强的抗菌活性。细菌通过不同信号分子相互通信,每种细菌产生少量的一种或多种信号分子,并释放到内坏境中,当达到一定的临界值时,就会促进细菌群体效应基因的转录,这种依靠细胞之间的信号传递发生的群体现象叫做群体效应(QS)。QS控制次生代谢产物,生物发光,蛋白的分泌,毒力因子的产生,质粒转移和细菌生物膜的形成。在实验中以革兰氏阴性菌铜绿假单胞菌(绿脓杆菌)为例来研究细菌QS和细菌生物膜的形成。实验证明,其中的一些化合物,如R-(a)-lipoic acid和穿心莲内酯的结合物,显著影响铜绿假单胞菌的QS系统并抑制生物膜的形成。实验得出新化合物的活性比较结果。新化合物的SAR分析发现:1)在天然穿心莲内酯C-14位引入脂族侧链(直链或环状的),可增加其抑制毒力因子产生的活性;2)有些化合物显著抑制蛋白酶的产生,但是抑制绿脓素产生方面作用较差,表明该化合物通过不同的途径抑制这两个毒力因子的产生;3)有些化合物同时有效抑制绿脓素和蛋白酶的产生,这些结果之间的差异有待进一步研究;4)结果表明,无论化合物是否含有二硫键,同样可以有效的抑制绿脓菌素和蛋白酶产生,表明二硫键在发挥抗菌活性方面的作用并不显著。而且有些化合物除了具有抗菌和抗病毒活性外,在体外和实验动物模型中还表现出显著的抗糖尿病活性。这些结果表明,二硫键在抗糖尿病方面起着至关重要的作用。并且AL-1的抗菌和抗糖尿病的机制是不同的。Uthaiwan Sirion[8]发现在穿心莲内酯C-19位置上用乙酰基,甲硅烷基和三苯基甲基醚基团修饰,可得到抗菌活性较高的穿心莲内酯衍生物,并比较了其抗菌活性。
3.2 解热抗炎作用 穿心莲内酯对肺炎双球菌和溶血性乙型链球菌引起的体温升高和伤寒、副伤寒菌苗所致的发热有一定的解热作用,对同时感染肺炎双球菌和溶血性链球菌培养物的家兔有延缓体温上升时间的作用,并且减缓了体温上升的程度。对于2,4-二硝基酚或内毒素诱导的发热和蛋清诱导的水肿或巴豆油诱导的炎症模型,穿心莲内酯、新穿心莲内酯(NA)、脱氧穿心莲内酯(DA)和脱氧二脱氢穿心莲内酯(DDA)的退热、抗炎活性强度依次为DDA、DA、NA和穿心莲内酯。对于干酵母所致的大鼠发热及内毒素所致的家兔发热,脱氧穿心莲内酯磷酰化钠(DAP Na)(300,150 mg/kg)有良好的解热作用;400,200,100 mg/kg DAPNa对蛋清所致的大鼠足肿胀及二甲苯所致的小鼠耳肿胀均有良好抗炎作用[9]。史传英等[10]研究表明亚硫酸钠穿心莲内酯具有解热镇痛抗炎作用,实验表明亚硫酸钠穿心莲内酯对大肠杆菌诱发的家兔发热有显著降温作用。在镇痛作用方面,亚硫酸钠穿心莲内酯可显著延长小鼠的舔足反应潜伏期,可减少冰醋酸引起的小鼠扭体反应。抗炎作用方面亚硫酸钠穿心莲内酯可明显抑制二甲苯诱导的小鼠耳肿胀。O’Shea JJ[11]研究表明,炎症的发生与巨噬细胞和T淋巴细胞的激活、TNF-α,白介素1(IL-1),白介素6(IL-6),干扰素-γ(IFN-γ),NO 和细胞黏附分子等炎性介质的释放有关。研究表明,穿心莲内酯能影响一氧化氮合成酶的表达,抑从而制NO的产生,抑制巨噬细胞的迁移和TNF-α,白介素12(IL-12)的产生[12-14]。炎症反应时,黏附分子表达上调及内皮-白细胞黏附增加。体外实验表明,脱水穿心莲内酯琥珀酸单钾盐可直接破坏内毒素结构,并抑制大量炎性因子如肿瘤坏死因子-A(TNFA)、白介素-1和-6(IL-1,IL-6)的活性,从而拮抗内毒素的作用[15]。Tsai等[16]阐述了穿心莲内酯作用于体外补体5α(C5α)诱导的巨噬细胞补充的抗炎机制,得出穿心莲内酯抗炎作用的机理可能是通过掺入ERK 1/2和PI3K/Akt信号通路的细胞分裂抑制作用的结论。
过去的研究表明,穿心莲乙酸乙酯部分(AP)具有抗炎活性。CHAO Wenwan等[17]通过生物色谱法进一步分离这些活性化合物,并确定了8个纯化合物。实验表明5-羟基-7,8-二甲氧基黄酮,5-羟基-7,8-二甲氧基二氢黄酮,混合的β-谷甾醇和豆甾醇,麦角甾醇过氧化物,14-去氧-14,15-脱氢穿心莲内酯,和一种新的化合物19-O-乙酰基-14-脱氧-11,12-二脱氢穿心莲内酯,都显著抑制LPS/IFN-γ中的转录因子NF-κ B的活性,NF-κ B可激活RAW 264.7巨噬细胞(P<0.05)。2个最丰富的化合物,14-去氧-11,12-二脱氢穿心莲内酯和穿心莲内酯抑制活性较小,但经过还原,氧化,或乙酰化后会得到抑制活性增加的4种衍生的化合物。所得的化合物能够显著降低TNF-R,IL-6,巨噬细胞炎性蛋白-2(MIP-2),和LPS/IFN-γ诱导的 RAW 264.7细胞产生一氧化氮(NO)分泌物,并且比较了化合物对 RAW 264.7细胞的NF-κ B的抑制作用强弱。
3.3 心血管系统 Chen等[18]调查了穿心莲内酯保护人脐静脉内皮细胞(HUVESVCs)免受生长因子(GF)缺乏诱导的凋亡的分子机理和信号通路。研究表明穿心莲内酯在HUVESVCs中通过激活Akt-BAD通路发挥其抗凋亡作用。Burgos等[19]发现14-脱氧穿心莲内酯有Ca2+离子通道阻断活性。研究还发现DA还是一种牛嗜中性粒细胞PAF介导过程的有效拮抗剂。以上研究表明穿心莲及其衍生物具有抗动脉粥样硬化的作用。穿心莲及其衍生物还具有降压作用。Zhang等研究认为降低血压的机制是DA和DDA能刺激血管内皮细胞增加NO的释放量,从而激活可溶性鸟苷酸环化酶而起到扩张血管的作用[20]。
3.4 免疫调节 穿心莲内酯,是一种非特异性免疫刺激剂,能够促进免疫活性细胞增殖,增强巨噬细胞的吞噬作用和游走指数,并通过影响NK、巨噬细胞及细胞因子分泌发挥免疫调节作用[21]。据Anju Puri等[22]报道,通过对比穿心莲内酯乙醇提取物和穿心莲内酯刺激抗原的特异性和非特异性免疫反应,得出穿心莲乙醇提取物中存在其他的免疫物的结论。
Wang Bin[23]合成了一系列的穿心莲内酯衍生物,并且评估潜在的体外抗-HIV活性。与穿心莲内酯相比,一些衍生物具有更好的抗HIV-1活性。在C-3和C-19羟基引入二芳基的衍生物比在C-3或C-9引入烷基的衍生物表现出更高的TI值,而在C-3和C-19引入过大的芳基会影响抑制活性的CPE和TI。在CFDA和美国FDA的相关法规指导下,TI被认为是体外抗HIV活性评价的关键指标,TI在10以上的化合物在体外具有抗-HIV作用。
3.5 抗肿瘤作用 近年来,研究发现穿心莲中重要的二萜内酯类化合物穿心莲内酯在许多体内外模型上表现出中等强度的抗肿瘤作用[24-26],如可抑制人急性早幼粒白血病细胞(HL-60)增殖,阻滞细胞周期于G0/G1期,并诱导细胞凋亡[27]。DA和DDA是穿心莲中2种重要的二萜内酯类有效成分,DA在Ec9706和A549上表现出的增殖抑制活性均显著强于DDA,与文献报道在其他细胞株上的结果一致[28]。有研究表明[29]在穿心莲内酯C-3,19引入缩醛(酮)基可显著提高其体外抗肿瘤活性。其中引入卤代苯基的衍生物活性提高幅度最大,DA的C-14羟基单独乙酰化与C-14,19羟基同时乙酰化产物的活性相当,且都强于DA;DA的C-3,C-14,C-19 3个羟基同时乙酰化可大幅提高其对Ec9706的增殖抑制活性。DA的C-8,17双键环氧化后活性提高,与Nanduri等[30]在卵巢癌SKOV3上的结果一致。在DDA的C-15取代衍生物中,当为脂肪族衍生物时,刚性越强越不利于活性发挥;当为芳香族衍生物时,共轭体系和刚性的引入也不利于活性的发挥,而当取代基为4-氟代苯基时,可能苯基上强电负性元素可以缓解C-15取代后导致的活性下降,另外苯环上含有羟基也可部分提高活性。
Uthaiwan Sirion[8]的研究发现新的C-19取代穿心莲内酯类似物具有很强的细胞毒性。穿心莲内酯是穿心莲的主要二萜类内酯,对癌细胞有毒。他们研究了通过改变3个羟基组得到的一系列衍生物的构效关系。穿心莲内酯类似物比母体化合物对癌细胞的的细胞毒活性高得多,包括对P-388,KB,COL-2,MCF-7,LU-1和ASK癌细胞对的细胞毒性。通过对穿心莲内酯合成类似物的研究表明,在母体化合物的C-19引入甲硅烷基醚或三苯基甲基醚可增加对癌细胞的毒性。19-O-三苯甲基醚衍生物比有效的抗癌药物玫瑰树碱细胞毒活性高,因此,此类似物可以作为一个新的抗癌药物的潜在发展结构。过去的研究也证明含有三笨甲基的化合物具有抗癌活性。研究得知无论在C-3还是C-14位引入乙酰基,其活性均可增加,但是引入乙酰基的位置对其活性无影响。但是在C-3和C-14位都引入乙酰基会降低其活性。
Bimolendu Das[31]通过C-14位羟基的化学选择性功能制备出一系列的穿心莲内酯类似物,在体外实验中表现出对人白血病细胞系的细胞毒性。实验表明穿心莲内酯衍生物都表现出很强的药效,构效关系的初步研究发现穿心莲内酯α-次甲基-γ-丁内酯在活性谱中发挥了重要作用。并通过光谱和资料分析,建立了类似物的结构。穿心莲内酯1包含(a)两个双键的(△12及△8(17)),(b)α-次甲基-γ-丁内酯,及(c)C3,C-14,和C19位的3个羟基。由于C-14位的羟基具有选择性功能,因此选择了C-14位。实验证明穿心莲内酯转变为适当的衍生物酯(C-14)能够增加其溶解度以及活性,酯酶切割酯键后能够在体内生理条件下释放穿心莲内酯,该酯类似物可作为一种前药。基于这个目的合成了在C-14位修饰的穿心莲内酯酯类衍生物。衍生物构效关系(SAR)的研究表明,主要发挥作用的是α-次甲基-γ-丁内酯基团。
4 结论
近年来随着对穿心莲内酯及其衍生物药理活性研究的不断深入,进一步证明穿心莲内酯及其衍生物具有广泛的药理活性,并展示出了广阔的深入开发的应用前景。但穿心莲内酯生物利用度低,和大部分中药有效成分一样,具有多种药理作用,但活性都不明显。因此开发新剂型并用化学方法制备穿心莲内酯衍生物是解决生物利用度低、增强临床疗效的重要途径。许多穿心莲内酯衍生物被发现有较好的抗肿瘤、抗炎等生物活性,对进一步以穿心莲内酯为先导的新药研发具有一定的指导意义。
[1]陈伶俐.穿心莲内酯基本理化性质考察[J].今日药学,2010,20(1):41-43.
[2]赵玉江,李勇,吴修红,等.不同提取方法对穿心莲内酯含量的影响[J].黑龙江医药,2006,19(3):181-182.
[3]周一君,杨增,石荣火,等.穿心莲总内酯与新穿心莲内酯、脱水穿心莲内酯、去氧穿心莲内酯的生产工艺[P].中国专利:101559088,2009-10-21.
[4]吴俊伟,古树英,曾忠良.酸水法提取穿心莲总内酯[J].四川畜牧兽医学报,1999,13(3):7-11.
[5]马芝玉,林翠梧,廖森,等.微波和超声波辅助提取穿心莲内酯[J].精细化工,2007,24(80):758-760.
[6]彭梦微,韦藤幼,陈晓光,等.减压内部沸腾法提取穿心莲内酯的工艺研究[J].时珍国医国药,2011,2(9):2244-2246.
[7]Wang Zhongli,Yu Pei.Design,synthesis and antibacterial activity of novel andrographolide derivatives[J].Bioorganic&Medicinal Chemistry,2010,18(12):4269-4274.
[8]Uthaiwan Sirion,Sakkasem Kasemsook.New substituted C-19-andrographolide analogues with potentcytotoxic activities[J].Bioorganic&Medicinal Chemistry Letters,2012,22(1):49-52.
[9]韩光,谢松强,张忠泉,等.穿心莲内酯衍生物DAP Na的药效学研究[J].中国现代应用药学杂志,2005,22(2):126-129.
[10]史传英,董六一.亚硫酸氢钠穿心莲内酯的抗炎解热镇痛作用研究[J].中国民族民间医药,2009,12(3):5-6.
[11]O’Shea JJ,Murray PJ.Cytokine signaling modules in inflammatory responses[J].Immunit,2008,28(4):477.
[12]Sheeja K,Shihab PK,Kuttan G.Antioxidant and anti-inflammatoryactivities of the plant Andrographis panic[J].Immunopharmacol Immunotoxicol,2006,28(1):129.
[13]Xia Y F,Ye B Q,Li Y D,et al.Andrographolide attenuates imflammation of NF-kappa B activation through covalent modification of reduced cysteine 62 of p50[J].J Immunol,2004,173(6):4207-4217.
[14]Qin L H,Kong L,Shi G J,et al.Andrographolide inhibits the production of TNF-αand IL-12 in LPS stimulated macrophages:role of mitogen activated protein kinases[J].Biol Pharm Bull,2006,29(2):220.
[15]张 霞,吴迪,王家泰,等.穿心莲破坏内毒素作用的体外实验研究[J].中国中西医结合急救杂志,2000,7(4):212-214.
[16]Tsai H R,Yang L M,Tsai W J,et al.Andrographolide acts through inhibition of ERK 1/2 and Akt phosphorylation to suppress chemotactic migration[J].European J Pharmacol,2004,498(1-3):45-52.
[17]Chao Wenwan,Kuo yieh-hsiung.Anti-inflammatory Activity of New Compounds fromAndrographis paniculata by NF-KB Transactivation Inhibition[J].Journal of Agricultural and Food Chemistry,2010,58(4):2505-2512.
[18]ChenJ H,Hsiao G,Lee A R,et al.Andrographolide Suppress esendothelial cell apoptosis via activation of Phosphatidyl inositol-3kinase/Akt pathway[J].Biochem Pharmacol,2004,67(7):1337-1345.
[19]BurgosR A,Hidalgo M A,Monsalve J.etal.14-deoxyandrographolide as a platelet activating factor antagonist in bovineneutrophilis[J].Planta Med,2005,71(7):604-608.
[20]孙备.(14-脱氧穿心莲内酯和14-脱氧)11,12)二去氢穿心莲内酯对培养的人体内皮细胞NO生成的影响[J].国外医学:中医中药分册,2000,22(2):100-101.
[21]彭光勇,周峰,丁如宁,等.莲必治注射液(穿心莲内酯)对免疫功能的调作用[J].中国中药杂志,2002,27(2):147-150.
[22]Anju Puri,Ragini Saxena,Saxena R P,et al.Immunostimulant agents from Andrographis paniculata[J].J Nat Prod,1993,56(7):995-999.
[23]Wang Bin,Ge Liang.Synthesis and Preliminary Anti-HIV Activities of Andrographolide Derivatives[J].Medicinal Chemistry,2010,6(4):252-258.
[24]杨琼,李曙光,董建华,等.穿心莲内酯及其衍生物的抗肿瘤作用及机制[J].山东医药,2009,12(49):108-109.
[25]Jiang CG,Li JB,Liu FR,et al.Andrographolide inhibits the adhesion of gastric cancer cells to endothelial cells by blocking E-selectin expression[J].Anticancer Res,2007,27(4B):2439-2447.
[26]Kim TG,Hw I KK,Hung CS.Morphological and biochemical changes of andrographolide induced cell death inhuman prostatic adeno carcinom a PC-3 cells[J].In Vivo,2005,19(3):551-557.
[27]Cheung HY,Chrung SH,LI J,et al.Andrographolide isolated from Andrograph is paniculata induces cell cycle arrest and mitochondrial mediated apoptosis in human leukemic HL-60 cells[J].Planta Med,2005,71(12):1106-1111.
[28]韩光,杜钢军,许启泰.穿心莲二萜内酯类化合物的合成及抗肿瘤构效关系研究[J].中国药学杂志,2008,43(10):790-794.
[29]戴桂馥,马文艳,刘宏民,等.穿心莲内酯衍生物体外抗肿瘤作用及构效关系研究[J].中国新药杂志,2011,20(4):362-366.
[30]Nanduri S,Nyavanandi V K,Thunuguntla S S R,et al.Synthesis and structure-activity relationship s of andrographolide analoguesas novel cytotoxic agents[J].Bioorganic Med Chem Letters,2004,14(18):4711-4719.
[31]Bimolendu Das,Chinmay Chowdhury.Synthesis,cytotoxicity,and structure activity relationship(SAR)studies of andrographolide analogues as anti-cancer agent[J].Bioorganic&Medicinal Chemistry Letters,2010,20(23):6947-6950.

