α-苦瓜素体内抗人乳腺癌MCF-7移植瘤实验*
沈富林,曹东亮,邓 斐,沈富兵△
1.湖北省十堰市郧县中医院(十堰 442500);2.成都医学院 检验医学院(成都610500)
α-苦瓜素(α-momorchain,α-MMC)是从苦瓜籽中提取分离的一种核糖体失活蛋白(ribosomeinactivating proteins,RIPs),同天花粉蛋白、美洲商陆抗病毒蛋白等I型RIPs一样,其能专一地水解真核细胞核糖体28SrRNA第A4324位上的腺嘌呤碱基与核糖之间的N-C糖苷键,释放出1个腺嘌呤碱基,阻遏延长因子EF-2与核糖体的结合,从而抑制蛋白质[1]。α-MMC具有广泛的生物学功能,包括抗肿瘤、抗病毒及细菌、抗生育、免疫调节等,其抗肿瘤作用受到广泛关注和研究。Tsao等[2]报道α-苦瓜素能选择性地杀伤绒毛膜癌细胞和黑色素瘤细胞,能较强抑制S-180实体瘤生长和NKM细胞的DNA、RNA 及其蛋白质合成活性[3]。Pan等[4]报道α-MMC在常氧和低氧情况下对人鼻咽癌细胞有选择性细胞毒性。笔者[5]前期研究发现,α-MMC对鼠乳腺癌细胞EMT-6具有较好的抗肿瘤活性,且体外实验[6]也显示出其对人乳腺癌细胞株(MDA-MB-231)具有明显抑制作用。目前α-MMC体外抗肿瘤作用研究较多,体内抗肿瘤作用研究较少,α-MMC体内抗人乳腺癌MCF-7移植瘤作用未见报道。本实验拟通过建立MCF-7裸鼠移植瘤模型探讨α-MMC的体内抗肿瘤效果,并通过检测肿瘤原位凋亡状况以了解α-MMC的抗肿瘤机制,现报道如下。
1 材料与方法
1.1 药物与试剂
α-MMC(溶剂为0.01MpH 7.4的 PBS缓冲液)由四川大学生命科学院孟延发教授惠赠,规格为2.5mg/mL,其制备方法见文献[7]。DMEM 培养基和胎牛血清购自美国Gibco公司,胰蛋白酶购自美国Sigma公司,青霉素-链霉素溶液购自美国Thermo公司,TUNEL原位检测试剂盒购自德国Roche公司。
1.2 实验动物
BALB/c裸小鼠(雌性,SPF级,18~20g)购于中国科学院上海实验动物中心。按SPF级动物饲养条件饲养,颗粒饲料、鼠笼、垫料、饲料及饮用水均经灭菌处理,鼠笼每周更换2次,动物房室内温度25℃,相对湿度70%,12h明暗交替,换气次数为10~20次/h,小鼠均自由饮水与摄食。
1.3 细胞培养
人乳腺癌MCF-7细胞株购于中国科学院上海生命科学研究院,培养基为DMEM(含10%胎牛血清),37 ℃、5%CO2条件下培养。
1.4 人乳腺癌MCF-7移植瘤模型构建
常规培养人乳腺癌 MCF-7细胞株,以250mL的细胞培养瓶大量传代,获得所需细胞数后收获计数,以无血清DMEM培养基稀释成3×106个/mL,以1mL注射器接种至BALB/c裸小鼠腋下,0.2mL/只,观察肿瘤生长情况,并以游标卡尺测量肿瘤长径和短径。
1.5 α-MMC给药及抗肿瘤效果
当肿瘤体积达到80~100mm3时,裸鼠被随机分为4组,分别为α-MMC低、中、高3个剂量给药组和1个溶剂对照组,每组各8只。根据预实验结果,设定α-MMC低、中、高剂量分别为0.53、0.8、1.2mg/kg,给药方式为腹腔注射,3次/周;对照组腹腔注射0.2mL的PBS溶剂,4组均连续用药6周。用药期间观察裸鼠的一般情况,每周测量1次肿瘤大小。
肿瘤体积(TV)的计算公式为:TV=1/2×a×b2,其中,a、b分别表示长宽。根据测量结果计算出“相对肿瘤体积”(RTV),RTV=Vt/V0×100,其中V0为分笼给药当天测量所得肿瘤体积,Vt为每次测量时的肿瘤体积。抗肿瘤活性的评价指标为“相对肿瘤增殖率”[T/C(%)],T/C(%)=TRTV/CRTV×100,TRTV:治疗组 RTV;CRTV:阴性对照组 RTV。疗效评价标准:T/C(%)>40%为无效;T/C(%)≤40%,并经方差分析与阴性对照组相比,P<0.05为有效。
实验结束时麻醉条件下脱颈处死动物,剥取肿瘤块于10%甲醛溶液中固定,常规方法制作肿瘤组织切片,用TUNEL原位凋亡检测试剂盒测定肿瘤细胞的凋亡状况。
1.6 统计学方法
采用SPSS 19.0统计学软件进行数据分析,每组数据以均数±标准差(±s)表示,多组比较及组间比较应用方差分析。以P<0.05为差异有统计学意义。
2 结果
2.1 α-MMC可明显抑制人乳腺癌 MCF-7移植瘤的生长
裸鼠MCF-7移植瘤模型实验中,对照组的肿瘤体积增长迅速,6周内增长了17倍,其平均终末RTV为(1 743.17±96.60)%。低剂量组平均终末RTV和T/C(%)分别为(1 203.89±79.05)%和69.06%,表现出一定的肿瘤生长抑制作用;而中、高剂量组肿瘤生长受到明显抑制,平均终末RTV分别为(680.37±33.26)%和(590.79±35.02)%,T/C(%)分别为39.03%和33.89%(表1、图1)。经统计分析,3个不同剂量给药组的RTV与对照组相比差异均有统计学意义(P<0.05),但因低剂量组T/C(%)>40%,被判定为差异无统计学意义,而中、高剂量组T/C(%)<40%,判为差异有统计学意义,具有有效抑制作用。
表1 α-MMC体内抗肿瘤活性(±s,n=8)

表1 α-MMC体内抗肿瘤活性(±s,n=8)
剂量/(mg/kg)n MCF-7平均终末相对肿瘤体积/% 相对肿瘤增值率/%8 1 743.17±96.60 -α-MMC低剂量组(0.53mg/kg)8 1 203.89±79.05* 69.06 α-MMC中剂量组(0.8mg/kg)8 680.37±33.26* 39.03 α-MMC高剂量组(1.2mg/kg)8 590.79±35.02*对照组(0mg/kg)33.89

图1 人乳腺癌MCF-7移植瘤相对肿瘤体积变化
2.2 α-MMC可诱导人乳腺癌 MCF-7移植瘤细胞凋亡
TUNEL染色结果显示,α-MMC可诱导 MCF-7肿瘤组织细胞凋亡,3个不同剂量给药组(0.53、0.8、1.2mg/kg)α-MMC呈剂量依赖性荧光细胞数增多,而对照组未见凋亡荧光(图2)。
3 讨论
乳腺癌是一种常见女性恶性肿瘤,全世界每年超过138万人发病[8],发病率日益增高。目前有研究[6]表明,苦瓜核糖体失活蛋白的α-MMC体外能抑制鼠乳腺癌EMT-6细胞株以及人乳腺癌细胞MDA-MB-231和 MCF-7的生长,体内实验[5]也观察到α-MMC对EMT-6和 MDA-MB-231移植瘤有较好抑制效果。同为Ⅰ型核糖体失活蛋白的天花粉蛋白(TCS)也观察到具有明显的抗乳腺癌作用[9]。因此,将苦瓜核糖体失活蛋白用于临床抗乳腺癌治疗具有较好的前景。
笔者通过BALB/c裸小鼠移植瘤模型观察α-MMC体内抗人乳腺癌MCF-7细胞株的效果,结果显示,3个不同剂量给药组的α-MMC都有明显的抗肿瘤效果,其RTV值与对照组相比差异均有统计学意义(P<0.05),而中、高剂量组的抗肿瘤效果更好,符合相对肿瘤增值率<40%有效性的判断标准。
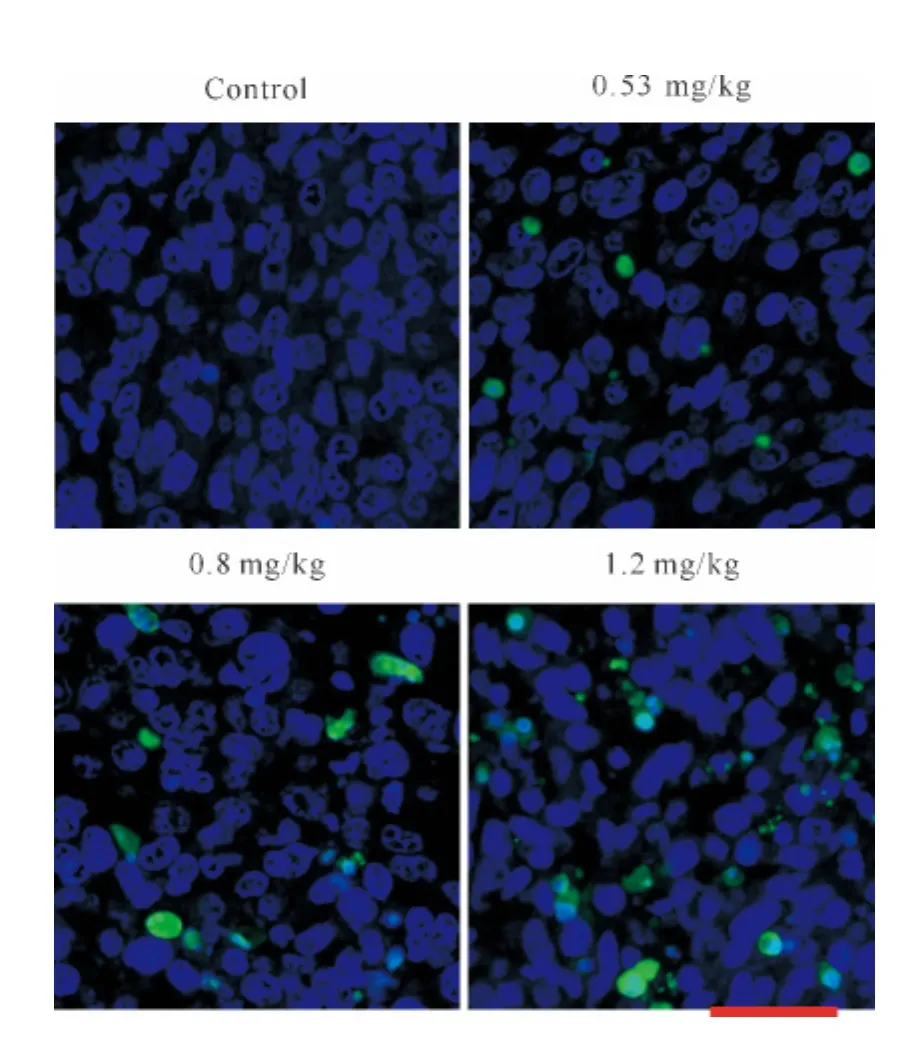
图2 TUNEL染色法检测人乳腺癌MCF-7移植瘤细胞凋亡状况
RIPs的抗肿瘤机制主要是诱导肿瘤细胞凋亡,如有报道天花粉蛋白是通过线粒体和内质网应激压力信号通路诱导 HL-60细胞凋亡[10],通过 PKC/MAPK/CREB信号途径来抑制 HeLa细胞的增殖[11],通过下调Notch信号通路来抑制鼻咽癌细胞CNE2增殖[12],并通过诱导鼻咽癌细胞 CNE1、CNE2凋亡及端粒酶活性来抑制鼻咽癌细胞的增殖[13]。体外培养的不同肿瘤细胞系用α-MMC及β-MMC作用后,结果显示α-MMC及β-MMC能显著增加Caspase 3和Caspase 9的活性及细胞色素C的释放。本研究观察到在中、高剂量组的肿瘤组织中经TUNEL染色有明显的细胞凋亡图像,证实了α-MMC是通过细胞凋亡来发挥抗肿瘤作用的。
RIPs的药物毒性是困扰其临床应用的主要问题,笔者曾报道了α-MMC在SD大鼠体内可观察到较高的免疫原性、免疫毒性及肝毒性[14],而用PEG修饰后能明显降低其毒性[15]。下一步课题组将在体内抗肿瘤药效的基础上研究其体内毒性,并通过系列剂量设置以获得α-MMC的治疗窗,为其临床抗乳腺癌实践提供安全性支撑。
[1]Sawasaki T,Morishita R,Ozawa A,etal.Mechanism of ribosome RNA apurinic site specific lyase[J].Nucleic Acids Symp,1999(42),257-258.
[2]Tsao SW,Ng TB,Yeung HW.Toxicities of trichosanthin and alpha-momorcharin,abortifacient proteins from Chinese medicinal plants,on cultured tumor cell lines[J].Toxicon,1990,28(1),1183-1192.
[3]Ng TB,Liu WK,Sze SF,etal.Action ofα-momorcharin,a ribosome inactivating protein,on cultured tumor cell lines[J].Gen Pharmacol,1994,25(1):75-77.
[4]Pan WL,Wong JH,Fang EF,etal.Preferentical cytotoxicity of the type I ribosome inactivating protein alpha-momorcharin on human nasopharyngeal carcinoma cells under normoxia and hypoxia[J].Biochem Pharmacol,2014,89(3):329-339.
[5]Deng NH,Wang L,He QC,etal.PEGylation alleviates the non-specific toxicities of alpha-momorchain and preserves its antitumor efficacy in vivo[J].Drug Deliv,2014,30:53.
[6]Bian X,Shen F,Chen Y,etal.PEGylation of alphamomorcharin:synthesis and characterization of novel antitumor conjugates with therapeutic potential[J].Biotechnol Lett,2010,32(7):883-890.
[7]Meng Y,Lin S,Liu S,etal.A Novel Method for Simultaneous Production of Two Ribosome Inactivating Proteins,α-MMC and MAP30,from Momordica charantia L[J].Plos One,2014,9(7):1-7.
[8]Jemal A,Bray F,Center MM,etal.Global cancer statistics[J].CA Cancer J Clin,2011,61(2):69-90.
[9]Fang EF,Zhang CZ,Zhang L,etal.Trichosanthin Inhibits Breast Cancer Cell Proliferation in Both Cell Lines and Nude Mice by Promotion of Apoptosis[J].Plos One,2012,7(9):41592.
[10]Li J,Xia X,Ke Y,etal.Trichosanthin induced apotosis in HL-60cells via mitochondrial and endoplasmic reticulum stress signaling pathways[J].Biochim Biophys Acta,2007,1770(8):1169-1180.
[11]Wang P,Huang S,Wang F,etal.Cyclic AMP-Response Element Regulated Cell Cycle Arrests in Cancer Cells[J].Plos One,2013,8(6):65661.
[12]Liu F,Wang B,Wang Z,etal.Trichosanthin down-regulates Notch signaling and inhibits proliferation of the nasopharyngeal carcinoma cell line CNE2in vitro[J].Fitoterapia,2012,83(5):838-842.
[13]Kang M,Ou H,Wang R,etal.Effect of trichosanthin on apoptosis and telomerase activity of nasopharyngeal carcinomas in nude mice[J].J Buon,2013,18(3):675-682.
[14]Meng Y,Liu B,Lei N,etal.Alpha-momorcharin possessing high immunogenicity,immunotoxicity and hepatotoxicity in SD rats[J].Journal of Ethnopharmacology,2012,139(2):590-598.
[15]Zheng JC,Lei N,He QC,etal.PEGylation is effective in reducing immunogenicity,immunotoxicity,and hepatotoxicity ofα-momorcharininvivo[J].Immunopharmacology and Immunotoxicology,2012,34(5):866-873.

