Notch-RBP-J 信号通路对小鼠黑素瘤细胞B16F10与小鼠单核巨噬细胞RAW264.7共培养巨噬细胞极化影响的研究
吴琼 陈浩 周武庆 李阿梅 吕雅琳 胡彬 姜祎群 孙建方
·论著·
Notch-RBP-J 信号通路对小鼠黑素瘤细胞B16F10与小鼠单核巨噬细胞RAW264.7共培养巨噬细胞极化影响的研究
吴琼 陈浩 周武庆 李阿梅 吕雅琳 胡彬 姜祎群 孙建方
目的探讨小鼠黑素瘤细胞B16F10与小鼠单核巨噬细胞RAW264.7共培养中Notch-RBP-J信号通路对巨噬细胞表型分化的影响。方法设计针对CBF1/RBP-Jκ基因的siRNA编码序列,转染至小鼠单核巨噬细胞RAW264.7细胞。实验分4组:沉默前共培养组,B16F10细胞与RAW264.7细胞共培养;沉默后共培养组,B16F10细胞与RBP-Jκ基因沉默后的RAW264.7细胞共培养;空白对照组,单独培养的RAW264.7细胞;阳性对照组,白细胞介素4刺激诱导的RAW264.7细胞。Western印迹法、ELISA法及流式细胞仪检测各组巨噬细胞的表型;RT-PCR法检测各组notch1、notch2、DLL1、DLL4及Hes1的表达。采用SPSS17.0软件进行重复测量方差分析及单因素方差分析、线性趋势检验、Bonferroni两两比较。结果Western印迹结果显示,RAW264.7与B16F10共培养不同时间后,RAW264.7细胞的CD163在空白对照组、共培养24 h、48 h、72 h组、阳性对照组的相对表达量分别为1.016± 0.018、1.274±0.034、2.065±0.094、3.615±0.144、3.099±0.071,经单因素方差分析(n=4),F =527.42,P <0.01,共培养后RAW264.7细胞CD163表达量较空白对照组增加;ELISA检测结果显示,共培养24、48、72 h,RAW264.7细胞培养上清液白细胞介素10的水平分别为(167.610±3.527)、(433.433 ± 5.558)、(679.673 ± 8.101) ng/L。沉默后共培养 24、48、72 h,RAW264.7细胞培养上清液白细胞介素10表达量分别为(63.403± 0.856)、(103.427± 2.072)、(202.297± 3.610)ng/L,较未沉默时降低(F=8.01,P<0.05)。Western印迹法及流式细胞仪分别检测沉默后共培养RAW264.7细胞CD163、CD206的表达量,均较未沉默时减少(P<0.05)。RT-PCR示,沉默后共培养组较沉默前共培养组及对照组的Notch信号通路相关基因mRNA表达均降低。结论沉默Notch-RBP-J信号通路后共培养组中RAW264.7细胞向M2型极化较未沉默共培养组减少,总体表型仍为M2型;该通路的活化促进RAW264.7细胞向M2型极化。
Notch-RBP-J信号通路;巨噬细胞极化;共同培养技术
巨噬细胞是肿瘤间质炎症中的一种主要细胞,然而,在大多数实体瘤中,巨噬细胞的存在有利于肿瘤的生长和转移。肿瘤相关巨噬细胞(tumorassociated macrophages,TAM)通过产生白细胞介素10(IL-10)以及肿瘤生长因子 β(TGF-β)来抑制抗肿瘤的免疫反应,同时可能通过分泌前血管生成因子促进肿瘤的血管新生,并通过改变肿瘤微环境协助肿瘤的转移及扩散[1-2]。巨噬细胞根据环境不同大致可极化为经典活化型巨噬细胞(M1型)及替代活化型巨噬细胞(M2型)[3]。M1型巨噬细胞介导Th1型免疫应答,杀灭细胞内微生物及肿瘤细胞,并释放大量促炎因子;M2型巨噬细胞参与诱导Th2型免疫应答,清除残留物,促进血管生成,参与组织重塑和修复,并具有促肿瘤的作用[4]。M1型及M2型巨噬细胞在肿瘤中的作用截然相反。在肿瘤组织内,巨噬细胞受到肿瘤微环境多种因素的影响,获得TAM表型,表现出M2型巨噬细胞的特性[5]。本研究旨在通过共培养小鼠黑素瘤细胞B16F10及小鼠单核巨噬细胞RAW264.7,观察共培养对巨噬细胞表型的影响,探讨发生影响的机制。
材料和方法
一、材料
1.主要试剂与耗材:RPMI1640细胞培养基、DMEM高糖细胞培养基、Trizol及转染试剂产自美国Invitrogen公司,牛血清产自美国ExCell Biology公司;流式抗体CD206产自美国ebioscience公司,兔抗人CD163抗体产自博奥森公司,IL-10及IL-4、IL-12、RT-PCR试剂盒产自南京凯基生物科技发展有限公司;6孔Transwell板产自美国Corning公司。
2.细胞系:B16F10细胞系来自美国标准生物品收藏中心,本所中心实验室保存;RAW264.7细胞来自中国科学院上海生命科学研究院细胞资源中心。
二、方法
1.实验分组:沉默前共培养组:B16F10细胞与RAW264.7细胞共培养;沉默后共培养组:B16F10细胞与RBP-Jκ基因沉默后的RAW264.7细胞共培养;空白对照组:单独培养的RAW264.7细胞;阳性对照组:白细胞介素4刺激诱导的RAW264.7细胞。
2.细胞转染:根据Gene bank中CBF1/RBP-Jκ基因的序列,针对不同位点设计20nt左右的siRNA序列,通过脂质体转染至RAW264.7细胞,提取细胞总RNA,RT-qPCR检测沉默效率。
3.B16F10与RBP-Jκ基因沉默前后的RAW264.7细胞共培养:在孔径0.4 μm的transwell小室下室接种沉默前后的RAW264.7细胞(5×104个/孔)过夜,待细胞贴壁后,上室接种B16F10细胞(104个/孔),分别共培养24、48、72 h后,吸取下室培养基检测沉默前后的RAW264.7表型的变化,并收集细胞。
4.IL-4刺激诱导RAW264.7细胞:诱导前1 d,接种适当数量的细胞至细胞培养板中,加入不含抗生素的培养基,细胞密度30%~50%,过夜贴壁后用含有50 μg/L IL-4的培养基培养48 h。
5.Western印迹法检测共培养后RAW264.7细胞表型:提取各组总蛋白,常规进行SDS-PAGE电泳,使用Gel-Pro32软件对结果进行灰度分析。
6.ELISA法检测共培养后RAW264.7细胞表型:共培养后收集RAW264.7细胞培养基,离心取上清液,用ELISA试剂盒检测上清液中IL-10、IL-12的表达。
7.流式细胞仪检测共培养后RAW264.7细胞表型:胰酶消化计数,5×105个/管,磷酸盐缓冲液(PBS)洗涤 1 次,100 μl PBS重悬,加 1 μg抗体,4 ℃共育30 min,PBS洗去游离的抗体,用0.5 ml PBS重悬后,流式细胞仪FACSCalibu检测。
8.RT-PCR法检测各组细胞 notch1、notch2、DLL1、DLL4及Hes1的表达:Trizol法提取各组细胞的总RNA,逆转录为cDNA,按照说明书进行RT-PCR检测。Notch1 上游引物:5′-CCTGCCACTATGGTTCC TGT-3′,下游引物:5′-GGGTTGGACTCACACTCGT T-3′;Notch2 上游引物:5′-ACCCTTGTATGCACGGA GTC-3′,下游引物:5′-CCAGGTTATTGCACGTTCC T-3′;DLL1 上游引物:5′-TGCAGGAGTTCGTCAAC AAG-3′,下游引物:5′-CTCCCCTGGTTTGTCACAG T-3′;DLL4 上游引物:5′-GCCTCTCGAACTTGGACT TG-3′,下游引物:5′-AGCTCCTGCTTAATGCCAAA-3′;Hes1 上游引物:5′-GGTGCTGATAACAGCGGAAT-3′,下游引物:5′-ATGCCGGGAGCTATCTTTCT-3′。
9.统计学分析:实验重复3次,采用SPSS17.0软件进行重复测量及单因素方差分析、线性趋势检验、Bonferroni两两比较,数据以±s表示。
结 果
一、RAW264.7细胞与B16F10细胞共培养不同时间后CD163的变化
RAW264.7细胞的CD163在空白对照组、共培养24、48、72 h组、阳性对照组的相对表达量分别为1.016 ± 0.018、1.274 ± 0.034、2.065 ± 0.094、3.615 ±0.144、3.099 ± 0.071,经单因素方差分析(n=4),F=527.42,P<0.01,CD163表达在共培养组随时间延长表达量增加(图1)。
二、Western印迹检测RAW264.7与B16F10共培养后表型的变化
经重复测量方差分析,沉默后与沉默前共培养组比较,RAW264.7细胞CD163表达量下降,差异有统计学意义(n=1.021,F=8.85,P< 0.05);线性趋势检验示,在沉默后与沉默前两组内部 24、48、72 h 三个时间点,CD163的表达量成线性趋势(n=1,F=18.99,P=0.007),随时间延长表达量增加。见图2、表1。
三、ELISA法检测RAW264.7与B16F10共培养后 IL-10、IL-12 的变化
重复测量方差分析及线性趋势检验结果表明,沉默后与沉默前共培养组比较,IL-10表达量下降,差异有统计学意义(P<0.05),且在两组内部3个时间点,IL-10的表达量成线性趋势(n=1,F=15.20,P<0.05),随时间延长表达量增加。各组IL-12水平则无明显改变(P>0.05)。见表1。
四、流式细胞仪检测RAW264.7与B16F10共培养后CD206的变化
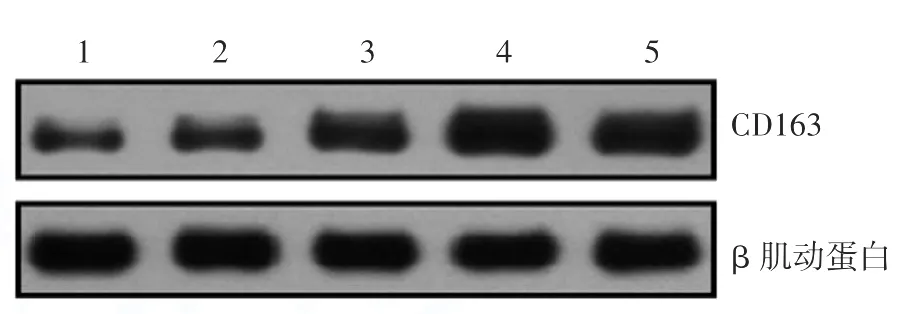
图1 Western印迹检测RAW264.7细胞与B16F10细胞共培养不同时间后CD163的变化 1:空白对照组;2~4:分别为共培养24 h、48 h、72 h; 5:阳性对照组

图2 Western印迹检测RAW264.7基因RBP-Jk沉默前后与B16F10共培养不同时间后CD163蛋白的变化 1:空白对照组;2~4:分别为RBP-Jk沉默前共培养24、48、72 h; 5 ~ 7:分别为RBP-Jk沉默后共培养 24、48、72 h
表1 RAW264.7细胞与B16F10细胞共培养不同时间CD163相对表达量及IL-10、IL-12表达量、CD206荧光值的变化(±s)
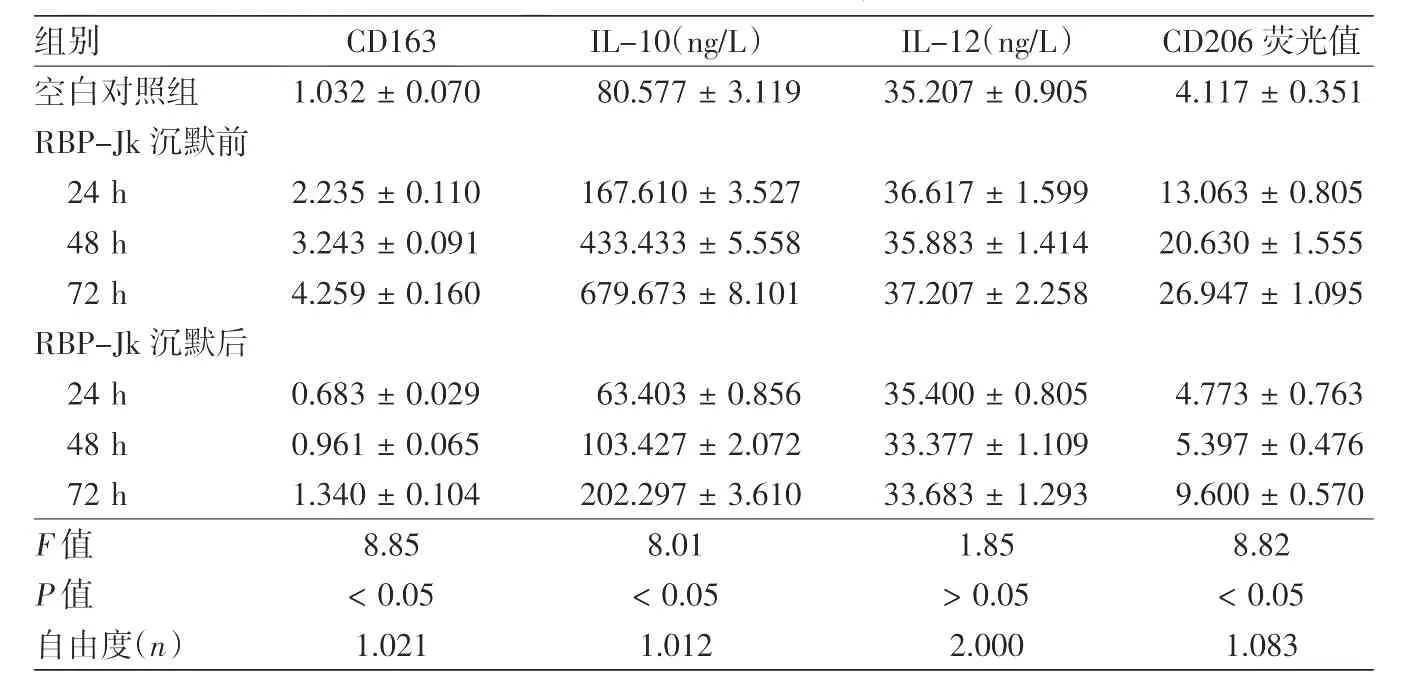
表1 RAW264.7细胞与B16F10细胞共培养不同时间CD163相对表达量及IL-10、IL-12表达量、CD206荧光值的变化(±s)
组别 CD163 IL-10(ng/L) IL-12(ng/L) CD206荧光值空白对照组 1.032±0.070 80.577±3.119 35.207±0.905 4.117±0.351 RBP-Jk沉默前24 h 2.235±0.110 167.610±3.527 36.617±1.599 13.063±0.805 48 h 3.243±0.091 433.433±5.558 35.883±1.414 20.630±1.555 72 h 4.259±0.160 679.673±8.101 37.207±2.258 26.947±1.095 RBP-Jk沉默后24 h 0.683±0.029 63.403±0.856 35.400±0.805 4.773±0.763 48 h 0.961±0.065 103.427±2.072 33.377±1.109 5.397±0.476 72 h 1.340±0.104 202.297±3.610 33.683±1.293 9.600±0.570 F值 8.85 8.01 1.85 8.82 P值 <0.05 <0.05 >0.05 <0.05自由度(n) 1.021 1.012 2.000 1.083

图3 流式细胞仪检测RAW264.7基因RBP-Jk沉默前后与B16F10共培养不同时间后CD206的变化 3a:对照组;3b~3d:RBP-Jk沉默前共培养 24、48、72 h; 3e ~ 3f:RBP-Jk沉默后共培养 24、48、72 h
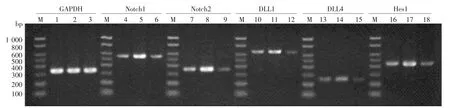
图4 RT-PCR法检测RAW264.7基因RBP-Jk沉默前后与B16F10共培养Notch信号通路相关基因mRNA的变化 M:标准参照物;1~3:分别为对照组、沉默前、沉默后的内参(GAPDH),352 bp; 4 ~ 6:分别为以上3组的Notch1,562 bp; 7 ~ 9:分别为以上3组的 Notch2,372 bp;10~12:分别为以上3组的DLL1,638 bp;13~15:分别为以上3组的DLL4,251 bp;16~18:分别为以上3组的Hes1,446 bp
表2 RAW264.7细胞与B16F10细胞共培养Notch信号通路相关基因mRNA的变化(与GAPDH的比值,±s)
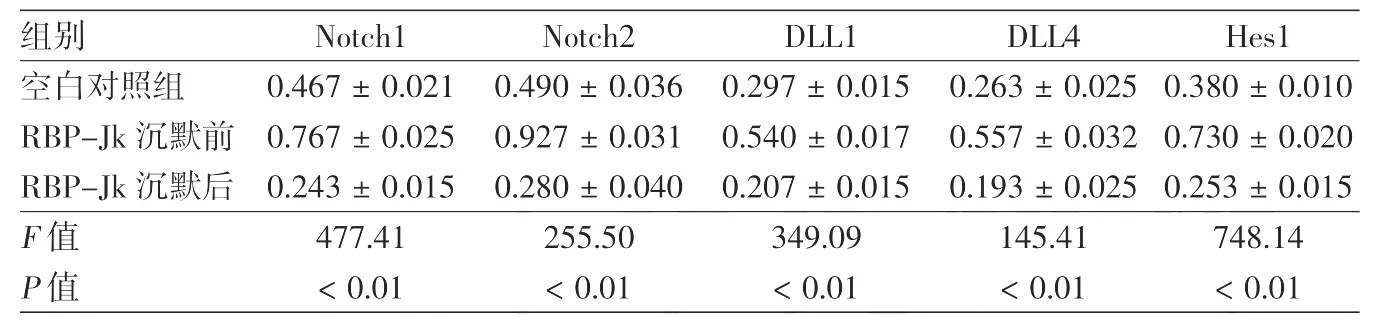
表2 RAW264.7细胞与B16F10细胞共培养Notch信号通路相关基因mRNA的变化(与GAPDH的比值,±s)
注:n=2
组别 Notch1 Notch2 DLL1 DLL4 Hes1空白对照组 0.467±0.021 0.490±0.036 0.297±0.015 0.263±0.025 0.380±0.010 RBP-Jk沉默前 0.767±0.025 0.927±0.031 0.540±0.017 0.557±0.032 0.730±0.020 RBP-Jk沉默后 0.243±0.015 0.280±0.040 0.207±0.015 0.193±0.025 0.253±0.015 F值 477.41 255.50 349.09 145.41 748.14 P值 <0.01 <0.01 <0.01 <0.01 <0.01
经重复测量方差分析及线性趋势检验,沉默后与沉默前共培养组比较,CD206表达量下降,差异有统计学意义(P<0.05);且在两组内部,CD206的表达量在不同时间点成线性趋势(n=1,F=20.362,P=0.006),随时间延长表达量增加。见表1、图3。
五、RT-PCR法检测RAW264.7与B16F10共培养Notch信号通路相关基因mRNA的变化
单因素方差分析及两两比较结果显示,空白对照组、沉默前及沉默后组 Notch1、Notch2、DLL1、DLL4、Hes1相对表达量差异有统计学意义(P<0.01),且在沉默前共培养组的相对表达量均较空白对照组升高,差异均有统计学意义(P<0.05);而在沉默后共培养组的相对表达量则较沉默前共培养组下降,差异均有统计学意义(P<0.05)。见表2、图4。
讨 论
M1型巨噬细胞由脂多糖(LPS)及干扰素γ(IFN-γ)诱导,产生诱导型一氧化氮合酶(iNOS)及细胞因子如肿瘤坏死因子 α(TNF-α)、IL-1、IL-6 及高水平的IL-12等,而M2型巨噬细胞则由IL-4、IL-10及IL-13诱导,分泌转化生长因子β(TGF-β)、IL-1受体拮抗剂及高水平的IL-10等。巨噬细胞分泌的IL-12与IL-10的比例是区分M1及M2型的关键[6]。另外,M1 型巨噬细胞还表达 CD16、CD32、iNOS,M2 型巨噬细胞的标志为 CD206、CD163[7]。Notch信号通路是由Notch配体、受体及下游信号转导分子及调节分子构成。哺乳动物Notch受体包 括 Notch1、Notch2、Notch3、Notch4,配 体 包 括Delta-like1、3、4(DLL1、3、4)及Jagged1、2(Jag1、2)[8]。Notch 受体活化后通过DNA结合蛋白CBF1/RBP-J发挥效应,Notch信号激活HES转录因子,引起HES靶基因的抑制。有研究表明,Notch信号通路的活化促使巨噬细胞向M1型极化,并抑制向M2型极化,RBP-J介导的Notch信号通路在巨噬细胞极化中起重要的作用[3]。
研究表明,巨噬细胞与乳腺癌或卵巢癌细胞体外共培养能够增加肿瘤细胞的侵袭性[9],那么,共培养体系中肿瘤细胞对于巨噬细胞会有何种影响呢?Hagemann等[10]的研究发现,卵巢癌细胞与巨噬细胞共培养后能够使巨噬细胞向具有TAM特性的表型分化。本研究采用小鼠单核巨噬细胞RAW264.7和小鼠黑素瘤细胞B16F10共培养,免疫印迹法及ELISA检测结果显示,随共培养时间延长,RAW264.7细胞CD163表达量及上清IL-10水平逐渐增多,而上清IL-12水平无明显改变。提示体外共培养体系中肿瘤细胞可使周围的巨噬细胞向M2型极化。CBF1/RBP-J是活化Notch信号通路的重要蛋白,通过设计针对小鼠RBP-Jκ基因的siRNA编码序列,并转染至巨噬细胞内达到沉默Notch信号通路的目的。Notch信号通路沉默后共培养,ELISA示IL-12水平无显著改变(P>0.05),沉默后巨噬细胞向M1型分化未受明显影响;IL-10表达量较未沉默时降低(P<0.05),但水平仍高于IL-12;免疫印迹法及流式细胞仪检测示巨噬细胞CD163及CD206表达较未沉默时减少。提示RAW264.7细胞Notch信号通路沉默后与肿瘤细胞共培养向M2型分化有所减少,但总体表型仍为M2型。既往有研究显示,Notch信号通路的活化促使巨噬细胞向M1型极化,抑制向M2型极化[3],依此进行理论上的推断,抑制Notch信号通路可能促进向M2型极化并抑制向M1型极化。但重复实验并未出现推断的结果,M2型极化并未增多,而M1型极化亦无显著减少。分析出现此结果的原因可能有以下两方面:①Notch信号通路沉默后的共培养体系中RAW264.7细胞出现了除M1及M2型以外其他型别的分化,具体尚待进一步研究验证。Mosser等[11]认为,巨噬细胞呈现出的表型不固定,而是由特定的表型以不同的比例混合而成,从而表现出不同的活化状态,其极化具有复杂性和多样性;②除Notch信号通路外,可能还有其他信号通路影响着共培养体系中巨噬细胞的极化,如文献中报道的JAK/STAT途径[12],M2分化成熟的转录调节途径(KLF4 的转录调节[13],PPARs的转录调节[14])以及 Jmjd3 的表观遗传学调节途径[15]。RTPCR法检测沉默前后共培养Notch信号通路相关基因mRNA的变化,结果显示,沉默前共培养RAW264.7细胞Notch信号通路活化程度较单独培养RAW264.7细胞增高,但沉默前共培养巨噬细胞表型为M2型,而非M1型,与“Notch信号通路的活化促使巨噬细胞向M1型极化并抑制向M2型极化”并不一致。沉默后共培养巨噬细胞表型虽然仍为M2型,但数量较沉默前有所减少,Notch信号通路的阻断并未促进共培养后巨噬细胞向M2型分化。Notch信号通路在TAM极化过程中到底起了何种作用?为进一步探讨Notch信号通路在肿瘤细胞对巨噬细胞极化的影响中的作用,下一步的实验计划过度活化该通路,观察该状态下巨噬细胞与肿瘤细胞共培养后的极化情况。
[1]Biswas SK,Gangi L,Paul S,et al.A distinct and unique transcriptional program expressed by tumor-associated macrophages(defective NF-kappaB and enhanced IRF-3/STAT1 activation)[J].Blood,2006,107(5);2112-2122.
[2]Lin EY,Pollard JW.Tumor-associated macrophages press the angiogenic switch in breast cancer[J].Cancer Res,2007,67(11);5064-5066.
[3]Wang YC,He F,Feng F,et al.Notch signaling determines the M1 versus M2 polarization of macrophages in antitumor immune responses[J].Cancer Res,2010,70(12);4840-4849.
[4]Sica A,Larghi P,Mancino A,et al.Macrophage polarization in tumour progression[J].Semin Cancer Biol,2008,18(5);349-355.
[5]Solinas G,Schiarea S,Liguori M,et al.Tumor-conditioned macrophages secrete migration-stimulating factor;a new marker for M2-polarization,influencing tumor cell motility[J].J Immunol,2010,185(1);642-652.
[6]Martinez FO,Sica A,Mantovani A,et al.Macrophage activation and polarization[J].Front Biosci,2008,13;453-461.
[7]Aron-Wisnewsky J,Tordjman J,Poitou C,et al.Human adipose tissue macrophages;m1 and m2 cellsurface markersin subcutaneous and omental depots and after weight loss[J].J Clin Endocrinol Metab,2009,94(11);4619-4623.
[8]Pellegrinet L,Rodilla V,Liu Z,et al.Dll1-and dll4-mediated notch signaling are required for homeostasis of intestinal stem cells[J].Gastroenterology,2011,140(4);1230-1240.
[9]Hagemann T,Wilson J,Kulbe H,et al.Macrophages induce invasiveness of epithelial cancer cells via NF-kappa B and JNK[J].J Immunol,2005,175(2);1197-1205.
[10]Hagemann T,Wilson J,Burke F,et al.Ovarian cancer cells polarize macrophagestoward a tumor-associated phenotype[J].J Immunol,2006,176(8);5023-5032.
[11]Mosser DM,Edwards JP.Exploring the full spectrum of macrophage activation[J].Nat Rev Immunol,2008,8(12);958-969.
[12]Gordon S,Martinez FO.Alternative activation of macrophages;mechanism and functions[J].Immunity,2010,32(5);593-604.
[13]Liao X,Sharma N,Kapadia F,et al.Krüppel-like factor 4 regulates macrophage polarization[J].J Clin Invest,2011,121(7);2736-2749.
[14]Kang K,Reilly SM,Karabacak V,et al.Adipocyte-derived Th2 cytokines and myeloid PPARdelta regulate macrophage polarization and insulin sensitivity[J].Cell Metab,2008,7(6);485-495.
[15]Satoh T,Takeuchi O,Vandenbon A,et al.The Jmjd3-Irf4 axis regulates M2 macrophage polarization and host responses against helminth infection[J].Nat Immunol,2010,11(10);936-944.
2013-12-23)
(本文编辑:颜艳)
Effect of the Notch-RBP-J signaling pathway on the polarization of RAW264.7 murine macrophage-like cells cocultured with B16F10 murine melanoma cells
Wu Qiong,Chen Hao,Zhou Wuqing,Li Amei,Lyu Yalin,Hu Bin,Jiang Yiqun,Sun Jianfang.Institute of Dermatology,Chinese Academy of Medical Sciences and Peking Union Medical College,Nanjing 210042,China
s;Jiang Yiqun,Email;yiqunjiang@qq.com;Sun Jianfang,Email;sunjf57@163.com
ObjectiveTo investigate the effect of the Notch-RBP-J signaling pathway on the phenotypic differentiation of RAW264.7 murine macrophage-like cells cocultured with B16F10 murine melanoma cells.MethodsA small interference RNA (siRNA)targeting the CBF1/RBP-Jκ gene was designed.RAW264.7 murine macrophage-like cells were divided into four groups;unsilenced co-culture group cocultured with B16F10 cells,silenced co-culture group transfected with the designed siRNA and cocultured with B16F10 cells,blank control group cultured alone,positive control group induced by interleukin-4 (IL-4).After additional culture for different durations,Western blot,enzyme-linked immunosorbent assay (ELISA) and flow cytometry were conducted to determine the phenotype of macrophages,and reverse transcription (RT)-PCR was performed to detect the expressions of notch1,notch2,DLL1,DLL4 and Hes1 genes in macrophages.Statistical analysis was carried out by one-way analysis of variance (ANOVA),repeated measures ANOVA,linear trend test and the Bonferroni method with the SPSS17.0 software.ResultsWestern blot showed that the relative expression level of CD163 in RAW264.7 cells was 1.016±0.018 in the blank control group,1.274±0.034,2.065±0.094 and 3.615±0.144 in the unsilenced co-culture group at 24,48 and 72 hours respectively,and 3.099±0.071 in the positive control group,with significant differences between these groups (n=4,F=527.42,P< 0.01).There was a significant increase in CD163 expression in RAW264.7 cells in the unsilenced co-culture group compared with the blank control group.As ELISA revealed,the levels of IL-10 in the culture supernatant of RAW264.7 cells were(167.61±3.527),(433.433 ± 5.558) and(679.673 ± 8.101) ng/L in the unsilenced co-culture group at 24,48,and 72 hours respectively,significantly higher than those in the silenced co-culture group((63.403 ± 0.856),(103.427 ± 2.072),(202.297 ± 3.61) ng/L,respectively,F=8.01,P< 0.05).Western blot and flow cytometry both demonstrated a statistical reduction in the expressions of CD163 and CD206 in RAW264.7 cells in the silenced co-culture group compared with the unsilenced co-culture group(bothP < 0.05).The mRNA expressions of notch signaling pathwayrelated genes in RAW264.7 cells were also attenuated in the silenced co-culture group in comparison with the unsilenced co-culture group.ConclusionsAlthough most of the RAW264.7 cells in the silenced co-culture group exhibited the M2 phenotype,their polarization toward M2 phenotype was weakened compared with those in the unsilenced co-culture group,implying that the activation of the Notch-RBP-J signaling pathway promotes the M2-polarization of RAW264.7 cells.
Notch-RBP-J signaling pathway;Macrophage polarization;Coculture techniques
10.3760/cma.j.issn.0412-4030.2014.011.001
国家自然科学基金(81102067);中国医学科学院北京协和医学院青年基金(5201-01-6068)
210042南京,中国医学科学院北京协和医学院皮肤病研究所
姜祎群,Email:yiqunjiang@qq.com;孙建方,Email:sunjf57@163.com

