斑秃皮损内朗格汉斯细胞及CD8+T细胞的数量及分布分析
张小婷 李水凤 赵莹 叶艳婷 戚世玲 杨雨清 曹慧 章星琪
斑秃皮损内朗格汉斯细胞及CD8+T细胞的数量及分布分析
张小婷 李水凤 赵莹 叶艳婷 戚世玲 杨雨清 曹慧 章星琪
目的探讨斑秃患者脱发皮损中朗格汉斯细胞在斑秃病理进程中的分布以及与T细胞的关系。方法对29例斑秃患者(活动期16例,非活动期13例)头皮脱发皮损进行CD1a免疫组化染色,对其中17例斑秃患者行CD4、CD8免疫组化染色。荧光半定量PCR测定局部皮损浅层和深层CD1a和粒细胞巨噬细胞刺激因子(GM-CSF)的mRNA表达水平。结果斑秃患者表皮和真皮各处包括真皮浅层血管周围、毛囊周围,真皮深层血管周围、毛囊周围CD1a阳性LC数量均较健康对照显著增加(Z=4.354,2.884,4.640,3.217,3.496,均P<0.01),活动期皮损表皮层、深层血管、深层毛囊CD1a阳性LC数量较非活动期皮损高(Z=2.457,2.130,1.954,P≤0.05)。斑秃患者CD1a、GM-CSF mRNA相对表达量在皮损真皮浅层虽与健康对照无差异,但在深层均高于健康对照(Z=2.702,2.941,均P<0.01)。斑秃患者浅层血管周围LC与深层毛囊周围CD8+T细胞数量呈正相关(r=0.618,P<0.05),活动组浅层血管周围LC与深层毛囊周围CD8+T细胞数量分布呈正相关关系(r=0.795,P=0.01),非活动组浅层血管周LC与深层毛囊周围CD8+T细胞数量分布则无相关关系。结论斑秃患者皮损LC数量增加,且在活动期皮损升高更明显。活动期斑秃皮损中浅层血管周围LC与深层毛囊周围CD8+T细胞数量呈正相关,推测LC在斑秃疾病进展中发挥作用。
斑秃;郎格汉斯细胞;T淋巴细胞;CD1a蛋白
朗格汉斯细胞(LC)是来源于骨髓的免疫细胞,CD1a蛋白是其主要的细胞表面标志分子。研究显示,粒细胞巨噬细胞刺激因子(GM-CSF)可以促进CD1a的转录和翻译,促进和维持CD1a在表皮微环境中的表达[1],并和其他因素一起促进骨髓细胞分化成LC。我们研究LC在斑秃中的浸润特征,CD1a和GM-CSF mRNA在斑秃皮损中的表达,以期了解该细胞在斑秃皮损中的分布特点,并对CD4+、CD8+T细胞进行免疫染色并分析与CD1a分布的关系,从而了解LC和斑秃发病的关系。
对象与方法
一、对象
我院脱发专科2008年10月至2012年10月就诊的3个月内无外用或系统使用糖皮质激素及其他药物的29例斑秃患者,其中女16例,男13例,男女比例为0.8∶1;年龄6~52岁,平均(26.86±11.934)岁;发病年龄为6~52岁,平均(24.76±12.543)岁;病程6~120个月,平均(24.74±34.81)个月。脱发面积 1% ~ 100%(根据 Olsen/Canfield评分)[2], 平均(54.03±37.320)%。其中斑片型12例(41.4%),弥漫型 6 例(20.7%),亚全秃/全秃/普秃型 11 例(37.9%)。特应性病史(包括过敏性鼻炎、哮喘、湿疹等)8例(27.6%),有自身免疫疾病家族史1例,有斑秃家族史2例,甲改变9例。根据拉发试验分为活动组(13例)和非活动组(16例),特应性疾病组(8例)和非特应性疾病组(21例)。本研究经中山大学附属第一医院医学伦理委员会批准,患者签署知情同意书。
同时进行血清学检查(血细胞计数、IgE水平)及头皮病理活检。头皮取材方法:取斑秃患者头皮皮损边缘或对照组0.8 cm×1.0 cm组织,含完整毛囊结构,深及脂肪层。对照组织来自本院外科及皮肤科头皮手术所取皮疹边缘正常头皮,健康对照组均无脱发表现。将头皮组织分为两部分,一部分用4%甲醛固定后用特定方法进行包埋制片,另一部分在皮脂腺水平离断为头皮浅层和深层,分别提取RNA。
二、CD1a+、CD4+、CD8+细胞免疫组化染色
按照说明书操作。以试剂公司提供的阳性切片为阳性对照,以磷酸盐缓冲液(PBS)代替一抗作为阴性对照。对29例斑秃患者及13例健康对照(美容除皱手术患者)行CD1a(1∶200,美国RD Systems公司)免疫组化染色;并对13例斑秃患者行CD4(1∶50,北京中杉金桥生物技术有限公司)、CD8(1∶200,美国Epitomics-an Abcam公司)免疫组化染色。两位研究者分别对阳性结果进行判定:以皮脂腺水平为界分为浅层和深层,分别计数浅层血管和浅层毛囊包括皮脂腺水平以上毛囊表皮、毛囊周围以及皮脂腺阳性细胞数,深层血管和深层毛囊包括皮脂腺水平以下毛囊上皮、毛囊周围CD1a阳性细胞数。每例患者计数病理片中5个阳性率最高的高倍镜视野(×400)并取其平均数。
三、荧光半定量 PCR检测 CD1a、GM-SCF mRNA表达水平
引物设计:CD1a用德国Qiagen公司设计引物CATALOG NO:QT0000840;GM-CSF 用德国 Qiagen公司设计引物CATALOG NO:QT01676962。内参照为β肌动蛋白,上游引物5'-CTAAGTCATAGTCCG CCTAGAAGCA-3',下游引物5'-TGGCACCCAGCA CAATGAA-3'。斑秃患者及健康对照头皮在解剖显微镜下分为浅层(纤维组织)和深层(脂肪组织),分离出的斑秃患者纤维组织和脂肪组织参照Qiagen试剂盒步聚提取总RNA,按照Takara反转录试剂盒(DDR037A)逆转录为cDNA。反应条件如下:37℃15 min,85℃15 s,cDNA-20℃保存。CDNA的扩增反应体系及条件仪器为Bio-Rad iQ5,使用Takara试剂盒[00041A,宝生物工程(大连)有限公司],反应体 系 20 μl:SYBR Premix Ex Taq 酶 10 μl,Rox Reference DYE 0.4 μl,dH2O 6.2 μl,1.8 μl DNA 模板,上下游引物各0.8 μl;反应条件:预变性 95℃1 min,95℃5 s、62℃1min,共40个循环,95℃1 min,65℃30 s,72℃15 s,1个循环。
四、统计学方法
相关数据应用SPSS 16.0软件进行统计学分析,组间均值比较用非参数Mann Whitney U检验,连续数据的组间相关关系用Pearson correlation分析,P<0.05为差异有统计学意义。
结 果
一、LC的分布特点
1.正常头皮LC分布:正常头皮毛囊皮脂腺中LC主要分布于表皮和毛囊上部,包括漏斗部、皮脂腺导管和腺上皮,其分布密度类似于表皮(图1,表1)。而毛囊下部LC数量减少,且主要见于其上段的隆突部附近,毛球部几乎看不到LC。
2.斑秃皮损LC分布:斑秃皮损表皮、毛囊、皮脂腺中LC数量增多,分布位置向毛囊下部迁移。毛乳头和深层毛囊周围存在CD1a浸润。斑秃患者表皮、真皮浅层毛囊、深层毛囊和血管周围以及皮脂腺处CD1a阳性LC数量均较健康对照显著增加(Z=4.354,2.884,4.640,3.217,3.496,均P<0.01),见图1,表1。活动期皮损表皮层、真皮深层血管、深层毛囊CD1a阳性LC数量较非活动期皮损高(Z=2.457,2.130,1.954,P ≤ 0.05)。
3.LC数量与分布部位、临床资料的关系:表皮层CD1a阳性LC数量与浅层血管周围、浅层毛囊、深层血管、深层毛囊周围LC数量均呈正相关关系(r=0.411,0.460,0.478,0.399,P<0.01或0.05)。深层血管周围与深层毛囊LC数量呈正相关(r=0.630,P<0.01)。浅层血管周围与深层血管周围CD1a阳性LC数量呈正相关(r=0.642,P<0.01)。而浅层毛囊与深层毛囊CD1a阳性LC数量则无相关关系(r=0.304,P>0.05)。
斑秃患者CD1a阳性LC分布情况与临床资料相关关系分析结果显示,特应性与非特应性者、血清IgE升高与IgE正常者,血清嗜酸性粒细胞升高与嗜酸性粒细胞正常者,有甲改变与无甲改变者、有斑秃家族史与无斑秃家族史者、有自身免疫疾病家族史与无自身免疫疾病家族史者、不同脱发类型之间LC分布在表皮层、浅层血管周、浅层毛囊周、深层血管和深层毛囊周分布差异均无统计学意义(均P>0.05)。而各部位LC数量与年龄、发病年龄、病程、脱发面积等均无统计学相关性(均P>0.05)。
二、T细胞的分布特点
斑秃患者CD4+T、CD8+T细胞浸润主要见于深层毛囊周围,CD8+T细胞在斑秃患者深层毛囊多于浅层毛囊,差异有统计学意义(Z=2.429,P<0.05),而CD4+T细胞虽然深层毛囊多于浅层毛囊,但差异无统计学意义(P<0.05)。见表2。
三、T细胞数量分布与LC相关性分析
1.LC与CD4+T细胞:斑秃患者非活动组表皮层LC数量与深层血管周围、深层毛囊周围CD4+T细胞数量分别呈负相关关系(r=-0.573,-0.553,均P<0.05)。活动组浅层血管周围、深层血管周围、深层毛囊周围LC与CD4+T细胞数量分布无统计学相关性(均P>0.05)。
2.LC与CD8+T细胞:浅层血管周围LC与深层毛囊周围CD8+T细胞数量呈正相关关系(r=0.618,P<0.05),深层毛囊周围LC与浅层毛囊周围CD8+T分布呈正相关(r=0.570,P<0.05)。活动组浅层血管周围LC与深层毛囊周围CD8+T分布呈正相关(r=0.795,P=0.01),而在非活动组深层LC与浅层血管周围CD8+T分布呈正相关(r=0.812,P<0.05)。而浅层血管周围、浅层毛囊周围、深层血管周围、深层毛囊周围LC与CD8+T细胞数量分布无相关关系(均P>0.05)。
表1 不同部位朗格汉斯细胞(LC)在斑秃患者和健康对照头皮中的分布情况(±s)
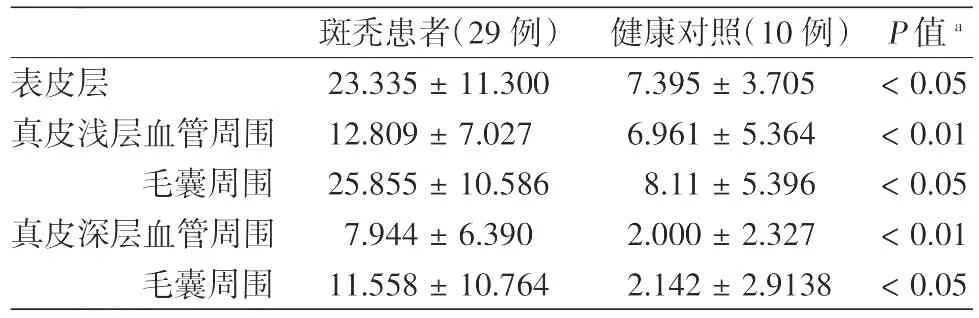
表1 不同部位朗格汉斯细胞(LC)在斑秃患者和健康对照头皮中的分布情况(±s)
注:a:斑秃患者和健康对照相同部位比较
斑秃患者(29例) 健康对照(10例) P值a表皮层 23.335±11.300 7.395±3.705 <0.05真皮浅层血管周围 12.809±7.027 6.961±5.364 <0.01毛囊周围 25.855±10.586 8.11±5.396 <0.05真皮深层血管周围 7.944±6.390 2.000±2.327 <0.01毛囊周围 11.558±10.764 2.142±2.9138 <0.05
表2 不同类型T细胞在17例斑秃患者真皮浅层和深层的分布情况(±s)

表2 不同类型T细胞在17例斑秃患者真皮浅层和深层的分布情况(±s)
注:a:浅层和深层相应部位比较
CD4+T细胞 CD8+T细胞浅层 深层 P值a 浅层 深层 P值a血管周围 15.00±9.72 12.28±10.10 >0.05 11.98±5.51 11.80±9.60 >0.05毛囊周围 17.73±10.52 23.16±20.40 >0.05 13.61±8.59 23.35±23.70 <0.05
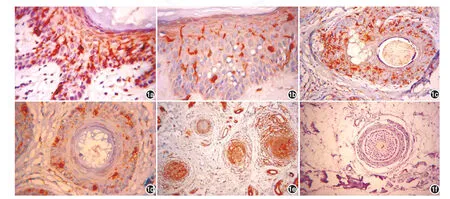
图1 CD1a阳性朗格汉斯细胞(LC)在斑秃皮损和健康对照的分布 1a:斑秃皮损表皮层(×400);1b:健康对照表皮层(×400);1c:斑秃皮损真皮浅层毛囊(×200);1d:健康对照真皮浅层毛囊(×200);1e:斑秃皮损深层毛囊(×100);1f:健康对照深层毛囊(×100)
四、CD1a和GM-CSF mRNA检测结果
斑秃患者皮损浅层CD1a mRNA表达量与健康对照差异无统计学意义(P>0.05),而深层CD1a mRNA表达量高于健康对照CD1a mRNA表达量(Z=2.702,P<0.01)。斑秃患者皮损深层GM-CSF mRNA表达量高于健康对照(Z=2.941,P<0.01),而皮损浅层与健康对照差异无统计学意义(P>0.05)。斑秃患者深层GM-CSF mRNA表达量高于浅层(Z=2.685,P<0.01)。脱发面积>75%的斑秃患者与脱发面积<75%的斑秃患者相比浅层GM-CSF mRNA表达量高(Z=2.839,P<0.01)。特应性体质患者与非特应性体质患者相比,GM-CSF mRNA表达量高(Z=2.733,P<0.01)。活动组GM-CSF mRNA表达量深层高于浅层(Z=2.252,P<0.05)。非活动组GM-CSF和CD1a mRNA在浅层和深层的表达量差异无统计学意义。
讨 论
斑秃是一种T细胞介导的针对生长期毛囊的自身免疫性炎症性疾病,其发病机制与毛囊免疫豁免解除有关,生长期毛囊是免疫豁免器官,部分上皮细胞处于免疫豁免状态,低表达MHCⅠ类分子,不表达MHCⅡ类分子[3]。在正常毛囊周围即有一定数量的LC,但由于毛囊不表达MHCⅡ类分子,故LC功能在正常状态下并不能被激活[4]。斑秃病理过程启动阶段可能是大量CD8+T细胞的聚集对毛囊MHCⅠ类分子表达异常升高的反应,而CD8+T细胞的激活又导致MHCⅡ类分子的表达,从而导致CD4+T细胞反应性地在毛囊周围大量聚集[5]。在这个过程中MHCⅡ类分子的表达,可能激活了LC的功能,斑秃病理也显示抗原呈递细胞如单核巨噬细胞和LC均可出现在生长不良的毛囊周围(这与毛囊自身抗原发生反应相一致),并且吸引更多抗原呈递细胞向炎症反应部位集中[6]。LC和树突细胞将凋亡导致的自身抗原提呈给T细胞并激发自身免疫反应[6-8]。当皮损部位毛囊退行性变广泛而迅速时,与之相关的淋巴细胞浸润将相应地激活并导致自身免疫反应[6-8]。
本研究发现,斑秃患者无论在表皮、真皮浅层还是真皮深层LC的数量都较健康对照高,且其CD1a mRNA的表达量在皮肤深层较健康对照高。同时我们发现健康对照LC主要集中于皮脂腺开口处以上及其附近毛囊漏斗部、隆突部以及皮脂腺上皮中,而毛囊下部和毛球部位LC数目明显减少,这与既往研究一致[9]。而在斑秃患者,我们发现不仅在表皮浅层、皮脂腺开口部位以上毛囊漏斗部、隆突部有大量LC,还在真皮浅层血管周围也存在大量LC浸润,而在真皮深层皮脂腺开口以下,LC主要集中存在于有大量炎症细胞浸润的毛囊周围。有趣的是,真皮浅层和深层血管周围的LC数量呈正相关,且浅层血管周围与浅层毛囊周围、深层血管周围与深层毛囊LC浸润数量均呈正相关。另外,斑秃患者无论是浅层毛囊还是真皮浅层血管周围LC数量都高于深层毛囊、深层血管周围,这可能与正常毛囊在皮脂腺水平以上即有相当部分CD1a阳性LC相关[9],同时也说明真皮浅层血管周围LC浸润有其重要性,至于此处LC的功能尚待进一步研究。
然而,斑秃患者CD1a mRNA相对仅只有真皮深层高于健康对照,可能是真皮深层疾病活动持续时间长而浅层持续时间短,浅层mRNA在升高并引起蛋白表达后已经恢复正常[10]。促进CD1a转录和翻译的GM-CSF mRNA在斑秃深层表达量增高,这与CD1a mRNA的表达一致,且在活动组深层GMCSF mRNA升高,脱发面积大者,mRNA水平越高,提示GM-CSF与疾病活动性和严重性相关,它的升高可引起CD1a表达继发性升高,故CD1a的表达可能与疾病活动性和严重程度也相关。
许多研究显示LC浸润与T细胞浸润呈正相关,而本研究浅层血管周围LC与深层毛囊周围CD8+T数量分布呈正相关关系,且活动组浅层血管周围LC与深层毛囊周围CD8+T细胞分布也呈正相关,而非活动组则没有这种相关关系。LC在真皮浅层浸润可以引起LC数量相对缺乏的真皮深层的CD8+T细胞激活[11]。本研究中,我们发现浅层血管周围LC与深层毛囊周围CD8+T细胞数量呈正相关关系,在活动性斑秃患者尤甚明显,提示浅层LC可能与提呈抗原给CD8+T细胞和激活细胞毒性CD8+T细胞相关。我们在研究LC与T细胞浸润相关时病例数较少可能之造成偏倚,需待进一步扩大样本进行研究。
[1]Mohamadzadeh M,Berard F,Essert G,et al.Interleukin 15 skews monocyte differentiation into dendritic cells with features of Langerhans cells[J].J Exp Med,2001,194(7):1013-1020.
[2]King LE Jr,McElwee KJ,Sundberg JP.Alopecia areata[J].Curr Dir Autoimmun,2008,10:280-312.
[3]Paus R,Nickoloff BJ,Ito T.A ‘hairy‘privilege[J].Trends Immunol,2005,26(1):32-40.
[4]Christoph T,Müller-Röver S,Audring H,et al.The human hair follicle immune system:cellularcomposition and immune privilege[J].Br J Dermatol,2000,142(5):862-873.
[5]Gilhar A,Landau M,Assy B,et al.Mediation of alopecia areata by cooperation between CD4+and CD8+T lymphocytes:transfer to human scalp explants on Prkdc(scid)mice [J].Arch Dermatol,2002,138(7):916-922.
[6]Ueno H,Klechevsky E,Morita R,et al.Dendritic cell subsets in health and disease[J].Immunol Rev,2007,219(1):118-142.
[7]Albert ML,Sauter B,Bhardwaj N.Dendritic cells acquire antigen from apoptotic cells and induce class I-restricted CTLs[J].Nature,1998,392(6671):86-89.
[8]Mehling A,Beissert S.Dendritic cells under investigation in autoimmune disease[J].Crit Rev Biochem Mol Biol,2003,38(1):1-21.
[9]杨海平,桑红桂,方方,等.正常皮肤毛囊中朗格汉斯细胞的定位、定量观察[J].临床皮肤科杂志,1999,28(2):84-86.
[10]Quaresma JA,Unger D,Pagliari C,et al.Immunohistochemical study of Langerhans cells in cutaneous lesions of the Jorge Lobo's disease[J].Acta Trop,2010,114(1):59-62.
[11]Wakim LM,Bevan MJ.Cross-dressed dendritic cells drive memory CD8+T-cell activation after viral infection [J].Nature,2011,471(7340):629-632.
2013-05-05)
(本文编辑:尚淑贤)
Quantity and distribution of Langerhans cells and CD8+T cells in lesions of alopecia areata
Zhang Xiaoting,Li Shuifeng,Zhao Ying,Ye Yanting,Qi Shiling,Yang Yuqing,Cao Hui,Zhang Xingqi*.*Department of Dermatology and Venereology,First Affiliated Hospital,Sun Yat-sen University,Guangzhou 510080,China
Zhang Xingqi,Email:xingqi.zhang@hotmail.com
ObjectiveTo analyze the quantity and distribution of Langerhans cells in lesions of alopecia areata(AA),so as to investigate their role in the pathological process of AA as well as their relationship with T lymphocytes.MethodsTissue specimens were obtained from the scalp lesions of AA in 29 patients,including 16 in active phase and 13 in non-active phase.All the specimens were subjected to immunohistochemical staining for CD1a,and 17 specimens to immunohistochemical staining for CD4 and CD8.Fluorescence-based semi-quantitative reverse transcription(RT)-PCR was performed to determine the mRNA expressions of CD1a and granulocytemacrophage colony stimulating factor(GM-CSF)in the full-thickness skin specimens.Statistical analysis was done using Mann Whitney U test and Pearson correlation analysis.ResultsThere was a significant increase in the quantity of CD1a+Langerhans cells in the epidermis,perivascular and perifollicular areas in the upper and deep dermis of the AA patients compared with the healthy controls(Z=4.354,2.884,4.640,3.217,3.496,allP < 0.01),and in the epidermis,perivascular and perifollicular areas in the deep dermis of AA patients in active phase compared with those in non-active phase(Z=2.457,2.130,1.954,P < 0.05 or=0.05).The relative mRNA expression levels of CD1a and GM-CSF in the patients were similar to the healthy controls in the upper dermis,but significantly higher than the healthy controls in the deep dermis(Z=2.702,2.941,bothP < 0.01).A positive correlation was observed between the quantity of perivascular Langerhans cells in the upper dermis and that of perifollicular CD8+T lymphocytes in the deep dermis in patients with AA(r=0.618,P < 0.05)and in patients with active AA(r=0.795,P=0.01),but not in patients with inactive AA(r=0.304,P > 0.05).ConclusionsThe number of Langerhans cells is elevated in patients with AA,especially in patients with active AA.The quantity of perivascular Langerhans cells in the upper dermis is positively correlated with that of perifollicular CD8+T lymphocytes in the deep dermis of active AA lesions,hinting that Langerhans cells play an important role in the progression of AA.
Alopecia areata;Langerhans cells;T-lymphocytes;CD1a protein
10.3760/cma.j.issn.0412-4030.2014.01.010
510080广州,中山大学附属第一医院皮肤性病科[张小婷(现在温州医科大学第二附属医院皮肤性病科,325000)、李水凤、叶艳婷、戚世玲、杨雨清、曹慧、章星琪];山东菏泽市立医院皮肤科(赵莹)
章星琪,Email:xingqi.zhang@hotmail.com

